名校
解题方法
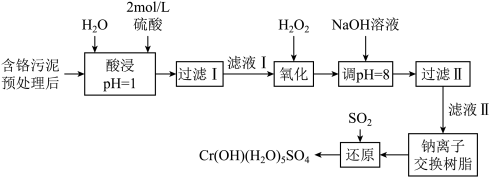
1 . 利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
已知:
①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Ca2+和Mg2+;
② ;
;
③常温下,部分金属离子以氢氧化物形式沉淀时溶液的 如表:
如表:
回答下列问题:
(1)“酸浸”时,为了提高浸取率,可采取的措施有_______ (写出两条)。
(2)在实验室进行“过滤”操作时所用玻璃仪器除烧杯外,还需要_______ 。
(3)H2O2的作用是将滤液I中的Cr3+转化为 该反应的离子方程式为
该反应的离子方程式为_______ 。
(4)加入NaOH溶液调节溶液pH=8,既可以将溶液中某些杂质离子转化为沉淀,同时又可以将 转化为
转化为_______ (填离子符号),当溶液的pH处于8.0~9.6范围内时,沉淀的主要成分为_______ (填化学式)。
(5)钠离子交换树脂的反应原理为 ,则利用钠离子交换树脂可除去的滤液Ⅱ中的金属阳离子有
,则利用钠离子交换树脂可除去的滤液Ⅱ中的金属阳离子有_______ (填离子符号,下同)。交换后溶液中浓度明显增大的离子为_______ 。

已知:
①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Ca2+和Mg2+;
②
 ;
;③常温下,部分金属离子以氢氧化物形式沉淀时溶液的
 如表:
如表:| 金属离子 | Fe3+ | Mg2+ | Ca2+ | Cr3+ |
| 开始沉淀时的pH | 2.2 | 9.6 | 10.8 | 4.6 |
| 沉淀完全时的pH | 3.7 | 11.6 | 12 | 5.9 |
(1)“酸浸”时,为了提高浸取率,可采取的措施有
(2)在实验室进行“过滤”操作时所用玻璃仪器除烧杯外,还需要
(3)H2O2的作用是将滤液I中的Cr3+转化为
 该反应的离子方程式为
该反应的离子方程式为(4)加入NaOH溶液调节溶液pH=8,既可以将溶液中某些杂质离子转化为沉淀,同时又可以将
 转化为
转化为(5)钠离子交换树脂的反应原理为
 ,则利用钠离子交换树脂可除去的滤液Ⅱ中的金属阳离子有
,则利用钠离子交换树脂可除去的滤液Ⅱ中的金属阳离子有
您最近一年使用:0次
真题
名校
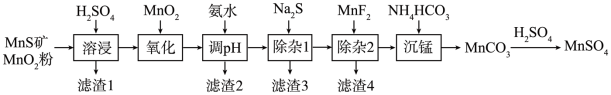
2 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
(1)“滤渣1”含有S和__________________________ ;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________ 。
(2)“氧化”中添加适量的MnO2的作用是将________________________ 。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______ ~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________ 。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________ 。
(6)写出“沉锰”的离子方程式___________________________________________________ 。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y= 时,z=
时,z=___________ 。
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和
(2)“氧化”中添加适量的MnO2的作用是将
(3)“调pH”除铁和铝,溶液的pH范围应调节为
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(6)写出“沉锰”的离子方程式
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=
 时,z=
时,z=
您最近一年使用:0次
2019-06-09更新
|
19599次组卷
|
29卷引用:黑龙江省大庆市第四中学2020届高三下学期4月月考理综化学试题
黑龙江省大庆市第四中学2020届高三下学期4月月考理综化学试题黑龙江省七台河市勃利县高级中学2022-2023学年高三上学期11月期中考试化学试题2019年全国统一高考化学试题(新课标Ⅲ)河北省张家口市第四中学2018-2019学年高二下学期6月月考理科综合化学试题 河北省辛集中学2020届高三上学期入学考试化学试题安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题甘肃省高台县第一中学2020届高三上学期期中考试化学试题山东省滕州市第一中学2020届高三3月线上模拟考试化学试题(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训河北省承德市围场卉原中学2020届高三模拟自测联考试卷理综化学试卷2020届四川省成都市第七中学高三三月份网络教学质量监测卷化学试题(已下线)专题6.1 无机化工流程题(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升四川省宜宾市叙州区第一中学校2020届高三下学期第四学月考试理综化学试题四川省宜宾市叙州区第二中学校2020届高三第一次高考适应性考试理综化学试题河南省信阳市罗山县2021届高三第一次调研(8月联考)化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三章素养检测(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)江西省宜春市第九中学2021-2022学年高三上学期10月月考化学试题天津市第二十五中学2021-2022学年高三上学期第一次月考化学试题(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)四川省泸州市泸县第五中学2022届高三高考适应性考试理综化学试题(已下线)专题18 工艺流程题(已下线)T26-工业流程题陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题河南省济源市高级中学2023-2024学年高三上学期高考模拟检测(10月)理科综合试题-高中化学



