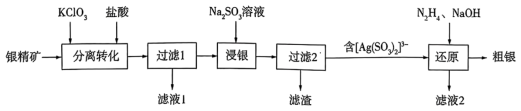
1 . 以银精矿(主要成分为Ag2S、FeS2、ZnS)为原料采用“预氧化湿法提银”工艺流程如下: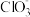 有较强的氧化性,被还原为Cl-。
有较强的氧化性,被还原为Cl-。
(1)“分离转化”时,为提高 的转化率可采取的措施是
的转化率可采取的措施是___________ ; 转化为AgCl和S的化学方程式为
转化为AgCl和S的化学方程式为___________ 。
(2)已知: ,
,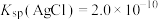 ,若不加KClO3,直接加氯化物,依据反应
,若不加KClO3,直接加氯化物,依据反应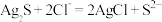 ,能否实现此反应较完全转化?并说明理由:
,能否实现此反应较完全转化?并说明理由:___________ 。
(3)滤液1中的金属阳离子有___________ 。在整个工艺中可循环利用的物质是___________ 。
(4)“浸银”时,发生反应的离子方程式为___________ 。
(5)“分离转化”时,除上述方法外也可以使用过量FeCl3、HCl和 的混合液作为浸出剂,将Ag2S中的银以
的混合液作为浸出剂,将Ag2S中的银以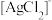 形式浸出,建立化学平衡状态。请解释浸出剂中
形式浸出,建立化学平衡状态。请解释浸出剂中 、H⁺的作用
、H⁺的作用___________ 。
(6)还原过程中所用的N2H4,分子可能有两种不同的构象——顺式和反式,沿N—N键轴方向的投影如下图所示,其中(a)为反式,(b)为顺式。测得 分子极性很大,说明它具有
分子极性很大,说明它具有___________ 构象(填“反式”或“顺式”)。
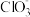 有较强的氧化性,被还原为Cl-。
有较强的氧化性,被还原为Cl-。(1)“分离转化”时,为提高
 的转化率可采取的措施是
的转化率可采取的措施是 转化为AgCl和S的化学方程式为
转化为AgCl和S的化学方程式为(2)已知:
 ,
,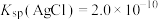 ,若不加KClO3,直接加氯化物,依据反应
,若不加KClO3,直接加氯化物,依据反应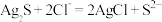 ,能否实现此反应较完全转化?并说明理由:
,能否实现此反应较完全转化?并说明理由:(3)滤液1中的金属阳离子有
(4)“浸银”时,发生反应的离子方程式为
(5)“分离转化”时,除上述方法外也可以使用过量FeCl3、HCl和
 的混合液作为浸出剂,将Ag2S中的银以
的混合液作为浸出剂,将Ag2S中的银以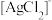 形式浸出,建立化学平衡状态。请解释浸出剂中
形式浸出,建立化学平衡状态。请解释浸出剂中 、H⁺的作用
、H⁺的作用(6)还原过程中所用的N2H4,分子可能有两种不同的构象——顺式和反式,沿N—N键轴方向的投影如下图所示,其中(a)为反式,(b)为顺式。测得
 分子极性很大,说明它具有
分子极性很大,说明它具有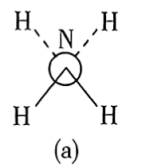
您最近半年使用:0次
7日内更新
|
79次组卷
|
2卷引用:东北三省四市教研联合体2024届高三下学期高考模拟(二)化学试题
2 . 应用(CO2催化加氢规模化生产甲醇是综合利用(CO2,实现“碳达峰”的有效措施之一、我国科学家研究发现二氧化碳电催化还原制甲醇的反应
 ,需通过以下两步实现:
,需通过以下两步实现:
I.

II.

(1)反应过程中各物质的相对能量变化情况如图所示: =
=___________ ,反应是快反应___________ (填“Ⅰ”或“Ⅱ”)
(2)若
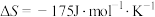 ,下列温度下反应能自发进行的是___________(填序号)。
,下列温度下反应能自发进行的是___________(填序号)。
(3)已知反应 ,在540K下,按初始投料
,在540K下,按初始投料 、
、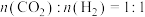 ,
, ,得到不同压强条件下H2的平衡转化率关系图:
,得到不同压强条件下H2的平衡转化率关系图:___________ (用字母表示)。
②N点在b曲线上,540K时的压强平衡常数Kp=___________ (MPa)-2(用平衡分压计算)。
(4)恒压下,分别向无分子筛膜和有分子筛膜(能选择性分离出)H?O)的两个同体积容器中通入1mol CO2和3mol H2,温度相同时,有分子筛膜的容器中甲醇的产率大于无分子筛膜的原因为___________ 。
(5)通过设计燃料电池,可以将甲醇中蕴藏的能量释放出来,酸性电解质溶液中,甲醇在电极上反应,产生碳氧化物COx。请写出燃料电池负极反应方程式___________ 。

 ,需通过以下两步实现:
,需通过以下两步实现:I.


II.


(1)反应过程中各物质的相对能量变化情况如图所示:

 =
=(2)若

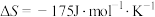 ,下列温度下反应能自发进行的是___________(填序号)。
,下列温度下反应能自发进行的是___________(填序号)。| A.0℃ | B.70℃ | C.150℃ | D.280°C |
(3)已知反应
 ,在540K下,按初始投料
,在540K下,按初始投料 、
、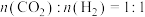 ,
, ,得到不同压强条件下H2的平衡转化率关系图:
,得到不同压强条件下H2的平衡转化率关系图:
②N点在b曲线上,540K时的压强平衡常数Kp=
(4)恒压下,分别向无分子筛膜和有分子筛膜(能选择性分离出)H?O)的两个同体积容器中通入1mol CO2和3mol H2,温度相同时,有分子筛膜的容器中甲醇的产率大于无分子筛膜的原因为
(5)通过设计燃料电池,可以将甲醇中蕴藏的能量释放出来,酸性电解质溶液中,甲醇在电极上反应,产生碳氧化物COx。请写出燃料电池负极反应方程式
您最近半年使用:0次
2024·黑龙江·模拟预测
解题方法
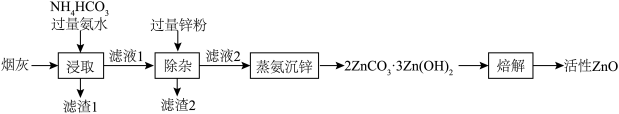
3 . 活性ZnO俗名锌白,用作白色颜料,也广泛用于生产玻璃、橡胶、油漆、塑料等。利用化工厂产生的烟灰(ZnO,还含有少量CuO、MnO2、FeO等杂质)制备活性ZnO的工艺流程如图。
(1)Zn的基态价电子排布式为___________ ,烟灰中的主要成分ZnO发生反应的化学方程式为___________ ,滤渣1的主要成分为___________ 。
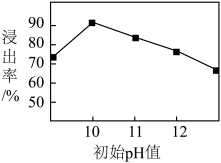
(2)锌元素的浸出率随浸出液初始pH的变化关系如图所示,当浸出液初始pH大于10时,浸出率随pH增大而减小的原因是___________ 。 也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式
也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式___________ 。
(4)“蒸氨”时会出现白色固体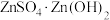 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:___________ 。
(5)从m kg烟灰中得到活性ZnO akg,则ZnO的回收率___________ (填“小于”、“大于”或“等于”)100%。
(6)已知 和
和 的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌
的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌 时测得的固体残留率随温度的变化关系如图所示。
时测得的固体残留率随温度的变化关系如图所示。___________ (填化学式)。
②经焙解得到的活性ZnO晶胞结构如图所示。该晶胞中Zn原子的配位数为___________ 。
(1)Zn的基态价电子排布式为
(2)锌元素的浸出率随浸出液初始pH的变化关系如图所示,当浸出液初始pH大于10时,浸出率随pH增大而减小的原因是
 也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式
也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式(4)“蒸氨”时会出现白色固体
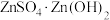 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:(5)从m kg烟灰中得到活性ZnO akg,则ZnO的回收率
(6)已知
 和
和 的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌
的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌 时测得的固体残留率随温度的变化关系如图所示。
时测得的固体残留率随温度的变化关系如图所示。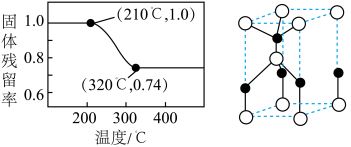
②经焙解得到的活性ZnO晶胞结构如图所示。该晶胞中Zn原子的配位数为
您最近半年使用:0次
名校
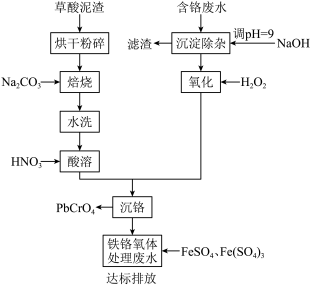
4 . 铬酸铅俗称铬黄,主要用于油漆、油墨、塑料以及橡胶等行业。一种以含铬废水(含Cr3+、Fe3+、Cu2+)和草酸泥渣(含草酸铅、硫酸铅)为原料制备铬酸铅的工艺流程如下:
回答下列问题
(1)草酸泥渣“粉碎”的目的是___________ ,“焙烧”时加入碳酸钠是为了将硫酸铅转化为PbO,同时放出CO2,该转化过程的化学方程式为___________ 。
(2)滤渣的主要成分为___________ 、___________ 。(填化学式)
(3)“沉淀除杂”所得滤液中含铬化合物主要为___________ 。(填化学式)
(4)“氧化”工序中发生反应的离子方程式为___________ 。
(5)为了提高沉铬率,用平衡移动原理解释“酸溶”过程中所加硝酸不能过量的原因:___________ 。
(6)处理含 的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为___________ mol。

回答下列问题
(1)草酸泥渣“粉碎”的目的是
(2)滤渣的主要成分为
(3)“沉淀除杂”所得滤液中含铬化合物主要为
(4)“氧化”工序中发生反应的离子方程式为
(5)为了提高沉铬率,用平衡移动原理解释“酸溶”过程中所加硝酸不能过量的原因:
(6)处理含
 的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
您最近半年使用:0次
2024-04-13更新
|
220次组卷
|
4卷引用:东北三省四市2024届高三教研联合体高考模拟(一)化学试卷
东北三省四市2024届高三教研联合体高考模拟(一)化学试卷(已下线)东北三省四城市联考暨沈阳市高三下学期质量监测(二)化学试题东北三省四城市联考暨沈阳市高三下学期质量监测(二)化学试题2024届江西省吉安市第一中学高三下学期一模化学试题
名校
解题方法
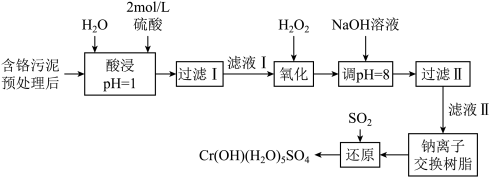
5 . 利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
已知:
①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Ca2+和Mg2+;
② ;
;
③常温下,部分金属离子以氢氧化物形式沉淀时溶液的 如表:
如表:
回答下列问题:
(1)“酸浸”时,为了提高浸取率,可采取的措施有_______ (写出两条)。
(2)在实验室进行“过滤”操作时所用玻璃仪器除烧杯外,还需要_______ 。
(3)H2O2的作用是将滤液I中的Cr3+转化为 该反应的离子方程式为
该反应的离子方程式为_______ 。
(4)加入NaOH溶液调节溶液pH=8,既可以将溶液中某些杂质离子转化为沉淀,同时又可以将 转化为
转化为_______ (填离子符号),当溶液的pH处于8.0~9.6范围内时,沉淀的主要成分为_______ (填化学式)。
(5)钠离子交换树脂的反应原理为 ,则利用钠离子交换树脂可除去的滤液Ⅱ中的金属阳离子有
,则利用钠离子交换树脂可除去的滤液Ⅱ中的金属阳离子有_______ (填离子符号,下同)。交换后溶液中浓度明显增大的离子为_______ 。

已知:
①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Ca2+和Mg2+;
②
 ;
;③常温下,部分金属离子以氢氧化物形式沉淀时溶液的
 如表:
如表:| 金属离子 | Fe3+ | Mg2+ | Ca2+ | Cr3+ |
| 开始沉淀时的pH | 2.2 | 9.6 | 10.8 | 4.6 |
| 沉淀完全时的pH | 3.7 | 11.6 | 12 | 5.9 |
(1)“酸浸”时,为了提高浸取率,可采取的措施有
(2)在实验室进行“过滤”操作时所用玻璃仪器除烧杯外,还需要
(3)H2O2的作用是将滤液I中的Cr3+转化为
 该反应的离子方程式为
该反应的离子方程式为(4)加入NaOH溶液调节溶液pH=8,既可以将溶液中某些杂质离子转化为沉淀,同时又可以将
 转化为
转化为(5)钠离子交换树脂的反应原理为
 ,则利用钠离子交换树脂可除去的滤液Ⅱ中的金属阳离子有
,则利用钠离子交换树脂可除去的滤液Ⅱ中的金属阳离子有
您最近半年使用:0次
名校
解题方法
6 . 利用某矿渣(含 )制备
)制备 的工艺流程如下:
的工艺流程如下:

已知:① ;
;
②
 。
。
回答下列问题:
(1)为提高焙烧效率可采取的操作有___________ (至少写两条,温度改变除外)。
(2)“滤液”中 元素的主要存在形式为
元素的主要存在形式为 ,“焙烧”时
,“焙烧”时 发生反应的化学方程式为
发生反应的化学方程式为___________ ;“滤渣”的主要成分为___________ 。
(3)“调 ”后溶液中
”后溶液中 的浓度是
的浓度是 ,则
,则 的浓度是
的浓度是___________  。
。
(4)在“转化”过程中淀粉水解液起___________ 作用。
(5)室温下,加入石灰乳调节 ,当
,当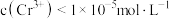 时,
时,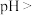
___________ 。
 )制备
)制备 的工艺流程如下:
的工艺流程如下:
已知:①
 ;
;②

 。
。回答下列问题:
(1)为提高焙烧效率可采取的操作有
(2)“滤液”中
 元素的主要存在形式为
元素的主要存在形式为 ,“焙烧”时
,“焙烧”时 发生反应的化学方程式为
发生反应的化学方程式为(3)“调
 ”后溶液中
”后溶液中 的浓度是
的浓度是 ,则
,则 的浓度是
的浓度是 。
。(4)在“转化”过程中淀粉水解液起
(5)室温下,加入石灰乳调节
 ,当
,当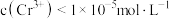 时,
时,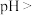
您最近半年使用:0次
2023-12-03更新
|
230次组卷
|
4卷引用:黑龙江省齐齐哈尔市2023-2024学年高二上学期1月期末化学试题
7 . 元素铬 在溶液中主要以
在溶液中主要以 (蓝紫色)、
(蓝紫色)、 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色)等形式存在。
(黄色)等形式存在。 为难溶于水的灰蓝色固体,可与强酸、强碱反应。回答下列问题:
为难溶于水的灰蓝色固体,可与强酸、强碱反应。回答下列问题:
(1)在 溶液中逐滴加入
溶液中逐滴加入 溶液直至过量,可观察到的现象是
溶液直至过量,可观察到的现象是___________ 。
(2) 和
和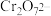 在溶液中可相互转化
在溶液中可相互转化 。室温下,初始浓度为
。室温下,初始浓度为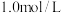 的
的 溶液中
溶液中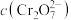 随
随 的变化如图所示。
的变化如图所示。

①由图可知,溶液酸性增强, 的平衡转化率
的平衡转化率___________ (填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为___________ 。
②升高温度,溶液中 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
___________ 0(填“>”、“<”或“=”)。
(3)+6价铬的化合物毒性较大,常用 将废液中的
将废液中的 还原成
还原成 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
 在溶液中主要以
在溶液中主要以 (蓝紫色)、
(蓝紫色)、 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色)等形式存在。
(黄色)等形式存在。 为难溶于水的灰蓝色固体,可与强酸、强碱反应。回答下列问题:
为难溶于水的灰蓝色固体,可与强酸、强碱反应。回答下列问题:(1)在
 溶液中逐滴加入
溶液中逐滴加入 溶液直至过量,可观察到的现象是
溶液直至过量,可观察到的现象是(2)
 和
和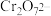 在溶液中可相互转化
在溶液中可相互转化 。室温下,初始浓度为
。室温下,初始浓度为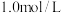 的
的 溶液中
溶液中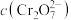 随
随 的变化如图所示。
的变化如图所示。
①由图可知,溶液酸性增强,
 的平衡转化率
的平衡转化率②升高温度,溶液中
 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
(3)+6价铬的化合物毒性较大,常用
 将废液中的
将废液中的 还原成
还原成 ,该反应的离子方程式为
,该反应的离子方程式为
您最近半年使用:0次
8 . I.二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ· mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
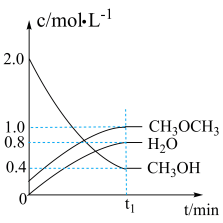
(1)在t1℃时,达到平衡时n(CH3OCH3) ∶n(CH3OH) ∶n(H2O)=___________ 。
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.4 mol·L-1、c(H2O)=0.6 mol·L-1、c(CH3OCH3)=2.4 mol·L-1,此时正、逆反应速率的大小:v正___________ v逆(填“>”、“<”或“=”),反应向___________ 反应方向进行(填“正”或“逆”)。
II.已知可逆反应:M(g)+N(g)⇌P(g)+Q(g) ΔH>0,请回答下列问题:
(3)在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1.达到平衡后,M的转化率为60%,此时N的转化率为___________ 。
(4)若反应温度升高,M的转化率___________ (填“增大”、“减小”或“不变”)。
(5)若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=amol·L-1;达到平衡后,c(P)=2 mol·L-1,a=___________ 。

(1)在t1℃时,达到平衡时n(CH3OCH3) ∶n(CH3OH) ∶n(H2O)=
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.4 mol·L-1、c(H2O)=0.6 mol·L-1、c(CH3OCH3)=2.4 mol·L-1,此时正、逆反应速率的大小:v正
II.已知可逆反应:M(g)+N(g)⇌P(g)+Q(g) ΔH>0,请回答下列问题:
(3)在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1.达到平衡后,M的转化率为60%,此时N的转化率为
(4)若反应温度升高,M的转化率
(5)若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=amol·L-1;达到平衡后,c(P)=2 mol·L-1,a=
您最近半年使用:0次
22-23高二上·山西·期末
名校
解题方法
9 . 硫酸锌是一种重要的工业原料,ZnSO4∙H2O可用于制造印染用的媒染剂,木材及皮革保存剂等。以炼锌厂锌渣为原料,含ZnO、FeO、CuO、CdO等,生产ZnSO4∙H2O的流程如下:
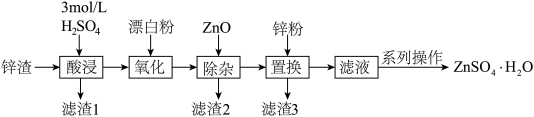
已知:①当溶液中剩余离子浓度小于1×10-5 mol∙L-1时,认为生成沉淀的反应进行完全;
②常温下,Ksp[Fe(OH)3]= 4.0×10-38,Ksp[Fe(OH)2]= 4.9×10-17,Ksp[Cu(OH)2]= 2.2×10-20,Ksp[Zn(OH)2]=1×10-17。
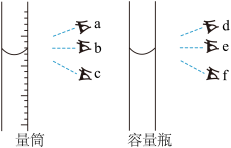
(1)“酸浸”时,需不断通入高温水蒸气,其目的是___________ (填字母)。用18 mol∙L-1的浓硫酸配制3 mol∙L-1H2SO4溶液,下列操作会使所配溶液浓度偏小的是___________ (填字母)。
(2)结合必要的化学反应方程式,从平衡角度解释加入ZnO得到滤渣2的原理:___________ 。除杂过程中,若控制pH=4,溶液中c(Fe3+)=___________ mol∙L-1。结合实际生产情况一般取pH4.5~5.0,pH不宜过大的原因是___________ 。
(3)滤渣3含有Zn和___________ (写化学式)。
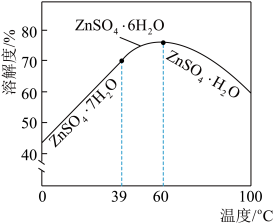
(4)硫酸锌晶体的溶解度与温度的变化如图所示。“系列操作”是:___________ ,洗涤、干燥。

已知:①当溶液中剩余离子浓度小于1×10-5 mol∙L-1时,认为生成沉淀的反应进行完全;
②常温下,Ksp[Fe(OH)3]= 4.0×10-38,Ksp[Fe(OH)2]= 4.9×10-17,Ksp[Cu(OH)2]= 2.2×10-20,Ksp[Zn(OH)2]=1×10-17。
(1)“酸浸”时,需不断通入高温水蒸气,其目的是

(2)结合必要的化学反应方程式,从平衡角度解释加入ZnO得到滤渣2的原理:
(3)滤渣3含有Zn和
(4)硫酸锌晶体的溶解度与温度的变化如图所示。“系列操作”是:

您最近半年使用:0次
2023-01-08更新
|
285次组卷
|
3卷引用:黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(21-24)
(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(21-24)山西省名校联考2022-2023学年高二上学期期末考试化学试题福建省宁德市2022-2023学年高二上学期期末居家检测化学试题
名校
10 . 硫酸镍广泛应用于电镀、电池、催化剂等工业。某科研小组以粗硫酸镍(含Cu2+、Fe3+、Ca2+、Mg2+、Zn2+等)为原料,经如图一系列除杂过程模拟精制硫酸镍工艺。
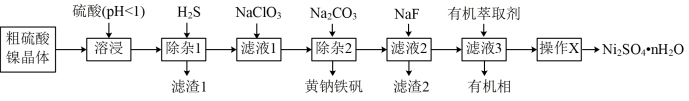
部分阳离子以硫化物的形式完全沉淀时溶液的pH见表。
回答下列问题:
(1)“溶浸”工序为了提高浸出率,可以采取的措施有____ 。(写出一条即可)
(2)“滤渣1”的主要成分为____ 。
(3)“滤液1”中加入NaClO3溶液,发生反应的离子方程式为____ 。
(4)“滤液2”中加入NaF可将滤液中Ca2+、Mg2+转化为难溶的CaF2和MgF2。已知CaF2与MgF2的Ksp分别为1.6×10-11、6.4×10-9,要使Ca2+和Mg2+均完全沉淀(离子浓度小于1×10-5mol/L),溶液中c(F-)须不低于____ mol/L。(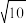 =3.16)
=3.16)
(5)“滤液3”中加入有机萃取剂后,Zn2+与有机萃取剂(用HA表示)形成易溶于萃取剂的络合物ZnA2·2HA。该过程可以表示为;Zn2++4HA ZnA2·2HA+2H+。已知加入萃取剂后,锌的萃取率随溶液pH变化如图所示。试分析pH增大时,锌的萃取率逐渐增大的原因是
ZnA2·2HA+2H+。已知加入萃取剂后,锌的萃取率随溶液pH变化如图所示。试分析pH增大时,锌的萃取率逐渐增大的原因是____ 。

(6)将萃取后所得富含硫酸镍的溶液经操作X可得硫酸镍晶体,则操作X为____ 、____ ,过滤、洗涤等。
(7)NiSO4在强碱溶液中和NaClO反应,可制得碱性镍镉电池电极材料NiOOH。该反应的离子方程式为____ 。

部分阳离子以硫化物的形式完全沉淀时溶液的pH见表。
| 沉淀物 | CuS | ZnS | FeS | NiS |
| pH | ≥-0.42 | ≥2.5 | ≥7 | ≥7.5 |
(1)“溶浸”工序为了提高浸出率,可以采取的措施有
(2)“滤渣1”的主要成分为
(3)“滤液1”中加入NaClO3溶液,发生反应的离子方程式为
(4)“滤液2”中加入NaF可将滤液中Ca2+、Mg2+转化为难溶的CaF2和MgF2。已知CaF2与MgF2的Ksp分别为1.6×10-11、6.4×10-9,要使Ca2+和Mg2+均完全沉淀(离子浓度小于1×10-5mol/L),溶液中c(F-)须不低于
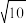 =3.16)
=3.16)(5)“滤液3”中加入有机萃取剂后,Zn2+与有机萃取剂(用HA表示)形成易溶于萃取剂的络合物ZnA2·2HA。该过程可以表示为;Zn2++4HA
 ZnA2·2HA+2H+。已知加入萃取剂后,锌的萃取率随溶液pH变化如图所示。试分析pH增大时,锌的萃取率逐渐增大的原因是
ZnA2·2HA+2H+。已知加入萃取剂后,锌的萃取率随溶液pH变化如图所示。试分析pH增大时,锌的萃取率逐渐增大的原因是
(6)将萃取后所得富含硫酸镍的溶液经操作X可得硫酸镍晶体,则操作X为
(7)NiSO4在强碱溶液中和NaClO反应,可制得碱性镍镉电池电极材料NiOOH。该反应的离子方程式为
您最近半年使用:0次



