1 . 二氧化铈 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: 能与
能与 结合成
结合成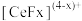 ,也能与
,也能与 结合成
结合成 ;
;
②在硫酸体系中 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。
回答下列问题:
(1)氧化焙烧中氧化的目的是_______ 。
(2)“萃取”时存在反应: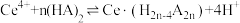 ,如图中D是分配比,表示
,如图中D是分配比,表示 分别在有机层中与水层中存在形式的物质的量浓度之比
分别在有机层中与水层中存在形式的物质的量浓度之比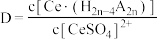 保持其它条件不变,若在起始料液中加入不同量的
保持其它条件不变,若在起始料液中加入不同量的 以改变水层中的
以改变水层中的 ,请解释D随起始料液中
,请解释D随起始料液中 变化的原因:
变化的原因:_______ 。 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:_______ 。
(4)向水层中加入 溶液来调节溶液的
溶液来调节溶液的 ,
, 应大于
应大于_______ 时, 完全生成
完全生成 沉淀。(已知
沉淀。(已知 )
)
(5)“氧化”步骤中氧化剂与还原剂物质的量之比为_______ 。
(6) 是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着
是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着 的循环,请写出
的循环,请写出 消除
消除 尾气(气体产物是空气的某一成分)的化学方程式
尾气(气体产物是空气的某一成分)的化学方程式_______ 。
(7)氧化铈 ,常用作玻璃工业添加剂,在其立方晶胞中掺杂
,常用作玻璃工业添加剂,在其立方晶胞中掺杂 ,
, 占据原来
占据原来 的位置,可以得到更稳定的结构,如图所示,
的位置,可以得到更稳定的结构,如图所示, 晶胞中
晶胞中 与最近
与最近 的核间距为
的核间距为 。(已知:
。(已知: 的空缺率
的空缺率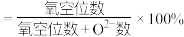 )
) 点原子的分数坐标为
点原子的分数坐标为 ,则
,则 点原子的分数坐标为
点原子的分数坐标为_______ 。
② 晶胞中与
晶胞中与 最近的
最近的 的个数为
的个数为_______ 。
③ 晶体的密度为
晶体的密度为_______ (只需列出表达式)。
④若掺杂 后得到
后得到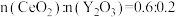 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为_______ 。
 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: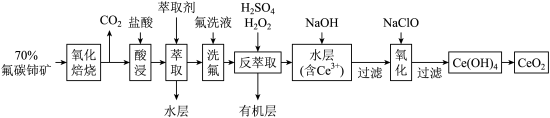
 能与
能与 结合成
结合成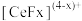 ,也能与
,也能与 结合成
结合成 ;
;②在硫酸体系中
 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。回答下列问题:
(1)氧化焙烧中氧化的目的是
(2)“萃取”时存在反应:
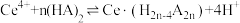 ,如图中D是分配比,表示
,如图中D是分配比,表示 分别在有机层中与水层中存在形式的物质的量浓度之比
分别在有机层中与水层中存在形式的物质的量浓度之比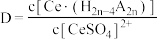 保持其它条件不变,若在起始料液中加入不同量的
保持其它条件不变,若在起始料液中加入不同量的 以改变水层中的
以改变水层中的 ,请解释D随起始料液中
,请解释D随起始料液中 变化的原因:
变化的原因: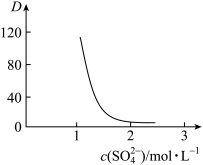
 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:(4)向水层中加入
 溶液来调节溶液的
溶液来调节溶液的 ,
, 应大于
应大于 完全生成
完全生成 沉淀。(已知
沉淀。(已知 )
)(5)“氧化”步骤中氧化剂与还原剂物质的量之比为
(6)
 是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着
是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着 的循环,请写出
的循环,请写出 消除
消除 尾气(气体产物是空气的某一成分)的化学方程式
尾气(气体产物是空气的某一成分)的化学方程式(7)氧化铈
 ,常用作玻璃工业添加剂,在其立方晶胞中掺杂
,常用作玻璃工业添加剂,在其立方晶胞中掺杂 ,
, 占据原来
占据原来 的位置,可以得到更稳定的结构,如图所示,
的位置,可以得到更稳定的结构,如图所示, 晶胞中
晶胞中 与最近
与最近 的核间距为
的核间距为 。(已知:
。(已知: 的空缺率
的空缺率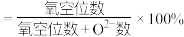 )
)
 点原子的分数坐标为
点原子的分数坐标为 ,则
,则 点原子的分数坐标为
点原子的分数坐标为②
 晶胞中与
晶胞中与 最近的
最近的 的个数为
的个数为③
 晶体的密度为
晶体的密度为④若掺杂
 后得到
后得到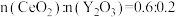 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为
您最近半年使用:0次
2 . 回答下列问题。
(1)已知下列热化学方程式:
Ⅰ.
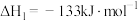
Ⅱ.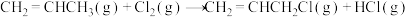
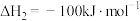
在相同条件下, 的正反应的活化能
的正反应的活化能 为
为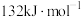 ,则逆反应的活化能
,则逆反应的活化能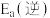 为
为___________  。
。
(2)查阅资料得知,反应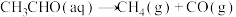 在含有少量I2的溶液中分两步进行:
在含有少量I2的溶液中分两步进行:
第Ⅰ步反应为 (慢反应);
(慢反应);
第Ⅱ步为快反应。
增大I2的浓度___________ (填“能”或“不能”)明显增大总反应的平均速率,理由为___________ 。
(3)氯化铜晶体( )常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下:
)常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下:
___________ (填字母,下同)。
a.KMnO4溶液 b.氯水 c.溴水 d.H2O2溶液
②溶液C中加入试剂y可以调节溶液pH,从而除去 而不引入杂质。试剂y可选用下列物质中的
而不引入杂质。试剂y可选用下列物质中的___________ 。
a.Cu b.CuO c. d.NaOH
d.NaOH
③SOCl2与水反应的化学方程式为___________ 。
④SOCl2与 混合并加热,可得到无水CuCl2的原因是
混合并加热,可得到无水CuCl2的原因是___________ 。
(1)已知下列热化学方程式:
Ⅰ.

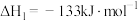
Ⅱ.
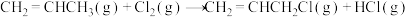
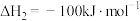
在相同条件下,
 的正反应的活化能
的正反应的活化能 为
为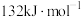 ,则逆反应的活化能
,则逆反应的活化能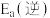 为
为 。
。(2)查阅资料得知,反应
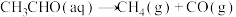 在含有少量I2的溶液中分两步进行:
在含有少量I2的溶液中分两步进行:第Ⅰ步反应为
 (慢反应);
(慢反应);第Ⅱ步为快反应。
增大I2的浓度
(3)氯化铜晶体(
 )常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下:
)常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下: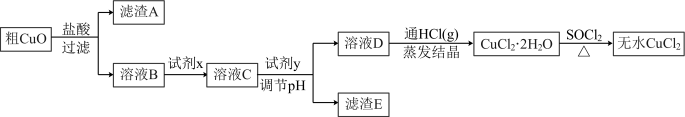
 |  |  | |
| 开始沉淀的pH | 1.9 | 7.0 | 4.7 |
| 沉淀完全的pH | 3.2 | 9.0 | 6.7 |
已知:氯化亚砜(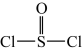 )熔点-105℃,沸点78.8℃,易水解。
)熔点-105℃,沸点78.8℃,易水解。
a.KMnO4溶液 b.氯水 c.溴水 d.H2O2溶液
②溶液C中加入试剂y可以调节溶液pH,从而除去
 而不引入杂质。试剂y可选用下列物质中的
而不引入杂质。试剂y可选用下列物质中的a.Cu b.CuO c.
 d.NaOH
d.NaOH③SOCl2与水反应的化学方程式为
④SOCl2与
 混合并加热,可得到无水CuCl2的原因是
混合并加热,可得到无水CuCl2的原因是
您最近半年使用:0次
3 . 某兴趣小组以重铬酸钾( )溶液为研究对象,改变条件使其发生“色彩变幻”。
)溶液为研究对象,改变条件使其发生“色彩变幻”。
已知:① 溶液存在平衡:
溶液存在平衡: 。
。
②含铬元素的离子在溶液中的颜色: (橙色);
(橙色); (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。 的正反应是
的正反应是_____ (填“吸热”或“放热”)反应。
(2)ⅱ是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是_____ (填化学式)。
(3)ⅲ的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验不能达到预期目的,理由是______ 。
(4)根据实验Ⅱ中不同现象,可以得出的结论是______ 。
(5)继续实验Ⅲ:______ 。
②第二步溶液变绿色:该反应的离子方程式是_______ 。
 )溶液为研究对象,改变条件使其发生“色彩变幻”。
)溶液为研究对象,改变条件使其发生“色彩变幻”。已知:①
 溶液存在平衡:
溶液存在平衡: 。
。②含铬元素的离子在溶液中的颜色:
 (橙色);
(橙色); (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。
 的正反应是
的正反应是(2)ⅱ是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是
(3)ⅲ的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验不能达到预期目的,理由是
(4)根据实验Ⅱ中不同现象,可以得出的结论是
(5)继续实验Ⅲ:
实验Ⅲ: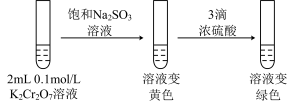
②第二步溶液变绿色:该反应的离子方程式是
您最近半年使用:0次
4 . 硫酸是重要的化工原料,它的年产量可以用来衡量一个国家的化工生产水平,以黄铁矿为原
料进行接触法制硫酸的流程如下:___________ (填设备名称)中与氧气反应的方程式,每生成 转移
转移___________ mol电子。
(2)在转化阶段,下列条件能使平衡向生成 的方向移动的是_________。
的方向移动的是_________。
(3)硫酸工业生产中 吸收率与进入吸收塔的硫酸浓度和温度关系如图,由图可知吸收
吸收率与进入吸收塔的硫酸浓度和温度关系如图,由图可知吸收 所用硫酸的适宜浓度为98.3%,适宜温度为
所用硫酸的适宜浓度为98.3%,适宜温度为___________ ,而工业生产中一般采用60℃的可能原因是___________ 。
料进行接触法制硫酸的流程如下:

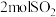 转移
转移(2)在转化阶段,下列条件能使平衡向生成
 的方向移动的是_________。
的方向移动的是_________。| A.不采用常温而加热至400℃-500℃ | B.使用 作为催化剂 作为催化剂 |
| C.向容器中通入过量空气 | D.进入接触室前的混合气体需要先净化 |
(3)硫酸工业生产中
 吸收率与进入吸收塔的硫酸浓度和温度关系如图,由图可知吸收
吸收率与进入吸收塔的硫酸浓度和温度关系如图,由图可知吸收 所用硫酸的适宜浓度为98.3%,适宜温度为
所用硫酸的适宜浓度为98.3%,适宜温度为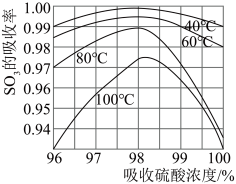
您最近半年使用:0次
5 . 利用含钴废料(主要成分为 、
、 、
、 、
、 以及
以及 、
、 等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示:
等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示: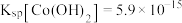 ;
;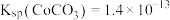 。
。
请回答下列问题:
(1)“碱浸”时所得滤液中溶质的主要成分为 和
和___________ 。“酸浸”时 发生反应的总离子方程式为
发生反应的总离子方程式为___________ 。
(2)“萃取”时 萃取的反应原理如下:
萃取的反应原理如下: (有机层)
(有机层)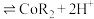 ,若萃取剂的量一定时,
,若萃取剂的量一定时,___________ (填“一次萃取”或“少量多次萃取”)的萃取效率更高。若“酸浸”后浸出液的 ,
, ,萃取完成后水相中
,萃取完成后水相中 为
为 ,则钴的萃取率为
,则钴的萃取率为___________ (结果保留一位小数,溶液体积变化忽略不计)。
(3)“沉锰”时, 转化为
转化为 ,则“沉锰”时发生反应的离子方程式为
,则“沉锰”时发生反应的离子方程式为___________ 。
(4)可以通过电解 溶液获得单质
溶液获得单质 和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是
和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是___________ 。若Ⅱ室溶液中溶质的质量增加了 ,则理论上获得的单质
,则理论上获得的单质 的质量为
的质量为___________ 。
 、
、 、
、 、
、 以及
以及 、
、 等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示:
等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示: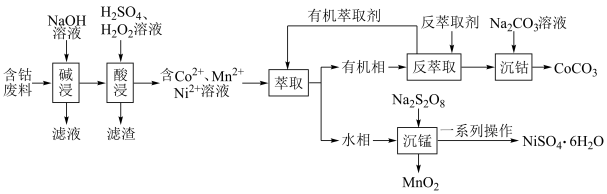
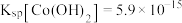 ;
;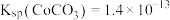 。
。请回答下列问题:
(1)“碱浸”时所得滤液中溶质的主要成分为
 和
和 发生反应的总离子方程式为
发生反应的总离子方程式为(2)“萃取”时
 萃取的反应原理如下:
萃取的反应原理如下: (有机层)
(有机层)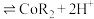 ,若萃取剂的量一定时,
,若萃取剂的量一定时, ,
, ,萃取完成后水相中
,萃取完成后水相中 为
为 ,则钴的萃取率为
,则钴的萃取率为(3)“沉锰”时,
 转化为
转化为 ,则“沉锰”时发生反应的离子方程式为
,则“沉锰”时发生反应的离子方程式为(4)可以通过电解
 溶液获得单质
溶液获得单质 和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是
和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是 ,则理论上获得的单质
,则理论上获得的单质 的质量为
的质量为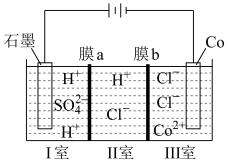
您最近半年使用:0次
名校
6 . 氢能是一种绿色能源,研发新型制氢技术具有重要意义。
(1)甘油 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
反应I: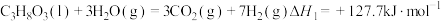
反应Ⅱ: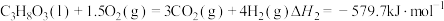
①
___________ 。
②除 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最需要抑制
等副产物,为了提高原子利用率,最需要抑制 的生成,原因是
的生成,原因是___________ 。
(2)“表面改性铝粉分解水制氢”因 储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响
储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响 还原活性的主要因素,工业上常用
还原活性的主要因素,工业上常用 溶液或锡酸钠
溶液或锡酸钠 溶液作为
溶液作为 粉的改性试剂。已知:
粉的改性试剂。已知: 。
。
①利用 溶液改性
溶液改性 粉的原理可用化学方程式表示为
粉的原理可用化学方程式表示为___________ 。
② 下,向两份质量和粒径均相同的
下,向两份质量和粒径均相同的 粉中,分别加入等体积
粉中,分别加入等体积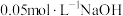 溶液和
溶液和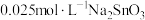 溶液来改性
溶液来改性 粉,氢气产率随时间的变化关系如图1所示。
粉,氢气产率随时间的变化关系如图1所示。 溶液改性效果明显优于
溶液改性效果明显优于 溶液的可能原因是
溶液的可能原因是___________ 。 溶液浓度的变化关系如图2所示。当
溶液浓度的变化关系如图2所示。当 溶液浓度为
溶液浓度为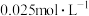 时,氢气产率接近
时,氢气产率接近 。但
。但 溶液过大或过小会大大降低氢气产率,其可能原因分别是
溶液过大或过小会大大降低氢气产率,其可能原因分别是___________ 。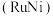 催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与
催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与 原子相连的3个
原子相连的3个 原子分别用
原子分别用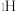 、
、 和
和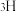 标记)。根据元素电负性的变化规律推测题图的虚线框内微粒
标记)。根据元素电负性的变化规律推测题图的虚线框内微粒 和
和 的化学式分别为
的化学式分别为___________ ;步骤Ⅱ可描述为___________ 。
(1)甘油
 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:反应I:
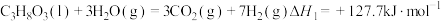
反应Ⅱ:
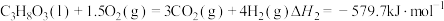
①

②除
 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最需要抑制
等副产物,为了提高原子利用率,最需要抑制 的生成,原因是
的生成,原因是(2)“表面改性铝粉分解水制氢”因
 储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响
储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响 还原活性的主要因素,工业上常用
还原活性的主要因素,工业上常用 溶液或锡酸钠
溶液或锡酸钠 溶液作为
溶液作为 粉的改性试剂。已知:
粉的改性试剂。已知: 。
。①利用
 溶液改性
溶液改性 粉的原理可用化学方程式表示为
粉的原理可用化学方程式表示为②
 下,向两份质量和粒径均相同的
下,向两份质量和粒径均相同的 粉中,分别加入等体积
粉中,分别加入等体积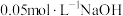 溶液和
溶液和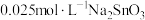 溶液来改性
溶液来改性 粉,氢气产率随时间的变化关系如图1所示。
粉,氢气产率随时间的变化关系如图1所示。 溶液改性效果明显优于
溶液改性效果明显优于 溶液的可能原因是
溶液的可能原因是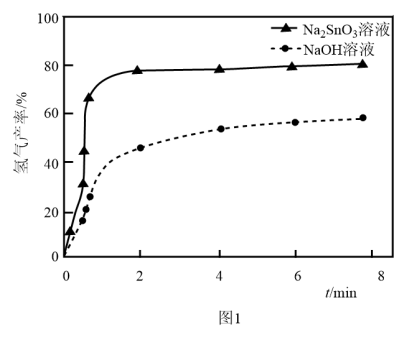
 溶液浓度的变化关系如图2所示。当
溶液浓度的变化关系如图2所示。当 溶液浓度为
溶液浓度为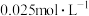 时,氢气产率接近
时,氢气产率接近 。但
。但 溶液过大或过小会大大降低氢气产率,其可能原因分别是
溶液过大或过小会大大降低氢气产率,其可能原因分别是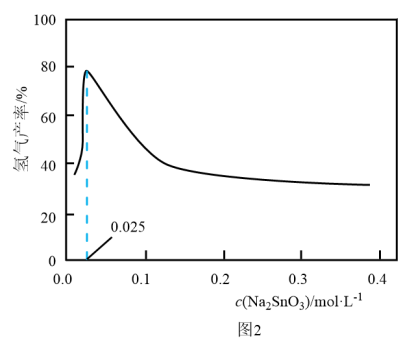
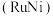 催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与
催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与 原子相连的3个
原子相连的3个 原子分别用
原子分别用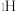 、
、 和
和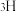 标记)。根据元素电负性的变化规律推测题图的虚线框内微粒
标记)。根据元素电负性的变化规律推测题图的虚线框内微粒 和
和 的化学式分别为
的化学式分别为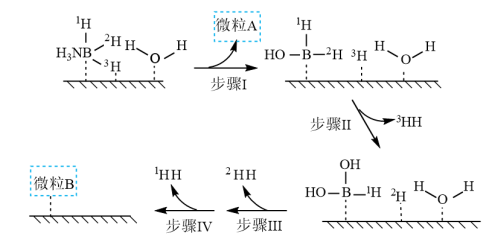
您最近半年使用:0次
名校
解题方法
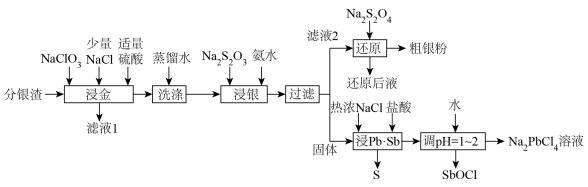
7 . 分银渣(主要成分为PbSO4、Sb2O3、AgCl、Ag2S、Au)是电解精炼铜的尾渣,具有较高的综合利用价值。一种提取流程如下:
2.Ksp(PbSO4)=2.53×10-8,Ksp(PbCl2)=1.70×10-5;
3.升高温度时,发生反应:Na2S2O3 S+Na2SO3。
S+Na2SO3。
回答下列问题:
(1)滤液1的主要成分为HAuCl4,该物质中金元素的化合价为___________ ,“浸金”过程中Ag2S转化为AgCl的离子方程式为__________
(2)“浸金”过程中加入适量硫酸,除防止Pb部分转化为PbCl2造成损失,还具有的作用是___________ ;
(3)“浸银”操作前先进行“洗涤”操作的目的是___________ ;
(4)“浸银”过程控制pH=8~10,温度50℃,发生反应:AgCl+2S2O
 [Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是
[Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是___________ ;
(5)“还原”过程中S2O 被氧化为SO
被氧化为SO 。还原后液可循环使用,应当将其导入到
。还原后液可循环使用,应当将其导入到___________ 操作中(填操作单元名称)。
(6)“浸Pb、Sb”过程中生成Na2PbCl4的化学方程式为___________ ,电解Na2PbCl4溶液制备金属单质Pb,装置如图,电路中通过0.2mole-时,阴极的质量增加___________ g。
2.Ksp(PbSO4)=2.53×10-8,Ksp(PbCl2)=1.70×10-5;
3.升高温度时,发生反应:Na2S2O3
 S+Na2SO3。
S+Na2SO3。回答下列问题:
(1)滤液1的主要成分为HAuCl4,该物质中金元素的化合价为
(2)“浸金”过程中加入适量硫酸,除防止Pb部分转化为PbCl2造成损失,还具有的作用是
(3)“浸银”操作前先进行“洗涤”操作的目的是
(4)“浸银”过程控制pH=8~10,温度50℃,发生反应:AgCl+2S2O

 [Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是
[Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是(5)“还原”过程中S2O
 被氧化为SO
被氧化为SO 。还原后液可循环使用,应当将其导入到
。还原后液可循环使用,应当将其导入到(6)“浸Pb、Sb”过程中生成Na2PbCl4的化学方程式为

您最近半年使用:0次
8 . 氮及其化合物在工农业生产、生活中有着重要作用。
1.下列元素中电负性最大的是____。
2.NH3和PH3都具有四面体结构,NH3比PH3的分解温度高的原因是____。
3.配合物Ni(CO)4也具有四面体结构,常温下Ni(CO)4为液态,易溶于CCl4、苯等有机溶剂。写出基态Ni的电子排布式____ ;Ni(CO)4属于____ 晶体。
4.Zn(NH3)42+离子也具有四面体结构,Zn2+可提供4个能量最低的空轨道与NH3参与形成配位键,这4个空轨道是____。
氨在某催化剂作用下只发生如下反应:
主反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H =-905kJ/mol
4NO(g)+6H2O(g) △H =-905kJ/mol
副反应:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H =-1268kJ/mol
2N2(g)+6H2O(g) △H =-1268kJ/mol
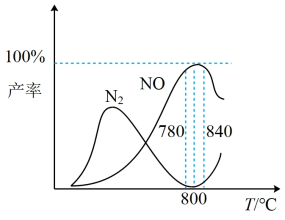
有关物质产率与温度的关系如图。_________ 。
6.工业上采用物料比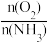 在1.7~2.0,主要目的是:
在1.7~2.0,主要目的是:______________ 。
7.下列说法正确的是______________ 。
A. 工业上进行氨催化氧化生成NO时,温度应控制在780~840℃之间
B. 在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
C. 选择合适的催化剂,可以大幅度提高NO在最终产物中的比率
8.一定温度下,在3.0L密闭容器中,通入0.10molCH4和0.20molNO2进行反应,CH4(g)+2NO2(g) CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:
CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:
表中数据计算0~4min内υ(NO2)=_________ 。
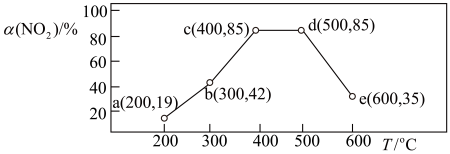
9.在一恒容密闭容器中,通入一定量CH4和NO2,测得在相同时间内,在不同温度下,NO2的转化率 [α(NO2)/%] 如下图;c点___ (填“是”或“不是”)反应达平衡的点。d点之后,转化率随温度升高而降低的原因是___ 。
1.下列元素中电负性最大的是____。
| A.N | B.P | C.Si | D.C |
| A.NH3分子间有氢键 | B.NH3分子极性强 |
| C.N-H键键能大于P-H键 | D.氨极易液化 |
4.Zn(NH3)42+离子也具有四面体结构,Zn2+可提供4个能量最低的空轨道与NH3参与形成配位键,这4个空轨道是____。
| A.3p | B.3d | C.4s | D.4p |
氨在某催化剂作用下只发生如下反应:
主反应:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H =-905kJ/mol
4NO(g)+6H2O(g) △H =-905kJ/mol副反应:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H =-1268kJ/mol
2N2(g)+6H2O(g) △H =-1268kJ/mol有关物质产率与温度的关系如图。
6.工业上采用物料比
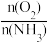 在1.7~2.0,主要目的是:
在1.7~2.0,主要目的是:7.下列说法正确的是
A. 工业上进行氨催化氧化生成NO时,温度应控制在780~840℃之间
B. 在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
C. 选择合适的催化剂,可以大幅度提高NO在最终产物中的比率
8.一定温度下,在3.0L密闭容器中,通入0.10molCH4和0.20molNO2进行反应,CH4(g)+2NO2(g)
 CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:
CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:| 时间(t/min) | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强(p/100kPa) | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
9.在一恒容密闭容器中,通入一定量CH4和NO2,测得在相同时间内,在不同温度下,NO2的转化率 [α(NO2)/%] 如下图;c点
您最近半年使用:0次
名校
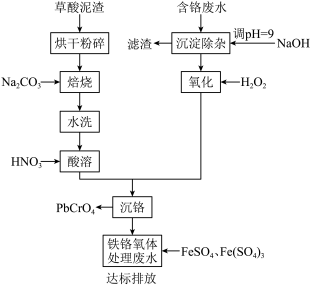
9 . 铬酸铅俗称铬黄,主要用于油漆、油墨、塑料以及橡胶等行业。一种以含铬废水(含Cr3+、Fe3+、Cu2+)和草酸泥渣(含草酸铅、硫酸铅)为原料制备铬酸铅的工艺流程如下:
回答下列问题
(1)草酸泥渣“粉碎”的目的是___________ ,“焙烧”时加入碳酸钠是为了将硫酸铅转化为PbO,同时放出CO2,该转化过程的化学方程式为___________ 。
(2)滤渣的主要成分为___________ 、___________ 。(填化学式)
(3)“沉淀除杂”所得滤液中含铬化合物主要为___________ 。(填化学式)
(4)“氧化”工序中发生反应的离子方程式为___________ 。
(5)为了提高沉铬率,用平衡移动原理解释“酸溶”过程中所加硝酸不能过量的原因:___________ 。
(6)处理含 的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为___________ mol。

回答下列问题
(1)草酸泥渣“粉碎”的目的是
(2)滤渣的主要成分为
(3)“沉淀除杂”所得滤液中含铬化合物主要为
(4)“氧化”工序中发生反应的离子方程式为
(5)为了提高沉铬率,用平衡移动原理解释“酸溶”过程中所加硝酸不能过量的原因:
(6)处理含
 的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
您最近半年使用:0次
2024-04-21更新
|
125次组卷
|
2卷引用:东北三省四城市联考暨沈阳市高三下学期质量监测(二)化学试题
2024高三下·全国·专题练习
10 . 丙烯是三大合成材料的基本原料之一,可用于生产多种重要有机化工原料。由丙烷制丙烯的两种方法如下:
I.丙烷无氧脱氢法:
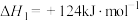
II.丙烷氧化脱氢法: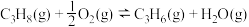

请回答下列问题:
(1)对于反应I,下列条件有利于提高 的平衡转化率的是___________(填字母)
的平衡转化率的是___________(填字母)
(2)某温度下,在刚性密闭容器中充入 发生反应I,起始压强为
发生反应I,起始压强为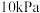 ,平衡时总压强为
,平衡时总压强为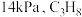 的平衡转化率为
的平衡转化率为___________ 。
(3)一定压强下,向密闭容器中充入一定量的 和
和 ,发生反应
,发生反应
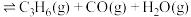 ,
, 的平衡转化率在不同投料比
的平衡转化率在不同投料比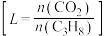 下与温度的关系如图所示,投料比L由小到大的顺序为
下与温度的关系如图所示,投料比L由小到大的顺序为___________ ,判断依据是___________ 。 等副产物,在催化剂的作用下,
等副产物,在催化剂的作用下, 的转化率和
的转化率和 的产率随温度的变化关系如图所示,
的产率随温度的变化关系如图所示, 的选择性:550℃
的选择性:550℃___________ 575℃(填“>”或“<”)。
I.丙烷无氧脱氢法:

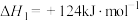
II.丙烷氧化脱氢法:
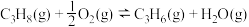

请回答下列问题:
(1)对于反应I,下列条件有利于提高
 的平衡转化率的是___________(填字母)
的平衡转化率的是___________(填字母)| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |
 发生反应I,起始压强为
发生反应I,起始压强为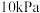 ,平衡时总压强为
,平衡时总压强为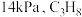 的平衡转化率为
的平衡转化率为(3)一定压强下,向密闭容器中充入一定量的
 和
和 ,发生反应
,发生反应
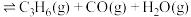 ,
, 的平衡转化率在不同投料比
的平衡转化率在不同投料比 下与温度的关系如图所示,投料比L由小到大的顺序为
下与温度的关系如图所示,投料比L由小到大的顺序为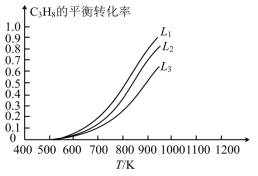
 等副产物,在催化剂的作用下,
等副产物,在催化剂的作用下, 的转化率和
的转化率和 的产率随温度的变化关系如图所示,
的产率随温度的变化关系如图所示, 的选择性:550℃
的选择性:550℃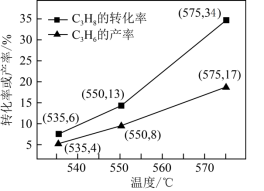
您最近半年使用:0次



