名校
1 .  是中学化学实验中常用的试剂。回答下列问题:
是中学化学实验中常用的试剂。回答下列问题:
(1) 溶液中存在:
溶液中存在: 。
。
①实验室配制 溶液的操作是取一定量
溶液的操作是取一定量 固体溶于浓硝酸中,加入蒸馏水稀释至指定体积。其中,浓硝酸的作用是
固体溶于浓硝酸中,加入蒸馏水稀释至指定体积。其中,浓硝酸的作用是___________ 。
②对 溶液进行加热,溶液变为红褐色,由此判断,
溶液进行加热,溶液变为红褐色,由此判断,
___________ 0(填“>”或“<”),判断理由是___________ 。
(2)在稀 溶液中滴加几滴
溶液中滴加几滴 溶液,将所得溶液分成甲、乙、丙、丁四份并进行如下实验(甲为参照组):
溶液,将所得溶液分成甲、乙、丙、丁四份并进行如下实验(甲为参照组):
①参照组甲溶液颜色为___________ 。
②解释产生实验I中现象的原因:___________ 。
③实验III中产生异常现象的原因可能是___________ ,为了验证该猜想,请设计简单实验:___________ 。
 是中学化学实验中常用的试剂。回答下列问题:
是中学化学实验中常用的试剂。回答下列问题:(1)
 溶液中存在:
溶液中存在: 。
。①实验室配制
 溶液的操作是取一定量
溶液的操作是取一定量 固体溶于浓硝酸中,加入蒸馏水稀释至指定体积。其中,浓硝酸的作用是
固体溶于浓硝酸中,加入蒸馏水稀释至指定体积。其中,浓硝酸的作用是②对
 溶液进行加热,溶液变为红褐色,由此判断,
溶液进行加热,溶液变为红褐色,由此判断,
(2)在稀
 溶液中滴加几滴
溶液中滴加几滴 溶液,将所得溶液分成甲、乙、丙、丁四份并进行如下实验(甲为参照组):
溶液,将所得溶液分成甲、乙、丙、丁四份并进行如下实验(甲为参照组):| 序号 | 操作 | 现象 |
| I | 向乙中加入少量铁粉,振荡 | 溶液颜色比甲浅 |
| II | 向丙中加入少量 粉末,振荡 粉末,振荡 | 溶液颜色与甲无明显变化 |
| III | 向丁中滴加足量的新制氯水,振荡 | 溶液颜色变为黄色 |
②解释产生实验I中现象的原因:
③实验III中产生异常现象的原因可能是
您最近半年使用:0次
2023-12-01更新
|
24次组卷
|
2卷引用:海南省海南华侨中学 海南省农垦中学2023-2024学年高二上学期11月学业水平测试期中联考化学试题
名校
2 . 亚硝酰氯( )是一种常用的氯化剂,广泛用于有机合成中。在体积相同的甲、乙密闭容器中均充入
)是一种常用的氯化剂,广泛用于有机合成中。在体积相同的甲、乙密闭容器中均充入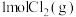 和
和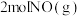 ,分别在“恒温恒容”“绝热恒容”条件下发生反应:
,分别在“恒温恒容”“绝热恒容”条件下发生反应: 。两个反应体系的压强与时间关系如图所示:
。两个反应体系的压强与时间关系如图所示:

回答下列问题:
(1)
___________ 0(填“>”或“<”)。
(2)气体总物质的量:
_______  (填“>”“<”或“=”,下同),判断依据是
(填“>”“<”或“=”,下同),判断依据是________ 。
(3)转化率:
___________  。
。
(4)反应速率:
___________  。
。
(5)乙容器中, 内
内 的分压变化率为
的分压变化率为___________ kPa∙min-1。
(6)a点时,
___________  。甲容器中平衡常数
。甲容器中平衡常数
___________ a点时的 (填“大于”“小于”或“等于”)。提示:用分压计算的平衡常数为
(填“大于”“小于”或“等于”)。提示:用分压计算的平衡常数为 ,分压
,分压 总压
总压 物质的量分数,
物质的量分数, 点时
点时 也用分压计算。
也用分压计算。
 )是一种常用的氯化剂,广泛用于有机合成中。在体积相同的甲、乙密闭容器中均充入
)是一种常用的氯化剂,广泛用于有机合成中。在体积相同的甲、乙密闭容器中均充入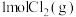 和
和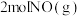 ,分别在“恒温恒容”“绝热恒容”条件下发生反应:
,分别在“恒温恒容”“绝热恒容”条件下发生反应: 。两个反应体系的压强与时间关系如图所示:
。两个反应体系的压强与时间关系如图所示:
回答下列问题:
(1)

(2)气体总物质的量:

 (填“>”“<”或“=”,下同),判断依据是
(填“>”“<”或“=”,下同),判断依据是(3)转化率:

 。
。(4)反应速率:

 。
。(5)乙容器中,
 内
内 的分压变化率为
的分压变化率为(6)a点时,

 。甲容器中平衡常数
。甲容器中平衡常数
 (填“大于”“小于”或“等于”)。提示:用分压计算的平衡常数为
(填“大于”“小于”或“等于”)。提示:用分压计算的平衡常数为 ,分压
,分压 总压
总压 物质的量分数,
物质的量分数, 点时
点时 也用分压计算。
也用分压计算。
您最近半年使用:0次
2023-12-01更新
|
29次组卷
|
2卷引用:海南省海南华侨中学 海南省农垦中学2023-2024学年高二上学期11月学业水平测试期中联考化学试题
名校
解题方法
3 . 某课外活动小组为了探究外界条件对化学平衡的影响,做了如下实验:
(1)已知颜色深浅(I)与有色物质浓度(c)和观察深度(L)的乘积成正比: (式中k为常数)。在a、b两支容积均为30mL的针筒中分别抽入
(式中k为常数)。在a、b两支容积均为30mL的针筒中分别抽入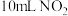 气体,将针筒前端封闭。
气体,将针筒前端封闭。

①将a针筒活塞迅速推至5mL处,从视线1处观察到的现象是___________ ;
②将b针筒活塞迅速拉至20mL处,从视线2处观察到的现象是___________ 。
(2)探究浓度对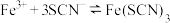 平衡的影响。将
平衡的影响。将 溶液(接近无色)和
溶液(接近无色)和 溶液等体积混合,将得到的红色溶液分为两等份。甲、乙两同学分别取一份向其中加入少量KCl(s)。
溶液等体积混合,将得到的红色溶液分为两等份。甲、乙两同学分别取一份向其中加入少量KCl(s)。
①甲同学根据中学所掌握知识预测红色应该___________ (填“变深”“变浅”或“不变”)。
②乙同学查阅资料得知该反应为配位反应,且学习到更多配离子,如冰晶石中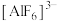 、银氨溶液中
、银氨溶液中 、
、 、
、 等。因此预测红色应该
等。因此预测红色应该___________ (填“变深”“变浅”或“不变”),理由:___________ 。
(1)已知颜色深浅(I)与有色物质浓度(c)和观察深度(L)的乘积成正比:
 (式中k为常数)。在a、b两支容积均为30mL的针筒中分别抽入
(式中k为常数)。在a、b两支容积均为30mL的针筒中分别抽入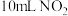 气体,将针筒前端封闭。
气体,将针筒前端封闭。
①将a针筒活塞迅速推至5mL处,从视线1处观察到的现象是
②将b针筒活塞迅速拉至20mL处,从视线2处观察到的现象是
(2)探究浓度对
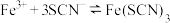 平衡的影响。将
平衡的影响。将 溶液(接近无色)和
溶液(接近无色)和 溶液等体积混合,将得到的红色溶液分为两等份。甲、乙两同学分别取一份向其中加入少量KCl(s)。
溶液等体积混合,将得到的红色溶液分为两等份。甲、乙两同学分别取一份向其中加入少量KCl(s)。①甲同学根据中学所掌握知识预测红色应该
②乙同学查阅资料得知该反应为配位反应,且学习到更多配离子,如冰晶石中
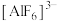 、银氨溶液中
、银氨溶液中 、
、 、
、 等。因此预测红色应该
等。因此预测红色应该
您最近半年使用:0次
2023-10-12更新
|
120次组卷
|
3卷引用:海南省三亚市2023-2024学年鲁迅中学高二上学期化学期中测试
名校
解题方法
4 . 海洋是生命的摇篮,蕴藏着丰富的化学资源。回答下列问题:
(1)粗盐中可溶性杂质离子包含Mg2+、Ca2+、 。要除去这些杂质离子得到精盐水,加入试剂的顺序可为
。要除去这些杂质离子得到精盐水,加入试剂的顺序可为___________
A.BaCl2溶液、NaOH溶液、Na2CO3溶液、盐酸
B.NaOH溶液、Na2CO3溶液、BaCl2溶液、盐酸
C.BaCl2溶液、Na2CO3溶液、NaOH溶液、盐酸
制取 晶体的“结晶”操作为
晶体的“结晶”操作为___________
(2)从海带中提取碘的实验过程如下图所示:
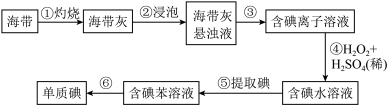
①灼烧海带时,应将海带放入___________ 中灼烧
A.烧杯 B.容量瓶 C.坩埚 D.锥形瓶
②请写出步骤④反应的离子方程式__________ 。
(3)海水显碱性,海水提溴过程中,先调其pH<3.5后,再通入氯气,调节海水pH可提高C12的利用率,用平衡原理解释其原因是___________ 。
(1)粗盐中可溶性杂质离子包含Mg2+、Ca2+、
 。要除去这些杂质离子得到精盐水,加入试剂的顺序可为
。要除去这些杂质离子得到精盐水,加入试剂的顺序可为A.BaCl2溶液、NaOH溶液、Na2CO3溶液、盐酸
B.NaOH溶液、Na2CO3溶液、BaCl2溶液、盐酸
C.BaCl2溶液、Na2CO3溶液、NaOH溶液、盐酸
制取
 晶体的“结晶”操作为
晶体的“结晶”操作为(2)从海带中提取碘的实验过程如下图所示:

①灼烧海带时,应将海带放入
A.烧杯 B.容量瓶 C.坩埚 D.锥形瓶
②请写出步骤④反应的离子方程式
(3)海水显碱性,海水提溴过程中,先调其pH<3.5后,再通入氯气,调节海水pH可提高C12的利用率,用平衡原理解释其原因是
您最近半年使用:0次
5 . 兴趣小组同学为探究影响化学反应速率及化学平衡的因素,设计以下实验:
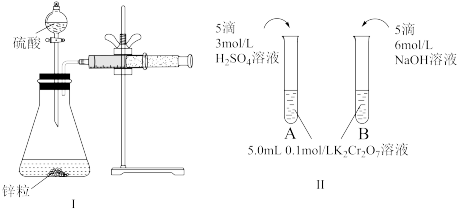
(1)利用实验Ⅰ探究锌与1mol/L硫酸和4mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项即可):___________ 。
(2)利用实验Ⅱ探究浓度对化学平衡的影响。
已知:Cr2O (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+ 推测B试管中实验现象为
(黄色)+2H+ 推测B试管中实验现象为___________ ,用平衡移动原理解释原因:___________ 。
(3)该小组同学继续用酸性KMnO4溶液和草酸(H2C2O4)溶液进行实验,实验操作及现象如下表:
已知:2MnO + 5H2C2O4 +6H+ =2Mn2+ +10CO2↑+8H2O
+ 5H2C2O4 +6H+ =2Mn2+ +10CO2↑+8H2O
① 由实验ⅰ、实验ⅱ可得出的结论是___________ 。
② 关于实验ⅱ中80s后溶液颜色迅速变浅的原因,该小组同学提出了猜想:反应中生成的Mn2+对反应有催化作用。利用下列提供的试剂设计实验ⅲ,验证猜想。
提供的试剂:0.01mol/L酸性KMnO4溶液,0.1mol/L草酸溶液,3mol/L硫酸, MnSO4固体,蒸馏水。
补全实验ⅲ的操作:向试管中先加入5mL0.01mol/L酸性KMnO4溶液,___________ ,最后加入5mL0.1mol/L草酸溶液。

(1)利用实验Ⅰ探究锌与1mol/L硫酸和4mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项即可):
(2)利用实验Ⅱ探究浓度对化学平衡的影响。
已知:Cr2O
 (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+ 推测B试管中实验现象为
(黄色)+2H+ 推测B试管中实验现象为(3)该小组同学继续用酸性KMnO4溶液和草酸(H2C2O4)溶液进行实验,实验操作及现象如下表:
| 编号 | 实验操作 | 实验现象 |
| ⅰ | 向一支试管中先加入5mL0.01mol/L酸性KMnO4溶液,再加入1滴3mol/L硫酸和9滴蒸馏水,最后加入5mL0.1mol/L草酸溶液 | 前10min内溶液紫色无明显变化,后颜色逐渐变浅,30min后几乎变为无色 |
| ⅱ | 向另一支试管中先加入5mL0.01mol/L酸性KMnO4溶液,再加入10滴3mol/L硫酸,最后加入5mL0.1mol/L草酸溶液 | 80s内溶液紫色无明显变化,后颜色迅速变浅,约150s后几乎变为无色 |
 + 5H2C2O4 +6H+ =2Mn2+ +10CO2↑+8H2O
+ 5H2C2O4 +6H+ =2Mn2+ +10CO2↑+8H2O① 由实验ⅰ、实验ⅱ可得出的结论是
② 关于实验ⅱ中80s后溶液颜色迅速变浅的原因,该小组同学提出了猜想:反应中生成的Mn2+对反应有催化作用。利用下列提供的试剂设计实验ⅲ,验证猜想。
提供的试剂:0.01mol/L酸性KMnO4溶液,0.1mol/L草酸溶液,3mol/L硫酸, MnSO4固体,蒸馏水。
补全实验ⅲ的操作:向试管中先加入5mL0.01mol/L酸性KMnO4溶液,
您最近半年使用:0次
2021-11-08更新
|
85次组卷
|
3卷引用:海南省文昌中学2022-2023学年高二上学期第一次月考化学试题
名校
解题方法
6 . 近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+ Cl2(g) ΔH1=+83 kJ∙mol−1
Cl2(g) ΔH1=+83 kJ∙mol−1
CuCl(s)+ O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=−20 kJ∙mol−1
Cl2(g) ΔH2=−20 kJ∙mol−1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=−121 kJ∙mol−1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=___________ kJ∙mol−1
(2)Deacon发明的直接氧化法原理为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g),在刚性容器中,进料浓度比c(HCl)∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系如图所示:

据图象分析可知:反应平衡常数K(300 ℃)___________ K(400 ℃)(填“大于”或“小于”)。
(3)设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据,计算K(400 ℃)=___________ (列出计算式)。
(4)按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是___________ 、___________ 。在一定温度的条件下,进一步提高HCl的转化率的方法是___________ 。(写出2种)
(1)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+
 Cl2(g) ΔH1=+83 kJ∙mol−1
Cl2(g) ΔH1=+83 kJ∙mol−1CuCl(s)+
 O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=−20 kJ∙mol−1
Cl2(g) ΔH2=−20 kJ∙mol−1CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=−121 kJ∙mol−1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=
(2)Deacon发明的直接氧化法原理为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g),在刚性容器中,进料浓度比c(HCl)∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系如图所示:

据图象分析可知:反应平衡常数K(300 ℃)
(3)设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据,计算K(400 ℃)=
(4)按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是
您最近半年使用:0次
2021-05-18更新
|
301次组卷
|
2卷引用:海南省海口市2021年高三高考调研测试化学试题
真题
7 . 过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成.医疗消毒等领域。
回答下列问题:
(1)已知:H2(g)+ O2(g)=H2O(l) △H1=-286 kJ·mol¯1
O2(g)=H2O(l) △H1=-286 kJ·mol¯1
H2(g)+O2(g)=H2O2(l) △H2=-188 kJ·mol¯1
过氧化氢分解反应2H2O2(l)=2H2O(l)+O2(g)的△H=______ kJ·mol¯1。不同温度下过氧化氢分解反应的平衡常数K(313K)_____ K(298K) (填大于、小于或等于)。
(2)100℃时,在不同金属离子存在下,纯过氧化氢24 h的分解率见下表:
由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是_______ 。贮运过氧化氢时,可选用的容器材质为_________ (填标号)。
A.不锈钢 B.纯铝 C.黄铜 D.铸铁
(3)过氧化氢的Ka1=2.24×10¯12,H2O2的酸性________ H2O (填大于、小于或等于)。
研究表明,过氧化氢溶液中HO2-的浓度越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH的关系如图所示。一定浓度的过氧化氢,pH增大分解率增大的原因是___________________ :相同pH下,过氧化氢浓度越大分解率越低的原因是__________________________________________ 。

回答下列问题:
(1)已知:H2(g)+
 O2(g)=H2O(l) △H1=-286 kJ·mol¯1
O2(g)=H2O(l) △H1=-286 kJ·mol¯1H2(g)+O2(g)=H2O2(l) △H2=-188 kJ·mol¯1
过氧化氢分解反应2H2O2(l)=2H2O(l)+O2(g)的△H=
(2)100℃时,在不同金属离子存在下,纯过氧化氢24 h的分解率见下表:
| 离子 | 加入量(mg·L¯1) | 分解率% | 离子 | 加入量(mg·L¯1) | 分解率% |
| 无 | 0 | 2 | Fe3+ | 1.0 | 15 |
| Al3+ | 10 | 2 | Cu2+ | 0.1 | 86 |
| Zn2+ | 10 | 10 | Cr3+ | 0.1 | 96 |
A.不锈钢 B.纯铝 C.黄铜 D.铸铁
(3)过氧化氢的Ka1=2.24×10¯12,H2O2的酸性
研究表明,过氧化氢溶液中HO2-的浓度越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH的关系如图所示。一定浓度的过氧化氢,pH增大分解率增大的原因是

您最近半年使用:0次



