解题方法
1 . 捕碳技术(主要指捕获 )在降低温室气体排放中具有重要的作用。目前
)在降低温室气体排放中具有重要的作用。目前 和
和 已经被用作工业捕获剂,它们与
已经被用作工业捕获剂,它们与 可发生如下可逆反应:
可发生如下可逆反应:
反应I:
反应Ⅱ:
反应Ⅲ:
请回答下列问题:
(1) 与
与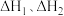 之间的关系是:
之间的关系是:
____________ 。
(2)为研究温度对 捕获
捕获 效率的影响,在某温度
效率的影响,在某温度 下,将一定量的
下,将一定量的 溶液置于密闭容器中,并充入一定量的
溶液置于密闭容器中,并充入一定量的 气体(用氮气作为稀释剂),在t时刻,测得容器中
气体(用氮气作为稀释剂),在t时刻,测得容器中 的浓度。然后分别在温度为
的浓度。然后分别在温度为 下,保持其他初始实验条件不变,重复上述实验,经过相同测得
下,保持其他初始实验条件不变,重复上述实验,经过相同测得 气体浓度,得到趋势图(见图1)。则:
气体浓度,得到趋势图(见图1)。则:
①
____________ 0(填>、=或<);
____________  (填>、=或<)
(填>、=或<)
②在 和
和 二个温度区间,容器内
二个温度区间,容器内 气体浓度呈现如图1所示的变化趋势,请分别说出二个温度区间变化原因是
气体浓度呈现如图1所示的变化趋势,请分别说出二个温度区间变化原因是____________ 。
③反应Ⅲ在温度为 时,溶液
时,溶液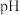 随时间变化的趋势曲线如图2所示。当时间到达
随时间变化的趋势曲线如图2所示。当时间到达 时,将该反应体系温度迅速升温到
时,将该反应体系温度迅速升温到 ,并维持该温度。请在该图中画出
,并维持该温度。请在该图中画出 时刻后溶液的
时刻后溶液的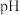 变化总趋势曲线
变化总趋势曲线____________ 。

(3)利用反应Ⅲ捕获 在
在 初始浓度和体积确定的情况下,提高
初始浓度和体积确定的情况下,提高 吸收量的措施有
吸收量的措施有__________ (写出2个)
(4)下列物质中也可能作为 捕获剂的是____________。
捕获剂的是____________。
 )在降低温室气体排放中具有重要的作用。目前
)在降低温室气体排放中具有重要的作用。目前 和
和 已经被用作工业捕获剂,它们与
已经被用作工业捕获剂,它们与 可发生如下可逆反应:
可发生如下可逆反应:反应I:

反应Ⅱ:

反应Ⅲ:

请回答下列问题:
(1)
 与
与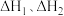 之间的关系是:
之间的关系是:
(2)为研究温度对
 捕获
捕获 效率的影响,在某温度
效率的影响,在某温度 下,将一定量的
下,将一定量的 溶液置于密闭容器中,并充入一定量的
溶液置于密闭容器中,并充入一定量的 气体(用氮气作为稀释剂),在t时刻,测得容器中
气体(用氮气作为稀释剂),在t时刻,测得容器中 的浓度。然后分别在温度为
的浓度。然后分别在温度为 下,保持其他初始实验条件不变,重复上述实验,经过相同测得
下,保持其他初始实验条件不变,重复上述实验,经过相同测得 气体浓度,得到趋势图(见图1)。则:
气体浓度,得到趋势图(见图1)。则:①


 (填>、=或<)
(填>、=或<)②在
 和
和 二个温度区间,容器内
二个温度区间,容器内 气体浓度呈现如图1所示的变化趋势,请分别说出二个温度区间变化原因是
气体浓度呈现如图1所示的变化趋势,请分别说出二个温度区间变化原因是③反应Ⅲ在温度为
 时,溶液
时,溶液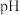 随时间变化的趋势曲线如图2所示。当时间到达
随时间变化的趋势曲线如图2所示。当时间到达 时,将该反应体系温度迅速升温到
时,将该反应体系温度迅速升温到 ,并维持该温度。请在该图中画出
,并维持该温度。请在该图中画出 时刻后溶液的
时刻后溶液的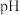 变化总趋势曲线
变化总趋势曲线
(3)利用反应Ⅲ捕获
 在
在 初始浓度和体积确定的情况下,提高
初始浓度和体积确定的情况下,提高 吸收量的措施有
吸收量的措施有(4)下列物质中也可能作为
 捕获剂的是____________。
捕获剂的是____________。A. | B. | C. | D. |
您最近一年使用:0次
名校
2 . 为减少大气污染,科学家采取多种措施处理工业废气中排放的氮氧化物(NOx)、SO2等。回答下列问题:
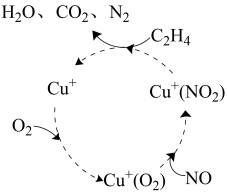
(1)某脱硝反应机理如图所示,Cu+的作用为____ ,C2H4参与的反应方程式为____ 。
(2)选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,其反应原理主要为:4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) △H=-1627kJ·mol-1。
4N2(g)+6H2O(g) △H=-1627kJ·mol-1。
①若有3molNO参与反应,则被NO氧化的NH3的物质的量为____ 。
②催化还原时应控制反应温度在315~400℃之间,反应温度不宜过高的原因是____ 。
③350℃时NO的百分含量与氨氮比的关系如图所示,若只改变氨气的投放量,当 >1.0时,烟气中NO含量反而增大,主要原因是
>1.0时,烟气中NO含量反而增大,主要原因是____ (用化学方程式表示)。

(3)烟气脱硫、脱硝一体化技术是大气污染防治研究的热点,ClO2在酸性条件下稳定,是性能优良的脱硫脱硝试剂。
①ClO 也是性能优良的脱硫脱硝试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,反应的离子方程式为
也是性能优良的脱硫脱硝试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,反应的离子方程式为____ 。
②某研究小组用ClO2进行单独脱除SO2实验时,测得SO2的脱除率随溶液pH变化如图所示。
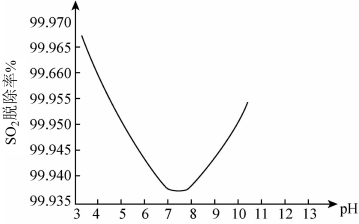
当3<pH<7时,随pH的增大,SO2脱除率逐渐降低,其原因是:____ ;在pH约7.8之后,随pH的增大,SO2脱除率又开始升高,其原因是____ 。
(1)某脱硝反应机理如图所示,Cu+的作用为

(2)选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,其反应原理主要为:4NH3(g)+4NO(g)+O2(g)
 4N2(g)+6H2O(g) △H=-1627kJ·mol-1。
4N2(g)+6H2O(g) △H=-1627kJ·mol-1。①若有3molNO参与反应,则被NO氧化的NH3的物质的量为
②催化还原时应控制反应温度在315~400℃之间,反应温度不宜过高的原因是
③350℃时NO的百分含量与氨氮比的关系如图所示,若只改变氨气的投放量,当
 >1.0时,烟气中NO含量反而增大,主要原因是
>1.0时,烟气中NO含量反而增大,主要原因是
(3)烟气脱硫、脱硝一体化技术是大气污染防治研究的热点,ClO2在酸性条件下稳定,是性能优良的脱硫脱硝试剂。
①ClO
 也是性能优良的脱硫脱硝试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,反应的离子方程式为
也是性能优良的脱硫脱硝试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,反应的离子方程式为②某研究小组用ClO2进行单独脱除SO2实验时,测得SO2的脱除率随溶液pH变化如图所示。

当3<pH<7时,随pH的增大,SO2脱除率逐渐降低,其原因是:
您最近一年使用:0次
2022-08-29更新
|
240次组卷
|
4卷引用:内蒙古自治区阿拉善盟第一中学2023届高三上学期8月月考化学试题
名校
3 . 某实验小组采用下列实验探究外界条件对化学反应速率及其化学平衡的影响。按要求回答下列问题:
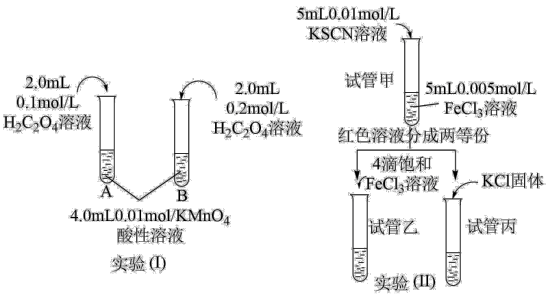
(1)实验(1)目的是探究浓度对反应速率的影响。
①为了观察到明显的现象,它们初始物质的量需要满足的关系为:n(H2C2O4):n(KMnO4)_______ 。
②在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
甲同学据此提出以下假设:
假设1:反应放热
假设2:生成Mn2+对反应有催化作用
乙同学用如下实验证明假设2成立:
则实验b中V=_______ mL,在实验b中加入蒸馏水的目的是_______ 。预期的实验现象是_______ 。
(2)实验(II)探究浓度对化学平衡的影响。
①试管甲中发生反应的离子方程式为_______ 。
②试管乙中的现象是_______ ,说明增大溶液中的Fe3+浓度,平衡_______ 。(正移、逆移或不移动)
③向试管丙中加入KC1固体,平衡_______ 。(正移、逆移或不移动)

(1)实验(1)目的是探究浓度对反应速率的影响。
①为了观察到明显的现象,它们初始物质的量需要满足的关系为:n(H2C2O4):n(KMnO4)
②在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
甲同学据此提出以下假设:
假设1:反应放热
假设2:生成Mn2+对反应有催化作用
乙同学用如下实验证明假设2成立:
| 实验 编号 | 室温下,试管中所加试剂及用量/mL | |||
| 0.20mol/LH2C2O4溶液 | 0.10mol/L酸性KMnO4溶液 | 0.10mol/LMnSO4溶液 | H2O | |
| a | 4.00 | 1.00 | 1.00 | 0 |
| b | 4.00 | 1.00 | 0 | V |
(2)实验(II)探究浓度对化学平衡的影响。
①试管甲中发生反应的离子方程式为
②试管乙中的现象是
③向试管丙中加入KC1固体,平衡
您最近一年使用:0次
名校
解题方法
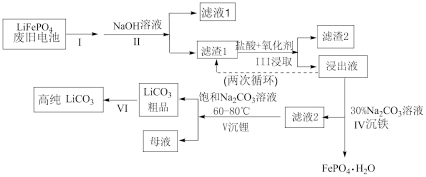
4 . 磷酸亚铁锂电池是新能源汽车的动力电池之一、采用湿法治金工艺回收废旧磷酸亚铁锂电池正极片(除 外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,流程如图:
外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,流程如图:
资料:碳酸锂在水中溶解度:
(1)I步操作是粉碎废旧电极,其主要目的是___________ 。
(2)II步加入过量NaOH溶液后,滤液1中存在的主要阴离子是___________ 。
(3)III步浸取加入的氧化剂最佳选择是___________。(填字母)
(4)浸出液中存在大量 和
和 ,从平衡移动的角度解释Ⅳ步中加入
,从平衡移动的角度解释Ⅳ步中加入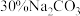 溶液沉铁的主要原理是
溶液沉铁的主要原理是___________ 。
(5)滤液2中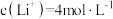 ,加入等体积的
,加入等体积的 溶液后,
溶液后, 的沉降率达到90%,母液中
的沉降率达到90%,母液中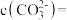
___________ 。[溶液混合后体积变化忽略不计,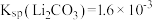 ]
]
(6)为将粗品 提纯,VI步使用
提纯,VI步使用___________ (填“热”或“冰”)水进行洗涤操作,理由是___________ 。
(7)工业上将回收的 、
、 粉碎与足量的炭黑混合高温灼烧再生制备
粉碎与足量的炭黑混合高温灼烧再生制备 ,反应的化学方程式为:
,反应的化学方程式为:___________ 。
 外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,流程如图:
外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,流程如图:
资料:碳酸锂在水中溶解度:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(2)II步加入过量NaOH溶液后,滤液1中存在的主要阴离子是
(3)III步浸取加入的氧化剂最佳选择是___________。(填字母)
A. | B.酸性 | C. | D. |
 和
和 ,从平衡移动的角度解释Ⅳ步中加入
,从平衡移动的角度解释Ⅳ步中加入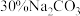 溶液沉铁的主要原理是
溶液沉铁的主要原理是(5)滤液2中
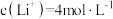 ,加入等体积的
,加入等体积的 溶液后,
溶液后, 的沉降率达到90%,母液中
的沉降率达到90%,母液中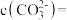
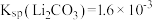 ]
](6)为将粗品
 提纯,VI步使用
提纯,VI步使用(7)工业上将回收的
 、
、 粉碎与足量的炭黑混合高温灼烧再生制备
粉碎与足量的炭黑混合高温灼烧再生制备 ,反应的化学方程式为:
,反应的化学方程式为:
您最近一年使用:0次
2022-02-05更新
|
609次组卷
|
7卷引用:内蒙古赤峰二中2023-2024学年高三上学期第三次月考化学试题
内蒙古赤峰二中2023-2024学年高三上学期第三次月考化学试题重庆市2021-2022学年高三上学期学业质量调研抽测(第一次)化学试卷(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)(已下线)押江苏卷第15题 化学工业流程综合题 -备战2022年高考化学临考题号押题(江苏卷)北京市通州区2022届高三查缺补漏化学试题北京市第十七中学2021-2022学年高三下学期5月模拟考试化学试题广东省华南师范大学附属中学2022届高三下学期押题预测(三)化学试题
名校
5 . I.在水溶液中橙色的 与黄色的
与黄色的 有下列平衡关系:
有下列平衡关系: +H2O⇌2
+H2O⇌2 +2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
(1)向上述溶液中加入NaOH溶液,溶液呈_______ 色。因为_______ 。
(2)向上述溶液中加入较浓硫酸,则溶液呈_______ 色,因为_______ 。
II.KI溶液在酸性条件下能被氧气氧化为I2.现有以下实验记录,回答:
(1)该实验的目的是_______ 。
(2)实验试剂除了1mol/LKI溶液、0.1mol/LH2SO4溶液外,还需要的试剂是_______ 。
(3)由上述实验记录可得出的结论是_______ 。
 与黄色的
与黄色的 有下列平衡关系:
有下列平衡关系: +H2O⇌2
+H2O⇌2 +2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。(1)向上述溶液中加入NaOH溶液,溶液呈
(2)向上述溶液中加入较浓硫酸,则溶液呈
II.KI溶液在酸性条件下能被氧气氧化为I2.现有以下实验记录,回答:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度/℃ | 30 | 40 | 50 | 60 | 70 |
| 显色时间/s | 160 | 80 | 40 | 20 | 10 |
(2)实验试剂除了1mol/LKI溶液、0.1mol/LH2SO4溶液外,还需要的试剂是
(3)由上述实验记录可得出的结论是
您最近一年使用:0次
2021-07-28更新
|
184次组卷
|
2卷引用:内蒙古杭锦后旗奋斗中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
6 . 合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)⇌2NH3(g) △H=-92.4kJ⋅mol-1
一种工业合成氨的简易流程图如图:
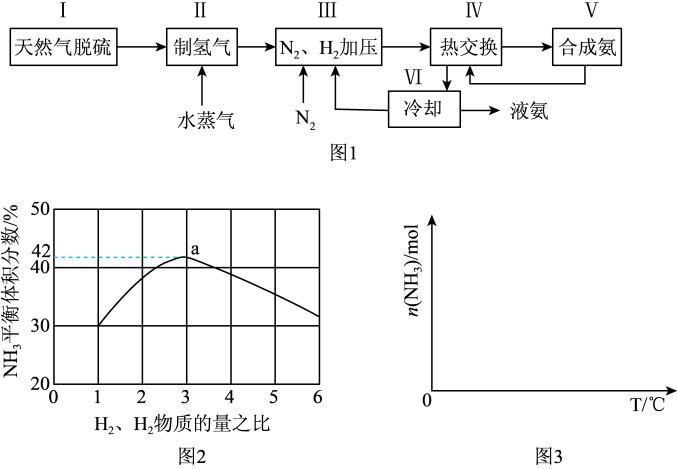
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___ 。
(2)步骤II中制氯气原理如下:
①CH4(g)+H2O(g)=CO2(g)+3H2(g) △H=+206.4kJ⋅mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ⋅mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是___ 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为___ 。
(3)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:___ 。
(4)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图___ 。
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是___ (填序号),简述本流程中提高合成氨原料总转化率的方法:___ 。
一种工业合成氨的简易流程图如图:

(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:
(2)步骤II中制氯气原理如下:
①CH4(g)+H2O(g)=CO2(g)+3H2(g) △H=+206.4kJ⋅mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ⋅mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为
(3)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:
(4)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是
您最近一年使用:0次
2020-01-07更新
|
112次组卷
|
4卷引用:内蒙古集宁一中(东校区)2016-2017学年高二下学期期末考试化学试题
2014·北京西城·二模
解题方法
7 . 利用某含铬废液[含较低浓度的Na2Cr2O7、Fe2(SO4)3]制备K2Cr2O7。流程如下:
Ⅰ.用NaOH溶液调pH至3.6,产生红褐色沉淀,过滤;
Ⅱ.向滤液中加入Na2SO3,一定操作后分离出Na2SO4;
Ⅲ.将分离出Na2SO4后的溶液调pH约为5,得到Cr(OH)3沉淀;
Ⅳ.在KOH存在条件下,向Cr(OH)3中加入足量H2O2溶液,得到黄色溶液;
Ⅴ.向黄色溶液中加入物质A后,溶液变为橙红色,一定操作后得到K2Cr2O7固体;
Ⅵ.测定K2Cr2O7固体的纯度。
已知:Cr2O (橙红色)+H2O
(橙红色)+H2O 2CrO
2CrO (黄色)+2H+
(黄色)+2H+
(1)步骤I中红褐色沉淀的化学式是_____ 。
(2)步骤II中加入Na2SO3的目的是_____ 。
(3)步骤IV中反应的离子方程式是_____ 。
(4)步骤V中加入的物质A可以是_____ 。(填序号)
a.KOH b.K2CO3 c.H2SO4 d.SO2
(5)步骤Ⅵ的操作是:取0.45 g K2Cr2O7产品配成溶液,酸化后滴入18.00 mL 0.50 mol/L的FeSO4溶液,恰好使Cr2O 完全转化为Cr3+。产品中K2Cr2O7的纯度是
完全转化为Cr3+。产品中K2Cr2O7的纯度是_____ 。(注:K2Cr2O7的摩尔质量为294 g/mol)
(6)向橙红色的K2Cr2O7溶液中,滴加Ba(NO3)2溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是_____ ,溶液pH变小的原因是_____ 。
Ⅰ.用NaOH溶液调pH至3.6,产生红褐色沉淀,过滤;
Ⅱ.向滤液中加入Na2SO3,一定操作后分离出Na2SO4;
Ⅲ.将分离出Na2SO4后的溶液调pH约为5,得到Cr(OH)3沉淀;
Ⅳ.在KOH存在条件下,向Cr(OH)3中加入足量H2O2溶液,得到黄色溶液;
Ⅴ.向黄色溶液中加入物质A后,溶液变为橙红色,一定操作后得到K2Cr2O7固体;
Ⅵ.测定K2Cr2O7固体的纯度。
已知:Cr2O
 (橙红色)+H2O
(橙红色)+H2O 2CrO
2CrO (黄色)+2H+
(黄色)+2H+(1)步骤I中红褐色沉淀的化学式是
(2)步骤II中加入Na2SO3的目的是
(3)步骤IV中反应的离子方程式是
(4)步骤V中加入的物质A可以是
a.KOH b.K2CO3 c.H2SO4 d.SO2
(5)步骤Ⅵ的操作是:取0.45 g K2Cr2O7产品配成溶液,酸化后滴入18.00 mL 0.50 mol/L的FeSO4溶液,恰好使Cr2O
 完全转化为Cr3+。产品中K2Cr2O7的纯度是
完全转化为Cr3+。产品中K2Cr2O7的纯度是(6)向橙红色的K2Cr2O7溶液中,滴加Ba(NO3)2溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是
您最近一年使用:0次



