名校
解题方法
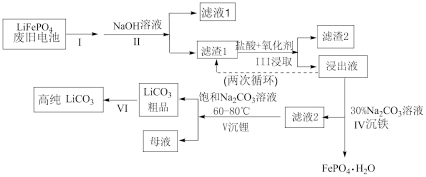
1 . 磷酸亚铁锂电池是新能源汽车的动力电池之一、采用湿法治金工艺回收废旧磷酸亚铁锂电池正极片(除 外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,流程如图:
外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,流程如图:
资料:碳酸锂在水中溶解度:
(1)I步操作是粉碎废旧电极,其主要目的是___________ 。
(2)II步加入过量NaOH溶液后,滤液1中存在的主要阴离子是___________ 。
(3)III步浸取加入的氧化剂最佳选择是___________。(填字母)
(4)浸出液中存在大量 和
和 ,从平衡移动的角度解释Ⅳ步中加入
,从平衡移动的角度解释Ⅳ步中加入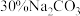 溶液沉铁的主要原理是
溶液沉铁的主要原理是___________ 。
(5)滤液2中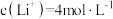 ,加入等体积的
,加入等体积的 溶液后,
溶液后, 的沉降率达到90%,母液中
的沉降率达到90%,母液中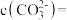
___________ 。[溶液混合后体积变化忽略不计,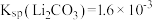 ]
]
(6)为将粗品 提纯,VI步使用
提纯,VI步使用___________ (填“热”或“冰”)水进行洗涤操作,理由是___________ 。
(7)工业上将回收的 、
、 粉碎与足量的炭黑混合高温灼烧再生制备
粉碎与足量的炭黑混合高温灼烧再生制备 ,反应的化学方程式为:
,反应的化学方程式为:___________ 。
 外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,流程如图:
外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,流程如图:
资料:碳酸锂在水中溶解度:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(2)II步加入过量NaOH溶液后,滤液1中存在的主要阴离子是
(3)III步浸取加入的氧化剂最佳选择是___________。(填字母)
A. | B.酸性 | C. | D. |
 和
和 ,从平衡移动的角度解释Ⅳ步中加入
,从平衡移动的角度解释Ⅳ步中加入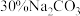 溶液沉铁的主要原理是
溶液沉铁的主要原理是(5)滤液2中
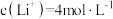 ,加入等体积的
,加入等体积的 溶液后,
溶液后, 的沉降率达到90%,母液中
的沉降率达到90%,母液中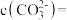
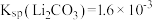 ]
](6)为将粗品
 提纯,VI步使用
提纯,VI步使用(7)工业上将回收的
 、
、 粉碎与足量的炭黑混合高温灼烧再生制备
粉碎与足量的炭黑混合高温灼烧再生制备 ,反应的化学方程式为:
,反应的化学方程式为:
您最近一年使用:0次
2022-02-05更新
|
611次组卷
|
7卷引用:内蒙古赤峰二中2023-2024学年高三上学期第三次月考化学试题
内蒙古赤峰二中2023-2024学年高三上学期第三次月考化学试题重庆市2021-2022学年高三上学期学业质量调研抽测(第一次)化学试卷(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)(已下线)押江苏卷第15题 化学工业流程综合题 -备战2022年高考化学临考题号押题(江苏卷)北京市通州区2022届高三查缺补漏化学试题北京市第十七中学2021-2022学年高三下学期5月模拟考试化学试题广东省华南师范大学附属中学2022届高三下学期押题预测(三)化学试题
名校
解题方法
2 . 合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)⇌2NH3(g) △H=-92.4kJ⋅mol-1
一种工业合成氨的简易流程图如图:
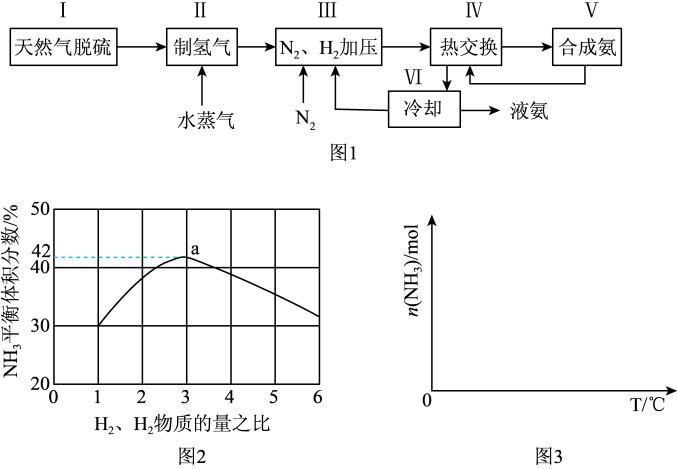
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___ 。
(2)步骤II中制氯气原理如下:
①CH4(g)+H2O(g)=CO2(g)+3H2(g) △H=+206.4kJ⋅mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ⋅mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是___ 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为___ 。
(3)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:___ 。
(4)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图___ 。
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是___ (填序号),简述本流程中提高合成氨原料总转化率的方法:___ 。
一种工业合成氨的简易流程图如图:

(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:
(2)步骤II中制氯气原理如下:
①CH4(g)+H2O(g)=CO2(g)+3H2(g) △H=+206.4kJ⋅mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ⋅mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为
(3)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:
(4)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是
您最近一年使用:0次
2020-01-07更新
|
113次组卷
|
4卷引用:内蒙古集宁一中(东校区)2016-2017学年高二下学期期末考试化学试题



