1 . 工业上以铬铁矿( ,含Al,Si氧化物等杂质)为主要原料制备重铬酸钾的工艺流程如图。回答下列问题:
,含Al,Si氧化物等杂质)为主要原料制备重铬酸钾的工艺流程如图。回答下列问题: (铁、铬分别为
(铁、铬分别为 、
、 价)转化为
价)转化为 和
和 ,同时A1、Si氧化物转化为可溶性钠盐。
,同时A1、Si氧化物转化为可溶性钠盐。
(1)“焙烧”过程与 有关的化学反应中,氧化剂和还原剂物质的量之比为
有关的化学反应中,氧化剂和还原剂物质的量之比为___________ 。“浸取”过程所得滤渣的用途有___________ (合理即可)。
(2)矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶组分浓度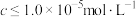 时,可认为已除尽。
时,可认为已除尽。___________ ;从平衡移动的角度解释“酸化”过程加入 的原因
的原因___________ 。
(3)“冷却结晶”时,相关化学反应方程式为___________ 。
(4) 价铬的化合物毒性较大,需将
价铬的化合物毒性较大,需将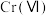 转化为毒性较低的
转化为毒性较低的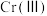 ;工业上可采用电解法处理酸性含铬废水:以铁板做阴、阳极,电解含铬(Ⅵ)废水,示意如图。
;工业上可采用电解法处理酸性含铬废水:以铁板做阴、阳极,电解含铬(Ⅵ)废水,示意如图。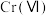 :向含铬(Ⅵ)废水中加入适量
:向含铬(Ⅵ)废水中加入适量 溶液发生反应,生成在乙醚中较稳定存在的
溶液发生反应,生成在乙醚中较稳定存在的 价的含铬氧化物
价的含铬氧化物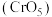 ,1mol
,1mol 中含过氧键
中含过氧键 的数量是
的数量是___________ 。
②电解开始时,A极上主要发生的电极反应式为___________ 。
③电解产生的 将
将 还原为
还原为 同时产生
同时产生 ,其离子方程式为
,其离子方程式为___________ 。
 ,含Al,Si氧化物等杂质)为主要原料制备重铬酸钾的工艺流程如图。回答下列问题:
,含Al,Si氧化物等杂质)为主要原料制备重铬酸钾的工艺流程如图。回答下列问题: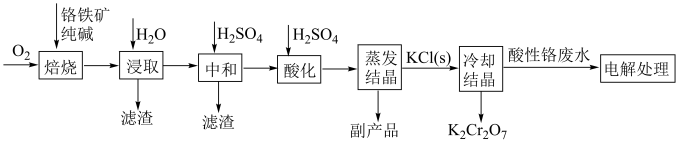
 (铁、铬分别为
(铁、铬分别为 、
、 价)转化为
价)转化为 和
和 ,同时A1、Si氧化物转化为可溶性钠盐。
,同时A1、Si氧化物转化为可溶性钠盐。(1)“焙烧”过程与
 有关的化学反应中,氧化剂和还原剂物质的量之比为
有关的化学反应中,氧化剂和还原剂物质的量之比为(2)矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶组分浓度
 时,可认为已除尽。
时,可认为已除尽。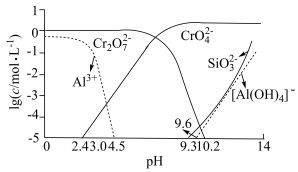
 的原因
的原因(3)“冷却结晶”时,相关化学反应方程式为
(4)
 价铬的化合物毒性较大,需将
价铬的化合物毒性较大,需将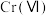 转化为毒性较低的
转化为毒性较低的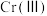 ;工业上可采用电解法处理酸性含铬废水:以铁板做阴、阳极,电解含铬(Ⅵ)废水,示意如图。
;工业上可采用电解法处理酸性含铬废水:以铁板做阴、阳极,电解含铬(Ⅵ)废水,示意如图。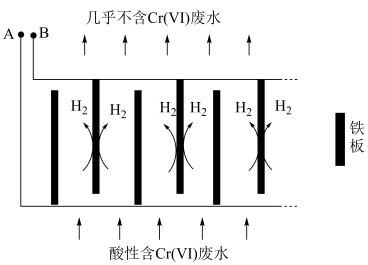
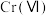 :向含铬(Ⅵ)废水中加入适量
:向含铬(Ⅵ)废水中加入适量 溶液发生反应,生成在乙醚中较稳定存在的
溶液发生反应,生成在乙醚中较稳定存在的 价的含铬氧化物
价的含铬氧化物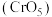 ,1mol
,1mol 中含过氧键
中含过氧键 的数量是
的数量是②电解开始时,A极上主要发生的电极反应式为
③电解产生的
 将
将 还原为
还原为 同时产生
同时产生 ,其离子方程式为
,其离子方程式为
您最近一年使用:0次
2024-04-11更新
|
279次组卷
|
2卷引用:2024届四川省雅安市、遂宁市、眉山市高三第二次诊断性考试理科综合试题-高中化学
名校
2 . 铬铁矿的主要成分的化学式为 FeO ·Cr2O3,还含有 SiO2、Al2O3等杂质。工业上常采用固体碱熔氧法用铬铁矿粉制备重铬酸钾,流程为

(1)铬铁矿经粉碎处理的目的是__ (填“加快”或“减慢”)反应速率。
(2)灼烧是中学化学中常用的操作方法,如在实验室中将铬铁矿和碳酸钠固体混合物灼烧,该过程不需要的仪器是___ (填序号)。
A.陶瓷坩埚 B.铁坩埚 C.三脚架 D.泥三角 E.酒精灯 F.蒸发皿
(3)铬铁矿中的 SiO2和 Al2O3 在反应器中与纯碱共热反应转变为可溶性盐,故 Al2O3与碳酸钠反应生成的可溶性盐的名称 为:________________ 。
(4)化合物 NaFeO2中 Fe 的化合价为______ (填序号)。
A.+2 B.+3 C.+6
该价态对应的简单离子与该元素常见的另一种简单离子相比 ,更稳定的是______ (填序号)。
A.Fe3+ B .Fe2+
(5)通过途径 1 从 Na2CrO4溶液获得 K2Cr2O7晶体,操作步骤有:酸化→加 KCl 固体→操作 a→过滤→洗涤 →干燥
①操作 a 的名称____________________ (填序号)。
A.蒸发结晶 B.蒸发浓缩,冷却结晶 C.蒸馏 D. 萃取
②“酸化”调节溶液 pH<5 其主要目的是_____ (填序号)。
A.增大H+浓度,加快反应速率
B.使2CrO +2H+
+2H+ Cr2O
Cr2O +H2O的平衡向正向移动,尽量将CrO
+H2O的平衡向正向移动,尽量将CrO 转化为Cr2O
转化为Cr2O
(6)将最后制得的晶体溶解、酸化就制成了化学实验中常用的氧化剂——酸性重铬酸钾。酸化过程中常用的酸是_________ (选填“盐酸”、“硫酸”或“硝酸”)。

(1)铬铁矿经粉碎处理的目的是
(2)灼烧是中学化学中常用的操作方法,如在实验室中将铬铁矿和碳酸钠固体混合物灼烧,该过程不需要的仪器是
A.陶瓷坩埚 B.铁坩埚 C.三脚架 D.泥三角 E.酒精灯 F.蒸发皿
(3)铬铁矿中的 SiO2和 Al2O3 在反应器中与纯碱共热反应转变为可溶性盐,故 Al2O3与碳酸钠反应生成的可溶性盐的
(4)化合物 NaFeO2中 Fe 的化合价为
A.+2 B.+3 C.+6
该价态对应的简单离子与该元素常见的另一种简单离子相比 ,更稳定的是
A.Fe3+ B .Fe2+
(5)通过途径 1 从 Na2CrO4溶液获得 K2Cr2O7晶体,操作步骤有:酸化→加 KCl 固体→操作 a→过滤→洗涤 →干燥
①操作 a 的名称
A.蒸发结晶 B.蒸发浓缩,冷却结晶 C.蒸馏 D. 萃取
②“酸化”调节溶液 pH<5 其主要目的是
A.增大H+浓度,加快反应速率
B.使2CrO
 +2H+
+2H+ Cr2O
Cr2O +H2O的平衡向正向移动,尽量将CrO
+H2O的平衡向正向移动,尽量将CrO 转化为Cr2O
转化为Cr2O
(6)将最后制得的晶体溶解、酸化就制成了化学实验中常用的氧化剂——酸性重铬酸钾。酸化过程中常用的酸是
您最近一年使用:0次
名校
3 . 手机主板中含有贵金属单质Au(金)、Ag和Pd(钯)。如图方法可从侤旧手机主板中回收贵金属。

已知:i.Au+3 +6H+
+6H+ Au3++3NO2↑+3H2O K<10-5
Au3++3NO2↑+3H2O K<10-5
Au+ +4H+
+4H+ Au3++NO↑+2H2O K<10-5
Au3++NO↑+2H2O K<10-5
Au3++4Cl- [AuCl4]- K>105
[AuCl4]- K>105
ii.HAuCl4=H++[AuCl4]-
(1)酸浸前,将废旧手机主板粉碎的目的是_______ 。
(2)已知:王水[V(浓硝酸):V(浓盐酸)=1:3]溶金反应时产生NO。
①写出该反应的离子方程式:________ 。
②从反应原理的角度解释浓盐酸的作用________ 。
(3)若用Zn粉将溶液中的1molHAuCl4完全还原,则参加反应的Zn的物质的量是________ mol。
(4)AgCl溶于氨水的离子方程式为________ 。
(5)水合肼(N2H4•H2O)是一种液态还原剂,能直接与AgCl反应生成单质Ag。上述工艺中,先将氯化银溶于氨水,再与水合肼反应,除了“碱性条件下水合肼的还原性增强”,还具有的优点可能有________ (写出一条即可)。
(6)Pd(NH3)2Cl2难溶于水,溶于氨水,是一种电镀试剂,是制备钯及其化合物的重要原料。加入氨水,[PdCl4]2-转化为[Pd(NH3)4]2+,则该条件下配位能力:Cl-_______ NH3(填“>”或“<”)。

已知:i.Au+3
 +6H+
+6H+ Au3++3NO2↑+3H2O K<10-5
Au3++3NO2↑+3H2O K<10-5Au+
 +4H+
+4H+ Au3++NO↑+2H2O K<10-5
Au3++NO↑+2H2O K<10-5Au3++4Cl-
 [AuCl4]- K>105
[AuCl4]- K>105ii.HAuCl4=H++[AuCl4]-
(1)酸浸前,将废旧手机主板粉碎的目的是
(2)已知:王水[V(浓硝酸):V(浓盐酸)=1:3]溶金反应时产生NO。
①写出该反应的离子方程式:
②从反应原理的角度解释浓盐酸的作用
(3)若用Zn粉将溶液中的1molHAuCl4完全还原,则参加反应的Zn的物质的量是
(4)AgCl溶于氨水的离子方程式为
(5)水合肼(N2H4•H2O)是一种液态还原剂,能直接与AgCl反应生成单质Ag。上述工艺中,先将氯化银溶于氨水,再与水合肼反应,除了“碱性条件下水合肼的还原性增强”,还具有的优点可能有
(6)Pd(NH3)2Cl2难溶于水,溶于氨水,是一种电镀试剂,是制备钯及其化合物的重要原料。加入氨水,[PdCl4]2-转化为[Pd(NH3)4]2+,则该条件下配位能力:Cl-
您最近一年使用:0次
2023-08-31更新
|
155次组卷
|
2卷引用:四川省泸县第一中学2023-2024学年高二上学期10月月考化学试题
名校
解题方法
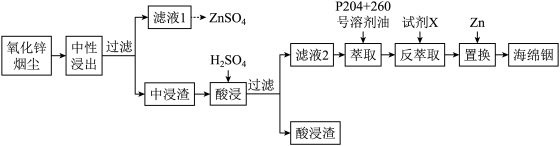
4 . 铟(In)是一种稀散金属,常与其他金属矿石伴生,回收氧化锌烟尘(主要成分是ZnO,还含少量PbO、FeS、FeSiO3、 In2O3、 In2S3等)中的金属铟的工艺流程如下:
已知:室温下,金属离子开始沉淀和完全沉淀的pH如表所示。
回答下列问题:
(1)In2O3中In的化合价是_______________________ 。
(2)“中性浸出”的过程为:先加入稀硫酸和适量氧化剂MnO2氧化酸浸氧化锌烟尘,反应结束前半个小时加入CaO调整pH=5.0~5.2。
①FeSiO3与稀H2SO4反应的化学方程式为____________________________________________ 。
②氧化酸浸过程中,In2S3中的硫元素被MnO2氧化为 ,该反应的离子方程式为
,该反应的离子方程式为____________________ 。
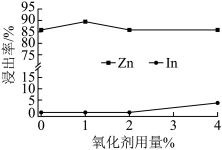
③氧化剂用量对中性浸出效果的影响如图所示。最佳氧化剂用量为_________________ 。
④“中浸渣”的主要成分为In(OH)3、________________ 。 (写化学式)
(3)萃取时,发生反应In3+ +3H2A2 In(HA2)3 +3H+,H2A2代表有机萃取剂。
In(HA2)3 +3H+,H2A2代表有机萃取剂。
①反萃取时,宜选用的试剂X为_____________________ (写化学式)
②实验室进行萃取和反萃取时,均需要使用的玻璃仪器有_________________________ 。
(4)“置换”后的滤液可返回________________________ (填“滤液 1”或“滤液2”)中利用。
(5)“置换”时锌粉的利用率为90%,若想获得6.9 kg海绵铟,需要使用锌粉___ _kg (结果保留1位小数)

已知:室温下,金属离子开始沉淀和完全沉淀的pH如表所示。
金属离子 | Fe3+ | Fe2+ | In3+ |
开始沉淀pH(离子浓度为0.1mol·L-1时) | 1.3 | 6 | 3 |
完全沉淀pH | 2.7 | 8 | 4.3 |
(1)In2O3中In的化合价是
(2)“中性浸出”的过程为:先加入稀硫酸和适量氧化剂MnO2氧化酸浸氧化锌烟尘,反应结束前半个小时加入CaO调整pH=5.0~5.2。
①FeSiO3与稀H2SO4反应的化学方程式为
②氧化酸浸过程中,In2S3中的硫元素被MnO2氧化为
 ,该反应的离子方程式为
,该反应的离子方程式为③氧化剂用量对中性浸出效果的影响如图所示。最佳氧化剂用量为

④“中浸渣”的主要成分为In(OH)3、
(3)萃取时,发生反应In3+ +3H2A2
 In(HA2)3 +3H+,H2A2代表有机萃取剂。
In(HA2)3 +3H+,H2A2代表有机萃取剂。①反萃取时,宜选用的试剂X为
②实验室进行萃取和反萃取时,均需要使用的玻璃仪器有
(4)“置换”后的滤液可返回
(5)“置换”时锌粉的利用率为90%,若想获得6.9 kg海绵铟,需要使用锌粉
您最近一年使用:0次
解题方法
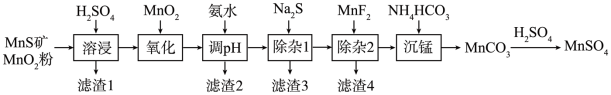
5 . 一种由天然MnO2矿与MnS矿(含Fe、Al、Mg、Zn、Ni、Si等元素的氧化物)制备高纯碳酸锰工艺如下:
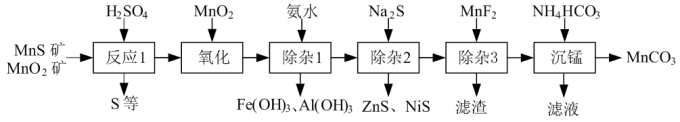
(1)写出两条“反应1”中能提高矿石浸取率的措施_______ 。
(2)“反应1”后所得沉淀物中除S外,一定还含有的氧化物是_______ (填化学式)。
(3)从平衡移动的角度解释氨水除Al3+的原理_______ 。
(4)“除杂2”后溶液中c(Zn2+)=1×10−5mol·L−1,则溶液中c(Ni2+)=_______ mol·L−1.[已知:Ksp(ZnS)=2×10−22,Ksp(NiS)=1×10−24]
(5)“滤渣”的成分为_______ (填化学式,下同);“滤液”中所含溶质的主要成分为_______ 。
(6)“沉锰”过程中,不能用相同浓度碳酸钠代替碳酸氢铵的原因可能是_______ 。

(1)写出两条“反应1”中能提高矿石浸取率的措施
(2)“反应1”后所得沉淀物中除S外,一定还含有的氧化物是
(3)从平衡移动的角度解释氨水除Al3+的原理
(4)“除杂2”后溶液中c(Zn2+)=1×10−5mol·L−1,则溶液中c(Ni2+)=
(5)“滤渣”的成分为
(6)“沉锰”过程中,不能用相同浓度碳酸钠代替碳酸氢铵的原因可能是
您最近一年使用:0次
名校
解题方法
6 . 铅铬黄是一种颜料,主要成分是铬酸铅 (摩尔质量323g/mol)。现以
(摩尔质量323g/mol)。现以 和
和 等为原料制备该物质,并测定产物纯度。
等为原料制备该物质,并测定产物纯度。
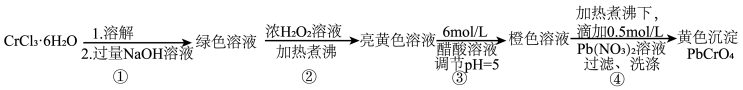
回答下列问题:
(1)已知 不溶于水,具有两性。第①步所得绿色溶液中的有色离子是
不溶于水,具有两性。第①步所得绿色溶液中的有色离子是_______ 。
(2)第②步生成了 ,写出该步骤的离子方程式
,写出该步骤的离子方程式_______ 。为了使 反应充分而不剩余,以下方案中最合理的是
反应充分而不剩余,以下方案中最合理的是_______ (填序号)。
A.首先加热绿色溶液,然后将一定量 浓溶液滴入其中
浓溶液滴入其中
B.首先加热 浓溶液,然后转入热的绿色溶液中
浓溶液,然后转入热的绿色溶液中
C.首先将一定量 浓溶液滴入绿色溶液中,然后加热煮沸
浓溶液滴入绿色溶液中,然后加热煮沸
(3)第③步调节pH=5的目的是为了将 转化为
转化为_______ (填写离子符号),并且防止在碱性条件下_______ 形成沉淀。
(4)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④步中逐滴滴加 溶液后,产生
溶液后,产生 黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:
黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:_______ 。
(5)测定铅铬黄的纯度:取mg铅铭黄样品用盐酸酸化溶解,加足量KI将其还原为 ,再用
,再用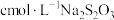 标准溶液滴定至淡黄绿色,发生反应
标准溶液滴定至淡黄绿色,发生反应 。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=_______ (用含c、m和V的式子表示)。
 (摩尔质量323g/mol)。现以
(摩尔质量323g/mol)。现以 和
和 等为原料制备该物质,并测定产物纯度。
等为原料制备该物质,并测定产物纯度。
回答下列问题:
(1)已知
 不溶于水,具有两性。第①步所得绿色溶液中的有色离子是
不溶于水,具有两性。第①步所得绿色溶液中的有色离子是(2)第②步生成了
 ,写出该步骤的离子方程式
,写出该步骤的离子方程式 反应充分而不剩余,以下方案中最合理的是
反应充分而不剩余,以下方案中最合理的是A.首先加热绿色溶液,然后将一定量
 浓溶液滴入其中
浓溶液滴入其中B.首先加热
 浓溶液,然后转入热的绿色溶液中
浓溶液,然后转入热的绿色溶液中C.首先将一定量
 浓溶液滴入绿色溶液中,然后加热煮沸
浓溶液滴入绿色溶液中,然后加热煮沸(3)第③步调节pH=5的目的是为了将
 转化为
转化为(4)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④步中逐滴滴加
 溶液后,产生
溶液后,产生 黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:
黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:(5)测定铅铬黄的纯度:取mg铅铭黄样品用盐酸酸化溶解,加足量KI将其还原为
 ,再用
,再用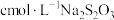 标准溶液滴定至淡黄绿色,发生反应
标准溶液滴定至淡黄绿色,发生反应 。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
您最近一年使用:0次
2022-08-30更新
|
242次组卷
|
2卷引用:四川省成都市第七中学2023届高三上学期入学考试化学试题
解题方法
7 . 铅在有色金属产量中居第四位,全世界消费的铅中大约有80%~85%用于铅蓄电池,下面是废铅蓄电池预处理获得的铅膏回收制取PbCl2的工艺流程:

已知:①铅膏含铅组成表:
②PbCl2是白色结晶性粉末,微溶于冷水,易溶于热水、浓盐酸和氢氧化钠溶液。
③已知浸取时PbSO4可溶于盐酸与食盐水混合溶液生成 。
。
回答下列问题:
(1)铅膏浸取前通常需要研磨,目的是_______ 。
(2)“浸取”过程会产生混合气体,其成分是_______ 和少量Cl2,写出PbO2氧化盐酸产生Cl2的化学方程式_______ 。
(3)25℃时PbCl2固体在浓盐酸中存在平衡:PbCl2(s)+2Cl-(aq)
 (aq),从平衡移动角度分析浸取时加入饱和食盐水的目的是
(aq),从平衡移动角度分析浸取时加入饱和食盐水的目的是_______ 。
(4)铅膏浸取时,浓盐酸与水配比(浓盐酸与水的体积比)对铅浸出率的影响如下图1,温度对铅浸出率的影响如下图2。

①浸取时,最合理的浓盐酸与水配比和温度分别是:_______ ,_______ 。
②低于70℃时,随温度升高铅浸出率增大的原因可能是(写一点):_______ 。
(5)提高铅回收率,可将IV步滤液补加一定量盐酸后循环用于铅膏浸取,重复循环实验,所得结果如下:
循环实验铅浸出率、铅回收率及氯化铅纯度表
循环4次后产品PbCl2的纯度骤降,增加的杂质主要是钠盐(填化学式):_______ 。为了恢复PbCl2的纯度,可以在IV步滤液中加入CaCl2使杂质离子沉淀后再进行循环操作,请用离子方程式表示其除杂原理:_______ 。

已知:①铅膏含铅组成表:
| 物相 | PbO | PbO2 | PbSO4 | Pb | 总铅 |
| 含量/% | 15.89 | 4.86 | 33.74 | 34.03 | 76.05 |
③已知浸取时PbSO4可溶于盐酸与食盐水混合溶液生成
 。
。回答下列问题:
(1)铅膏浸取前通常需要研磨,目的是
(2)“浸取”过程会产生混合气体,其成分是
(3)25℃时PbCl2固体在浓盐酸中存在平衡:PbCl2(s)+2Cl-(aq)

 (aq),从平衡移动角度分析浸取时加入饱和食盐水的目的是
(aq),从平衡移动角度分析浸取时加入饱和食盐水的目的是(4)铅膏浸取时,浓盐酸与水配比(浓盐酸与水的体积比)对铅浸出率的影响如下图1,温度对铅浸出率的影响如下图2。

①浸取时,最合理的浓盐酸与水配比和温度分别是:
②低于70℃时,随温度升高铅浸出率增大的原因可能是(写一点):
(5)提高铅回收率,可将IV步滤液补加一定量盐酸后循环用于铅膏浸取,重复循环实验,所得结果如下:
循环实验铅浸出率、铅回收率及氯化铅纯度表
| 循环次数 | 0 | 1 | 2 | 3 | 4 |
| 铅浸出率/% | 99.5 | 99.5 | 99.4 | 99.5 | 99. 3 |
| 铅回收率/% | 85.4 | 93.5 | 95.8 | 97.1 | 98.2 |
| 氯化铅纯度/% | 99.4 | 99.3 | 99.2 | 99.1 | 96.1 |
您最近一年使用:0次
10-11高三上·江苏盐城·期中
名校
8 . 重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O

试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:___________ 。
(2)操作③的目的是什么,用简要的文字说明:____________________________ 。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:_______ 。
(4)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是:________________ ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度(设整个过程中其它杂质不参与反应)____________ 。
 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:
(2)操作③的目的是什么,用简要的文字说明:
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
(4)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是:
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度(设整个过程中其它杂质不参与反应)
您最近一年使用:0次
名校
解题方法
9 . 合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)⇌2NH3(g) △H=-92.4kJ⋅mol-1
一种工业合成氨的简易流程图如图:
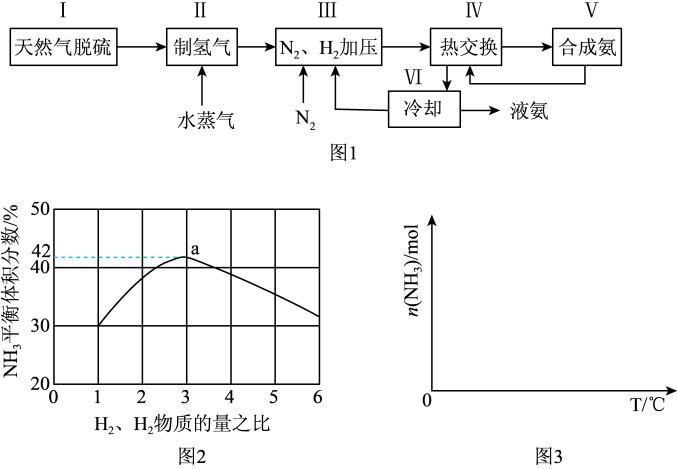
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___ 。
(2)步骤II中制氯气原理如下:
①CH4(g)+H2O(g)=CO2(g)+3H2(g) △H=+206.4kJ⋅mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ⋅mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是___ 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为___ 。
(3)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:___ 。
(4)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图___ 。
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是___ (填序号),简述本流程中提高合成氨原料总转化率的方法:___ 。
一种工业合成氨的简易流程图如图:

(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:
(2)步骤II中制氯气原理如下:
①CH4(g)+H2O(g)=CO2(g)+3H2(g) △H=+206.4kJ⋅mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ⋅mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为
(3)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:
(4)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是
您最近一年使用:0次
2020-01-07更新
|
113次组卷
|
4卷引用:2016-2017学年四川省成都市树德中学高二10月阶段性考试化学试卷
真题
名校
10 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
(1)“滤渣1”含有S和__________________________ ;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________ 。
(2)“氧化”中添加适量的MnO2的作用是将________________________ 。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______ ~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________ 。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________ 。
(6)写出“沉锰”的离子方程式___________________________________________________ 。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y= 时,z=
时,z=___________ 。
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和
(2)“氧化”中添加适量的MnO2的作用是将
(3)“调pH”除铁和铝,溶液的pH范围应调节为
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(6)写出“沉锰”的离子方程式
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=
 时,z=
时,z=
您最近一年使用:0次
2019-06-09更新
|
19596次组卷
|
29卷引用:2020届四川省成都市第七中学高三三月份网络教学质量监测卷化学试题
2020届四川省成都市第七中学高三三月份网络教学质量监测卷化学试题四川省宜宾市叙州区第一中学校2020届高三下学期第四学月考试理综化学试题四川省宜宾市叙州区第二中学校2020届高三第一次高考适应性考试理综化学试题四川省泸州市泸县第五中学2022届高三高考适应性考试理综化学试题2019年全国统一高考化学试题(新课标Ⅲ)河北省张家口市第四中学2018-2019学年高二下学期6月月考理科综合化学试题 河北省辛集中学2020届高三上学期入学考试化学试题安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题甘肃省高台县第一中学2020届高三上学期期中考试化学试题山东省滕州市第一中学2020届高三3月线上模拟考试化学试题(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训河北省承德市围场卉原中学2020届高三模拟自测联考试卷理综化学试卷(已下线)专题6.1 无机化工流程题(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升黑龙江省大庆市第四中学2020届高三下学期4月月考理综化学试题河南省信阳市罗山县2021届高三第一次调研(8月联考)化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三章素养检测(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)江西省宜春市第九中学2021-2022学年高三上学期10月月考化学试题天津市第二十五中学2021-2022学年高三上学期第一次月考化学试题(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题18 工艺流程题(已下线)T26-工业流程题黑龙江省七台河市勃利县高级中学2022-2023学年高三上学期11月期中考试化学试题陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题河南省济源市高级中学2023-2024学年高三上学期高考模拟检测(10月)理科综合试题-高中化学



