2023高三·全国·专题练习
1 . 实验小组探究酸对 平衡的影响。将0.050mol/L
平衡的影响。将0.050mol/L 溶液(接近无色)和0.1mol/LKSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。
溶液(接近无色)和0.1mol/LKSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。
(1)甲同学认为加入酸后,会使 体系中
体系中___________ 浓度改变,导致该平衡正向移动,溶液颜色加深。
【设计并实施实验】
【查阅资料】
 和
和 、
、 均能发生络合反应:
均能发生络合反应:
 (黄色);
(黄色); (无色)。
(无色)。
实验I.探究现象a中溶液颜色变化的原因
(2)实验①的目的是___________ 。
(3)根据实验①和实验②的结果,从平衡移动角度解释现象a:___________ 。
 平衡的影响。将0.050mol/L
平衡的影响。将0.050mol/L 溶液(接近无色)和0.1mol/LKSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。
溶液(接近无色)和0.1mol/LKSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。(1)甲同学认为加入酸后,会使
 体系中
体系中【设计并实施实验】
 |  |
 和
和 、
、 均能发生络合反应:
均能发生络合反应: (黄色);
(黄色); (无色)。
(无色)。实验I.探究现象a中溶液颜色变化的原因
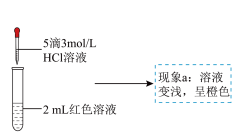
| 编号 | 操作 | 现象 |
| ① | 向2mL红色溶液中滴加5滴水 | 溶液颜色无明显变化 |
| ② | 向2mL红色溶液中滴加5滴3mol/LKCl溶液 | 溶液颜色变浅,呈橙色 |
(2)实验①的目的是
(3)根据实验①和实验②的结果,从平衡移动角度解释现象a:
您最近半年使用:0次
2 . 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
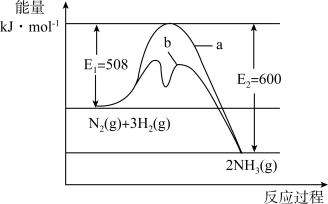
(1)根据图提供的信息,写出该反应的热化学方程式___________ ,在图中曲线___________ (填“a”或“b”)表示加入铁触媒的能量变化曲线,判断理由是___________ 。
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是___________
(3)一定温度下,向2 L密闭容器中充入1 mol N2和3 mol H2,保持体积不变,0.5 min后达到平衡,测得容器中有0.4 mol NH3,则平均反应速率v(N2)=___________ ,该温度下的平衡常数K=___________ 。(小数点后保留3位有效数字)
(4)保持温度和体积不变,向上述平衡体系中再加入1 mol N2、1 mol H2 、1 mol NH3 后该反应的速率大小关系为v正___________ v逆(填“大于”、“小于”或“等于”)。

(1)根据图提供的信息,写出该反应的热化学方程式
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是___________
| A.3v(H2)正=2v(NH3)逆 |
| B.单位时间内生成n mol N2的同时生成2n mol NH3 |
| C.混合气体的密度不再改变 |
| D.容器内压强不随时间的变化而变化 |
(3)一定温度下,向2 L密闭容器中充入1 mol N2和3 mol H2,保持体积不变,0.5 min后达到平衡,测得容器中有0.4 mol NH3,则平均反应速率v(N2)=
(4)保持温度和体积不变,向上述平衡体系中再加入1 mol N2、1 mol H2 、1 mol NH3 后该反应的速率大小关系为v正
您最近半年使用:0次
2023-11-04更新
|
80次组卷
|
2卷引用:甘肃省兰州市教育局第四片区联考2023-2024学年高二上学期期中考试化学试题
名校
解题方法
3 . 某课外活动小组为了探究外界条件对化学平衡的影响,做了如下实验:
(1)已知颜色深浅(I)与有色物质浓度(c)和观察深度(L)的乘积成正比: (式中k为常数)。在a、b两支容积均为30mL的针筒中分别抽入
(式中k为常数)。在a、b两支容积均为30mL的针筒中分别抽入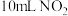 气体,将针筒前端封闭。
气体,将针筒前端封闭。

①将a针筒活塞迅速推至5mL处,从视线1处观察到的现象是___________ ;
②将b针筒活塞迅速拉至20mL处,从视线2处观察到的现象是___________ 。
(2)探究浓度对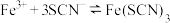 平衡的影响。将
平衡的影响。将 溶液(接近无色)和
溶液(接近无色)和 溶液等体积混合,将得到的红色溶液分为两等份。甲、乙两同学分别取一份向其中加入少量KCl(s)。
溶液等体积混合,将得到的红色溶液分为两等份。甲、乙两同学分别取一份向其中加入少量KCl(s)。
①甲同学根据中学所掌握知识预测红色应该___________ (填“变深”“变浅”或“不变”)。
②乙同学查阅资料得知该反应为配位反应,且学习到更多配离子,如冰晶石中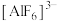 、银氨溶液中
、银氨溶液中 、
、 、
、 等。因此预测红色应该
等。因此预测红色应该___________ (填“变深”“变浅”或“不变”),理由:___________ 。
(1)已知颜色深浅(I)与有色物质浓度(c)和观察深度(L)的乘积成正比:
 (式中k为常数)。在a、b两支容积均为30mL的针筒中分别抽入
(式中k为常数)。在a、b两支容积均为30mL的针筒中分别抽入 气体,将针筒前端封闭。
气体,将针筒前端封闭。
①将a针筒活塞迅速推至5mL处,从视线1处观察到的现象是
②将b针筒活塞迅速拉至20mL处,从视线2处观察到的现象是
(2)探究浓度对
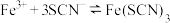 平衡的影响。将
平衡的影响。将 溶液(接近无色)和
溶液(接近无色)和 溶液等体积混合,将得到的红色溶液分为两等份。甲、乙两同学分别取一份向其中加入少量KCl(s)。
溶液等体积混合,将得到的红色溶液分为两等份。甲、乙两同学分别取一份向其中加入少量KCl(s)。①甲同学根据中学所掌握知识预测红色应该
②乙同学查阅资料得知该反应为配位反应,且学习到更多配离子,如冰晶石中
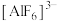 、银氨溶液中
、银氨溶液中 、
、 、
、 等。因此预测红色应该
等。因此预测红色应该
您最近半年使用:0次
2023-10-12更新
|
120次组卷
|
3卷引用:山东省泰安第一中学2023-2024学年高二上学期10月月考化学试题
名校
解题方法
4 . 重铬酸钾是强氧化剂,在实验室和工业中都有很广泛的应用。用于制铬矾、火柴、铬颜料、电镀、有机合成等。
(1)K2Cr2O7溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(i) (aq)+H2O(l)⇌2HCrO
(aq)+H2O(l)⇌2HCrO (aq) K1=3.0×10-2(25℃)
(aq) K1=3.0×10-2(25℃)
(ii)HCrO (aq)⇌
(aq)⇌ (aq)+H+(aq) K2=3.3×10-7(25℃)
(aq)+H+(aq) K2=3.3×10-7(25℃)
①下列有关K2Cr2O7溶液的说法正确的有___________ 。
A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(i)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时c2(HCrO )与c(
)与c( )的比值保持不变
)的比值保持不变
②25℃时,0.10mol•L-1K2Cr2O7溶液中 、HCrO
、HCrO 与
与 的平衡浓度分别为x、y、zmol•L-1,则x、y、z之间的关系式为
的平衡浓度分别为x、y、zmol•L-1,则x、y、z之间的关系式为___________ =0.10。
(2)现有含少量杂质的FeCl2⋅nH2O,为测定n值进行如下实验:
称取m1g样品,用足量稀硫酸溶解后,用cmol/LK2Cr2O7标准溶液滴定Fe2+达终点时消耗VmL(滴定过程中 转化为Cr3+,Cl-不反应)。
转化为Cr3+,Cl-不反应)。
①滴定时应将K2Cr2O7溶液加入___________ (填“酸式”或“碱式”)滴定管中,在规格为50.00mL的滴定管中,若起始读数为10.00mL,此时滴定管中溶液的实际体积为___________ (填标号)。
A.10.00mL B.40mL C.大于40mL D.小于40mL
②滴定过程中操作滴定管的图示正确的是___________ 。
A. B.
B.  C.
C.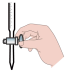
③下列关于滴定分析的操作,不正确的是___________ 。
A.滴定前应将滴定管烘干后再装溶液
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
④下列情况会导致n测量值偏小的是___________ (填标号)。
①样品中含少量FeO杂质;
②实验中,称重后样品发生了潮解;
③滴定达终点时发现滴定管尖嘴内有气泡生成;
④滴定时,滴定管洗涤后直接装标准液;
⑤滴定前平视读数,滴定后俯视读数。
(1)K2Cr2O7溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(i)
 (aq)+H2O(l)⇌2HCrO
(aq)+H2O(l)⇌2HCrO (aq) K1=3.0×10-2(25℃)
(aq) K1=3.0×10-2(25℃)(ii)HCrO
 (aq)⇌
(aq)⇌ (aq)+H+(aq) K2=3.3×10-7(25℃)
(aq)+H+(aq) K2=3.3×10-7(25℃)①下列有关K2Cr2O7溶液的说法正确的有
A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(i)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时c2(HCrO
 )与c(
)与c( )的比值保持不变
)的比值保持不变②25℃时,0.10mol•L-1K2Cr2O7溶液中
 、HCrO
、HCrO 与
与 的平衡浓度分别为x、y、zmol•L-1,则x、y、z之间的关系式为
的平衡浓度分别为x、y、zmol•L-1,则x、y、z之间的关系式为(2)现有含少量杂质的FeCl2⋅nH2O,为测定n值进行如下实验:
称取m1g样品,用足量稀硫酸溶解后,用cmol/LK2Cr2O7标准溶液滴定Fe2+达终点时消耗VmL(滴定过程中
 转化为Cr3+,Cl-不反应)。
转化为Cr3+,Cl-不反应)。①滴定时应将K2Cr2O7溶液加入
A.10.00mL B.40mL C.大于40mL D.小于40mL
②滴定过程中操作滴定管的图示正确的是
A.
 B.
B.  C.
C.
③下列关于滴定分析的操作,不正确的是
A.滴定前应将滴定管烘干后再装溶液
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
④下列情况会导致n测量值偏小的是
①样品中含少量FeO杂质;
②实验中,称重后样品发生了潮解;
③滴定达终点时发现滴定管尖嘴内有气泡生成;
④滴定时,滴定管洗涤后直接装标准液;
⑤滴定前平视读数,滴定后俯视读数。
您最近半年使用:0次
名校
解题方法
5 . 元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子,原子核外有_______ 种不同能量的电子,写出其最外层电子的轨道表示式_______ ;碘元素在元素周期表中的位置是_______ ;液溴的保存通常采取的方法是_______ 。
(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是_______(填序号)。
(3) 与
与 反应生成
反应生成 和一种黑色固体。在25℃、101kPa下,已知该反应消耗
和一种黑色固体。在25℃、101kPa下,已知该反应消耗 ,放热44.5kJ,该反应的热化学方程式是
,放热44.5kJ,该反应的热化学方程式是_______ 。
(4)已知: 的熔点为1040℃,
的熔点为1040℃, 在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:
在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:_______
(5)HClO有很好的杀菌消毒效果。为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:_______
(6)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是_______ (填字母)。
a.海盐提纯:

b.海水提镁:
c.海带提碘: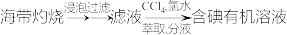

d.海水提溴:
(1)与氯元素同族的短周期元素的原子,原子核外有
(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是_______(填序号)。
A. 、 、 、 、 的氧化性 的氧化性 | B. 、 、 、 、 的熔点 的熔点 |
| C.HCl、HBr、HI的热稳定性 | D.HCl、HBr、HI的酸性 |
 与
与 反应生成
反应生成 和一种黑色固体。在25℃、101kPa下,已知该反应消耗
和一种黑色固体。在25℃、101kPa下,已知该反应消耗 ,放热44.5kJ,该反应的热化学方程式是
,放热44.5kJ,该反应的热化学方程式是(4)已知:
 的熔点为1040℃,
的熔点为1040℃, 在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:
在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:(5)HClO有很好的杀菌消毒效果。为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:
(6)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是
a.海盐提纯:


b.海水提镁:

c.海带提碘:
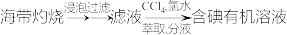

d.海水提溴:

您最近半年使用:0次
2022-11-11更新
|
167次组卷
|
2卷引用:上海市宝山区行知中学2022-2023学年高三上学期期中测试化学试题
解题方法
6 . 兴趣小组同学为探究影响化学反应速率及化学平衡的因素,设计以下实验:

(1)利用实验I探究锌与稀硫酸反应的速率,需要记录的实验数据有:___________ 。
(2)利用实验II探究浓度对化学平衡的影响。已知: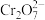 (橙色)
(橙色)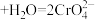 (黄色)
(黄色)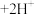 ,推测B试管中的实验现象为:
,推测B试管中的实验现象为:___________ ,用平衡移动原理解释其原因:___________ 。
(3)该小组同学继续用酸性 溶液和草酸(
溶液和草酸( )溶液进行实验,设计实验方案如表所示。请回答相关问题:
)溶液进行实验,设计实验方案如表所示。请回答相关问题:
①实验时,分别量取 溶液和酸性
溶液和酸性 溶液,迅速混合并开始计时,通过测定
溶液,迅速混合并开始计时,通过测定___________ 来判断反应的快慢。
②实验a、b、c所加的 溶液均要过量。理由是
溶液均要过量。理由是___________ 。
③实验a和b是探究___________ 对化学反应速率的影响。实验b和c是探究___________ 对化学反应速率的影响。
④实验a和b起初反应均很慢,过了一会儿速率突然增大,可能原因是___________ 。

(1)利用实验I探究锌与稀硫酸反应的速率,需要记录的实验数据有:
(2)利用实验II探究浓度对化学平衡的影响。已知:
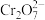 (橙色)
(橙色)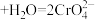 (黄色)
(黄色) ,推测B试管中的实验现象为:
,推测B试管中的实验现象为:(3)该小组同学继续用酸性
 溶液和草酸(
溶液和草酸( )溶液进行实验,设计实验方案如表所示。请回答相关问题:
)溶液进行实验,设计实验方案如表所示。请回答相关问题:| 编号 | 温度℃ |  溶液 溶液 | 酸性 溶液 溶液 | ||
浓度/( ) ) | 体积/mL | 浓度/( ) ) | 体积/mL | ||
| a | 25 | 0.10 | 2.0 | 0.010 | 4.0 |
| b | 25 | 0.20 | 2.0 | 0.010 | 4.0 |
| c | 50 | 0.20 | 2.0 | 0.010 | 4.0 |
 溶液和酸性
溶液和酸性 溶液,迅速混合并开始计时,通过测定
溶液,迅速混合并开始计时,通过测定②实验a、b、c所加的
 溶液均要过量。理由是
溶液均要过量。理由是③实验a和b是探究
④实验a和b起初反应均很慢,过了一会儿速率突然增大,可能原因是
您最近半年使用:0次
名校
解题方法
7 . 雾霾严重危害人类健康和生态环境,开发稳定高效的脱硫脱硝工艺技术是国内外研究的热点。研究表明,氮氧化物(NOx)和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如下图所示。
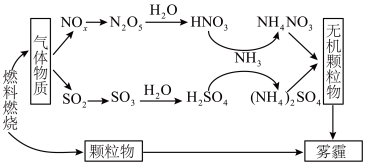
(1)NH4NO3溶液中的离子浓度由大到小顺序是_______ 。
(2)① 已知:SO2生成SO3总反应方程式是:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ/mol
2SO3(g) ΔH=-196.6 kJ/mol
此反应可通过如下两步完成:
2NO(g)+O2 (g ) 2NO2(g) ΔH1=-113 kJ/mol
2NO2(g) ΔH1=-113 kJ/mol
NO2(g)+SO2(g) SO3(g)+NO(g) ΔH2=
SO3(g)+NO(g) ΔH2=_______ 。
② 一定温度下,向2 L恒容密闭容器中充入NO2和SO2各1 mol,5min达到平衡,此时容器中NO2和NO的浓度之比为1∶3,则NO2的平衡转化率是_______ 。
(3)SO2属于酸性氧化物,将其通入NaOH溶液中,得到NaHSO3溶液。
①NaHSO3溶液呈酸性,其原因是_______
② 向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因是_______
(4)某同学用中和滴定法测定某烧碱样品的纯度,实验步骤如下:
Ⅰ、配制待测液:称量5.0 g烧碱样品(杂质不与硫酸反应),配成1000 mL溶液;
Ⅱ、滴定:取20.00mL所配待测液,用0.05mol·L-1的H2SO4标准溶液进行滴定,达到滴定终点后,重复此操作两次;记录数据如下表:
计算烧碱样品的纯度是_______ (计算结果保留三位有效数字)
下列实验操作,会使测定结果偏高的是_______ 。
A.酸式滴定管未润洗就装H2SO4标准溶液滴定
B.锥形瓶在蒸馏水洗净后未用待测液润洗
C.读取H2SO4标准溶液读数时,滴定前仰视,滴定到终点后俯视
D.滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失

(1)NH4NO3溶液中的离子浓度由大到小顺序是
(2)① 已知:SO2生成SO3总反应方程式是:2SO2(g)+O2(g)
 2SO3(g) ΔH=-196.6 kJ/mol
2SO3(g) ΔH=-196.6 kJ/mol此反应可通过如下两步完成:
2NO(g)+O2 (g )
 2NO2(g) ΔH1=-113 kJ/mol
2NO2(g) ΔH1=-113 kJ/molNO2(g)+SO2(g)
 SO3(g)+NO(g) ΔH2=
SO3(g)+NO(g) ΔH2=② 一定温度下,向2 L恒容密闭容器中充入NO2和SO2各1 mol,5min达到平衡,此时容器中NO2和NO的浓度之比为1∶3,则NO2的平衡转化率是
(3)SO2属于酸性氧化物,将其通入NaOH溶液中,得到NaHSO3溶液。
①NaHSO3溶液呈酸性,其原因是
② 向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因是
(4)某同学用中和滴定法测定某烧碱样品的纯度,实验步骤如下:
Ⅰ、配制待测液:称量5.0 g烧碱样品(杂质不与硫酸反应),配成1000 mL溶液;
Ⅱ、滴定:取20.00mL所配待测液,用0.05mol·L-1的H2SO4标准溶液进行滴定,达到滴定终点后,重复此操作两次;记录数据如下表:
| 测定序号 | 待测溶液体积(mL) | 所耗H2SO4标准溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
| 3 | 20.00 | 1.30 | 21.50 |
计算烧碱样品的纯度是
下列实验操作,会使测定结果偏高的是
A.酸式滴定管未润洗就装H2SO4标准溶液滴定
B.锥形瓶在蒸馏水洗净后未用待测液润洗
C.读取H2SO4标准溶液读数时,滴定前仰视,滴定到终点后俯视
D.滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失
您最近半年使用:0次
解题方法
8 . 一种由天然MnO2矿与MnS矿(含Fe、Al、Mg、Zn、Ni、Si等元素的氧化物)制备高纯碳酸锰工艺如下:
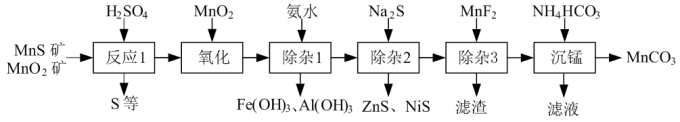
(1)写出两条“反应1”中能提高矿石浸取率的措施_______ 。
(2)“反应1”后所得沉淀物中除S外,一定还含有的氧化物是_______ (填化学式)。
(3)从平衡移动的角度解释氨水除Al3+的原理_______ 。
(4)“除杂2”后溶液中c(Zn2+)=1×10−5mol·L−1,则溶液中c(Ni2+)=_______ mol·L−1.[已知:Ksp(ZnS)=2×10−22,Ksp(NiS)=1×10−24]
(5)“滤渣”的成分为_______ (填化学式,下同);“滤液”中所含溶质的主要成分为_______ 。
(6)“沉锰”过程中,不能用相同浓度碳酸钠代替碳酸氢铵的原因可能是_______ 。

(1)写出两条“反应1”中能提高矿石浸取率的措施
(2)“反应1”后所得沉淀物中除S外,一定还含有的氧化物是
(3)从平衡移动的角度解释氨水除Al3+的原理
(4)“除杂2”后溶液中c(Zn2+)=1×10−5mol·L−1,则溶液中c(Ni2+)=
(5)“滤渣”的成分为
(6)“沉锰”过程中,不能用相同浓度碳酸钠代替碳酸氢铵的原因可能是
您最近半年使用:0次
名校
解题方法
9 . 由γ-丁酸生成γ-丁内酯的反应如下:HOCH2CH2CH2COOH
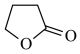 +H2O,在298K下,γ-羟基丁酸水溶液的初始浓度为0.180mol/L,测得γ-丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
+H2O,在298K下,γ-羟基丁酸水溶液的初始浓度为0.180mol/L,测得γ-丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
(1)该反应在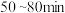 内的平均反应速率为
内的平均反应速率为_______  。
。
(2)该反应化学平衡常数K的表达式是_______ ,298K时该反应的平衡常数K=_______ 。
(3)求120min时γ-羟基丁酸的转化率为_______ (请写出计算过程,注意格式规范)
(4)为提高γ-羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是_______

 +H2O,在298K下,γ-羟基丁酸水溶液的初始浓度为0.180mol/L,测得γ-丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
+H2O,在298K下,γ-羟基丁酸水溶液的初始浓度为0.180mol/L,测得γ-丁内酯的浓度随时间变化的数据如表所示。回答下列问题: | 21 | 50 | 80 | 100 | 120 | 160 | 220 |  |
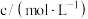 | 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
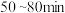 内的平均反应速率为
内的平均反应速率为 。
。(2)该反应化学平衡常数K的表达式是
(3)求120min时γ-羟基丁酸的转化率为
(4)为提高γ-羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是
您最近半年使用:0次
名校
解题方法
10 . 重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为 ,还含有硅、铝等杂质。制备流程如图所示:
,还含有硅、铝等杂质。制备流程如图所示:
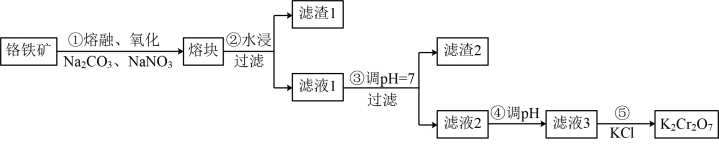
回答下列问题:
(1)步骤①的主要反应为: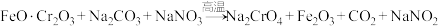
上述反应配平后 与
与 的系数比为
的系数比为___________ 。
(2)滤渣1中含量最多的金属元素是___________ ,滤渣2的主要成分是___________ 及含硅杂质。
(3)步骤④调滤液2的 使之变
使之变___________ (填“大”或“小”),原因是___________ (用离子方程式表示)。
(4)有关物质的溶解度如图所示。

向“滤液3”中加入适量 ,蒸发浓缩,冷却结晶,过滤得到
,蒸发浓缩,冷却结晶,过滤得到 固体。冷却到
固体。冷却到___________ (填标号)得到的 固体产品最多。
固体产品最多。
a. 80℃ b. 60℃ c. 40℃ d. 10℃
 ,还含有硅、铝等杂质。制备流程如图所示:
,还含有硅、铝等杂质。制备流程如图所示:
回答下列问题:
(1)步骤①的主要反应为:
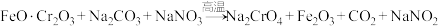
上述反应配平后
 与
与 的系数比为
的系数比为(2)滤渣1中含量最多的金属元素是
(3)步骤④调滤液2的
 使之变
使之变(4)有关物质的溶解度如图所示。

向“滤液3”中加入适量
 ,蒸发浓缩,冷却结晶,过滤得到
,蒸发浓缩,冷却结晶,过滤得到 固体。冷却到
固体。冷却到 固体产品最多。
固体产品最多。a. 80℃ b. 60℃ c. 40℃ d. 10℃
您最近半年使用:0次
2022-09-12更新
|
322次组卷
|
2卷引用:河南省洛阳市第一高级中学2022~2023学年高三上学期9月月考化学试题



