解题方法
1 . 金属镍广泛应用于制造记忆合金、储氢合金以及用作加氢反应的催化剂,是重要的战略物资,但资源匮乏。由镍矿渣[主要含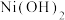 、NiS,还含锌、铁、钙的氧化物、
、NiS,还含锌、铁、钙的氧化物、 等]制备草酸镍晶体的流程如图:
等]制备草酸镍晶体的流程如图: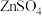 与萃取剂(用HA表示)存在:
与萃取剂(用HA表示)存在: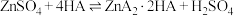
(1)“酸浸”过程中,生成了一种臭鸡蛋气味的气体,写出相应反应的离子方程式_______ ,滤渣1的主要成分是_______ 。
(2)已知“除铁”时,NaClO的作用是将 氧化为
氧化为 并转化为
并转化为 沉淀而除去,若将氧化剂改为
沉淀而除去,若将氧化剂改为 ,写出
,写出 与
与 反应生成
反应生成 的化学方程式
的化学方程式_______ 。
(3)“除钙”时,加入 溶液使钙离子转化为
溶液使钙离子转化为 沉淀,写出
沉淀,写出 的电子式
的电子式_______ 。
(4)若已知萃取剂的密度大于水的密度,则应保留_______ 液体。(填“上层”或“下层”)在完成“萃取”操作后,后续操作依次为_______ 、_______ 。
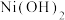 、NiS,还含锌、铁、钙的氧化物、
、NiS,还含锌、铁、钙的氧化物、 等]制备草酸镍晶体的流程如图:
等]制备草酸镍晶体的流程如图: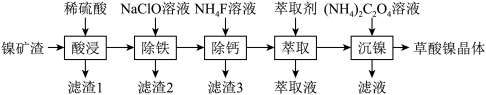
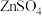 与萃取剂(用HA表示)存在:
与萃取剂(用HA表示)存在:
(1)“酸浸”过程中,生成了一种臭鸡蛋气味的气体,写出相应反应的离子方程式
(2)已知“除铁”时,NaClO的作用是将
 氧化为
氧化为 并转化为
并转化为 沉淀而除去,若将氧化剂改为
沉淀而除去,若将氧化剂改为 ,写出
,写出 与
与 反应生成
反应生成 的化学方程式
的化学方程式(3)“除钙”时,加入
 溶液使钙离子转化为
溶液使钙离子转化为 沉淀,写出
沉淀,写出 的电子式
的电子式(4)若已知萃取剂的密度大于水的密度,则应保留
您最近一年使用:0次
名校
解题方法
2 . 元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子,原子核外有_______ 种不同能量的电子,写出其最外层电子的轨道表示式_______ ;碘元素在元素周期表中的位置是_______ ;液溴的保存通常采取的方法是_______ 。
(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是_______(填序号)。
(3) 与
与 反应生成
反应生成 和一种黑色固体。在25℃、101kPa下,已知该反应消耗
和一种黑色固体。在25℃、101kPa下,已知该反应消耗 ,放热44.5kJ,该反应的热化学方程式是
,放热44.5kJ,该反应的热化学方程式是_______ 。
(4)已知: 的熔点为1040℃,
的熔点为1040℃, 在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:
在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:_______
(5)HClO有很好的杀菌消毒效果。为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:_______
(6)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是_______ (填字母)。
a.海盐提纯:

b.海水提镁:
c.海带提碘: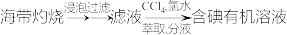

d.海水提溴:
(1)与氯元素同族的短周期元素的原子,原子核外有
(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是_______(填序号)。
A. 、 、 、 、 的氧化性 的氧化性 | B. 、 、 、 、 的熔点 的熔点 |
| C.HCl、HBr、HI的热稳定性 | D.HCl、HBr、HI的酸性 |
 与
与 反应生成
反应生成 和一种黑色固体。在25℃、101kPa下,已知该反应消耗
和一种黑色固体。在25℃、101kPa下,已知该反应消耗 ,放热44.5kJ,该反应的热化学方程式是
,放热44.5kJ,该反应的热化学方程式是(4)已知:
 的熔点为1040℃,
的熔点为1040℃, 在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:
在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:(5)HClO有很好的杀菌消毒效果。为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:
(6)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是
a.海盐提纯:


b.海水提镁:

c.海带提碘:
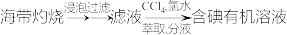

d.海水提溴:

您最近一年使用:0次
2022-11-11更新
|
171次组卷
|
2卷引用:上海市宝山区行知中学2022-2023学年高三上学期期中测试化学试题
名校
3 . 某实验小组采用下列实验探究外界条件对化学反应速率及其化学平衡的影响。按要求回答下列问题:
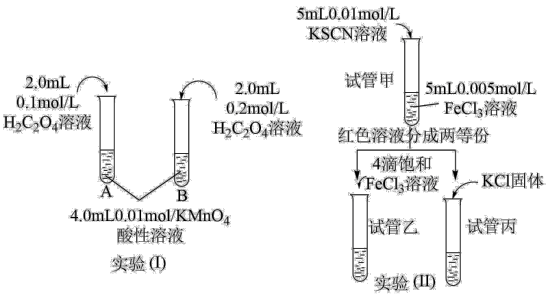
(1)实验(1)目的是探究浓度对反应速率的影响。
①为了观察到明显的现象,它们初始物质的量需要满足的关系为:n(H2C2O4):n(KMnO4)_______ 。
②在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
甲同学据此提出以下假设:
假设1:反应放热
假设2:生成Mn2+对反应有催化作用
乙同学用如下实验证明假设2成立:
则实验b中V=_______ mL,在实验b中加入蒸馏水的目的是_______ 。预期的实验现象是_______ 。
(2)实验(II)探究浓度对化学平衡的影响。
①试管甲中发生反应的离子方程式为_______ 。
②试管乙中的现象是_______ ,说明增大溶液中的Fe3+浓度,平衡_______ 。(正移、逆移或不移动)
③向试管丙中加入KC1固体,平衡_______ 。(正移、逆移或不移动)

(1)实验(1)目的是探究浓度对反应速率的影响。
①为了观察到明显的现象,它们初始物质的量需要满足的关系为:n(H2C2O4):n(KMnO4)
②在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
甲同学据此提出以下假设:
假设1:反应放热
假设2:生成Mn2+对反应有催化作用
乙同学用如下实验证明假设2成立:
| 实验 编号 | 室温下,试管中所加试剂及用量/mL | |||
| 0.20mol/LH2C2O4溶液 | 0.10mol/L酸性KMnO4溶液 | 0.10mol/LMnSO4溶液 | H2O | |
| a | 4.00 | 1.00 | 1.00 | 0 |
| b | 4.00 | 1.00 | 0 | V |
(2)实验(II)探究浓度对化学平衡的影响。
①试管甲中发生反应的离子方程式为
②试管乙中的现象是
③向试管丙中加入KC1固体,平衡
您最近一年使用:0次
名校
解题方法
4 . 近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+ Cl2(g) ΔH1=+83 kJ∙mol−1
Cl2(g) ΔH1=+83 kJ∙mol−1
CuCl(s)+ O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=−20 kJ∙mol−1
Cl2(g) ΔH2=−20 kJ∙mol−1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=−121 kJ∙mol−1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=___________ kJ∙mol−1
(2)Deacon发明的直接氧化法原理为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g),在刚性容器中,进料浓度比c(HCl)∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系如图所示:

据图象分析可知:反应平衡常数K(300 ℃)___________ K(400 ℃)(填“大于”或“小于”)。
(3)设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据,计算K(400 ℃)=___________ (列出计算式)。
(4)按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是___________ 、___________ 。在一定温度的条件下,进一步提高HCl的转化率的方法是___________ 。(写出2种)
(1)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+
 Cl2(g) ΔH1=+83 kJ∙mol−1
Cl2(g) ΔH1=+83 kJ∙mol−1CuCl(s)+
 O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=−20 kJ∙mol−1
Cl2(g) ΔH2=−20 kJ∙mol−1CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=−121 kJ∙mol−1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=
(2)Deacon发明的直接氧化法原理为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g),在刚性容器中,进料浓度比c(HCl)∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系如图所示:

据图象分析可知:反应平衡常数K(300 ℃)
(3)设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据,计算K(400 ℃)=
(4)按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是
您最近一年使用:0次
2021-05-18更新
|
301次组卷
|
2卷引用:海南省海口市2021年高三高考调研测试化学试题
名校
解题方法
5 . 乙酸丁酯的物理性质如表。
实验室用如图所示的实验装置制取乙酸丁酯。

(1)仪器A的名称___ 。
(2)写出制取乙酸丁酯的化学方程式:__ 。
(3)该实验中生成物除了主产物乙酸丁酯外,还可能生成的有机副产物有__ (写出一种结构简式)。
(4)酯化反应是一个可逆反应,为提高1-丁醇的转化率,可采取的措施是__ (写出两条)。
(5)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,需要的是__ (填答案编号)。


(6)用60g乙酸与37g1-丁醇反应,实验中得到乙酸丁酯的质量为40.6g,则乙酸丁酯的产率为___ 。
| 乙酸 | 1-丁醇 | 乙酸丁酯 | |
| 熔点(℃) | 16.6 | -89.5 | -73.5 |
| 沸点(℃) | 117.9 | 117 | 126.3 |
| 密度(g/cm3) | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 可溶(9g/100g水) | 微溶 |
实验室用如图所示的实验装置制取乙酸丁酯。

(1)仪器A的名称
(2)写出制取乙酸丁酯的化学方程式:
(3)该实验中生成物除了主产物乙酸丁酯外,还可能生成的有机副产物有
(4)酯化反应是一个可逆反应,为提高1-丁醇的转化率,可采取的措施是
(5)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,需要的是


(6)用60g乙酸与37g1-丁醇反应,实验中得到乙酸丁酯的质量为40.6g,则乙酸丁酯的产率为
您最近一年使用:0次



