名校
解题方法
1 . 探究溶液中Ag+与单质S的反应。
资料:Ag2S不溶于6mol/L盐酸,Ag2SO3和Ag2SO4在6mol/L盐酸中均发生沉淀的转化
实验Ⅰ.在注射器中将10mL0.04mol/LAgNO3溶液(pH≈6)与0.01g S粉混合,水浴加热,充分反应后,过滤,得到无色溶液a(pH≈1),沉淀除S、洗涤后得到黑色固体b。
(1)研究黑色固体b的组成
①根据S具有__________ 性,推测b中可能含有Ag2S、Ag、Ag2SO3或Ag2SO4。
②检验黑色固体b的成分______ 。
ⅱ.用滤液c继续实验证明了黑色固体b中不含Ag2SO3,可选择的试剂是______ (填序号)。
a.酸性KMnO4溶液 b.H2O2和BaCl2的混合溶液 c.溴水
ⅲ.进一步实验证实了黑色固体b中不含Ag。根据沉淀e含有Ag、气体含有H2S,写出同时生成Ag和H2S的离子方程式:_________________ 。
(2)研究无色溶液a的组成
结合上述实验结果,分析溶液a中可能存在 或H2SO3,依据是
或H2SO3,依据是_______________ 。___________________ 。
②加入足量稀盐酸的作用是_________________ 。
(3)在注射器中进行实验Ⅳ,探究Ag2SO4溶液与S的反应,所得产物与实验Ⅰ相同。向注射器中加入的物质是__________________ 。
(4)用酸化的NaNO3溶液(pH≈6)与S进行实验Ⅴ,发现二者不反应。综合以上实验,写出溶液中Ag+与S反应的离子方程式并简要说明Ag+的作用:_______________ 。
资料:Ag2S不溶于6mol/L盐酸,Ag2SO3和Ag2SO4在6mol/L盐酸中均发生沉淀的转化
实验Ⅰ.在注射器中将10mL0.04mol/LAgNO3溶液(pH≈6)与0.01g S粉混合,水浴加热,充分反应后,过滤,得到无色溶液a(pH≈1),沉淀除S、洗涤后得到黑色固体b。
(1)研究黑色固体b的组成
①根据S具有
②检验黑色固体b的成分
实验Ⅱ.
ⅱ.用滤液c继续实验证明了黑色固体b中不含Ag2SO3,可选择的试剂是
a.酸性KMnO4溶液 b.H2O2和BaCl2的混合溶液 c.溴水
ⅲ.进一步实验证实了黑色固体b中不含Ag。根据沉淀e含有Ag、气体含有H2S,写出同时生成Ag和H2S的离子方程式:
(2)研究无色溶液a的组成
结合上述实验结果,分析溶液a中可能存在
 或H2SO3,依据是
或H2SO3,依据是实验Ⅲ.
②加入足量稀盐酸的作用是
(3)在注射器中进行实验Ⅳ,探究Ag2SO4溶液与S的反应,所得产物与实验Ⅰ相同。向注射器中加入的物质是
(4)用酸化的NaNO3溶液(pH≈6)与S进行实验Ⅴ,发现二者不反应。综合以上实验,写出溶液中Ag+与S反应的离子方程式并简要说明Ag+的作用:
您最近一年使用:0次
名校
2 . 草酸钴在化学中应用广泛,可用于制备催化剂等。以钻矿[主要成分为 、
、 、
、 ,含少量的
,含少量的 、
、 、
、 、
、 、
、 等]为原料制取草酸钴晶体
等]为原料制取草酸钴晶体 的工艺流程如图所示。
的工艺流程如图所示。
(1) 位于元素周期表中第
位于元素周期表中第___________ 周期第___________ 族。
(2)浸出渣的主要成分是___________ (填化学式)。“浸取”时 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(3)“氧化”过程中消耗 的量明显偏高的原因是
的量明显偏高的原因是___________ (用化学方程式表示)。
(4)取“调节 ”后所得滤液,将
”后所得滤液,将 调至9.4,可得到
调至9.4,可得到 沉淀,在空气中
沉淀,在空气中 煅烧该沉淀得到
煅烧该沉淀得到 的化学方程式为
的化学方程式为___________ 。
(5)“提纯”分为萃取和反萃取两步进行。向除杂后的溶液中加入某有机酸萃取剂 发生反应
发生反应 当溶液
当溶液 处于一定范围内时,测得
处于一定范围内时,测得 萃取率随溶液
萃取率随溶液 的增大而增大,其原因是
的增大而增大,其原因是___________ 。反萃取时,应加入___________ 。
(6)取 草酸钴晶体,在空气中加热至恒重,得到
草酸钴晶体,在空气中加热至恒重,得到 和
和 的混合物
的混合物 ,则该混合物中
,则该混合物中 的质量为
的质量为___________  。
。
 、
、 、
、 ,含少量的
,含少量的 、
、 、
、 、
、 、
、 等]为原料制取草酸钴晶体
等]为原料制取草酸钴晶体 的工艺流程如图所示。
的工艺流程如图所示。
(1)
 位于元素周期表中第
位于元素周期表中第(2)浸出渣的主要成分是
 发生反应的化学方程式为
发生反应的化学方程式为(3)“氧化”过程中消耗
 的量明显偏高的原因是
的量明显偏高的原因是(4)取“调节
 ”后所得滤液,将
”后所得滤液,将 调至9.4,可得到
调至9.4,可得到 沉淀,在空气中
沉淀,在空气中 煅烧该沉淀得到
煅烧该沉淀得到 的化学方程式为
的化学方程式为(5)“提纯”分为萃取和反萃取两步进行。向除杂后的溶液中加入某有机酸萃取剂
 发生反应
发生反应 当溶液
当溶液 处于一定范围内时,测得
处于一定范围内时,测得 萃取率随溶液
萃取率随溶液 的增大而增大,其原因是
的增大而增大,其原因是(6)取
 草酸钴晶体,在空气中加热至恒重,得到
草酸钴晶体,在空气中加热至恒重,得到 和
和 的混合物
的混合物 ,则该混合物中
,则该混合物中 的质量为
的质量为 。
。
您最近一年使用:0次
名校
解题方法
3 . CCTV在“新闻30分”中介绍:王者归“铼”,我国发现超级铁矿,飞机上天全靠它。铼(Re)是一种稀散金属,广泛应用于航空航天领域。工业上从高铼废料(含 等)中提取铼的一种工艺流程如图所示:
等)中提取铼的一种工艺流程如图所示: 。
。
回答下列问题:
(1)“焙烧”时,高铼废料粉末与富氧空气逆流混合的目的为___________ 。该工序中,ReS2发生反应的化学方程式为___________ 。
(2)其他条件相同时,“离子交换”过程中料液和D296体积比与铼交换率、铼交换量的变化关系如图1所示;混合溶液的pH与 提取率的变化关系如图2所示。
提取率的变化关系如图2所示。___________ 。
②其他条件相同,混合溶液的pH>1.5时, 的提取率降低的主要原因为
的提取率降低的主要原因为___________ 。
(3)“反萃取”时,选用的试剂X为盐酸的理由为___________ 。
(4)另一种途径从炼铜废液中来提取铼,其简易工艺流程如图,(部分副产物省略,铼在废液中以 形式存在):
形式存在):___________ 方法提纯高铼酸铵晶体。
(5)废料中的Ni元素经一系列操作可得到金属镍,金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图及晶胞参数如图所示。该晶体的化学式为___________ ;晶体密度为___________ g∙cm-3 (列出含a、b、NA的计算表达式,NA表示阿伏加德罗常数的值)。
 等)中提取铼的一种工艺流程如图所示:
等)中提取铼的一种工艺流程如图所示:
 。
。回答下列问题:
(1)“焙烧”时,高铼废料粉末与富氧空气逆流混合的目的为
(2)其他条件相同时,“离子交换”过程中料液和D296体积比与铼交换率、铼交换量的变化关系如图1所示;混合溶液的pH与
 提取率的变化关系如图2所示。
提取率的变化关系如图2所示。
②其他条件相同,混合溶液的pH>1.5时,
 的提取率降低的主要原因为
的提取率降低的主要原因为(3)“反萃取”时,选用的试剂X为盐酸的理由为
(4)另一种途径从炼铜废液中来提取铼,其简易工艺流程如图,(部分副产物省略,铼在废液中以
 形式存在):
形式存在):
(5)废料中的Ni元素经一系列操作可得到金属镍,金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图及晶胞参数如图所示。该晶体的化学式为

您最近一年使用:0次
名校
4 . 锶( )与钙同主族,某固态化合物Y的组成为
)与钙同主族,某固态化合物Y的组成为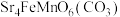 ,以Y为原料可实现如下转化:
,以Y为原料可实现如下转化: 均不能形成配合物。请回答:
均不能形成配合物。请回答:
(1)写出溶液C中的所有阳离子___________ 。
(2)步骤Ⅴ中的反应为 ,说明
,说明 能够较完全转化为
能够较完全转化为 ,的两个原因分别是:①生成
,的两个原因分别是:①生成 降低了体系的能量,促使反应正向进行②
降低了体系的能量,促使反应正向进行②___________ 。
(3)下列说法不正确 的是___________。
(4)固体Y可与 溶液反应,写出该反应的离子方程式
溶液反应,写出该反应的离子方程式___________ 。
(5)设计实验方案检验气体中除 以外的两种主要成分
以外的两种主要成分___________ 。
 )与钙同主族,某固态化合物Y的组成为
)与钙同主族,某固态化合物Y的组成为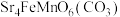 ,以Y为原料可实现如下转化:
,以Y为原料可实现如下转化:
 均不能形成配合物。请回答:
均不能形成配合物。请回答:(1)写出溶液C中的所有阳离子
(2)步骤Ⅴ中的反应为
 ,说明
,说明 能够较完全转化为
能够较完全转化为 ,的两个原因分别是:①生成
,的两个原因分别是:①生成 降低了体系的能量,促使反应正向进行②
降低了体系的能量,促使反应正向进行②(3)下列说法
A.固体B中含有 | B.步骤Ⅱ反应促进了 的水解 的水解 |
C.步骤Ⅲ可推断碱性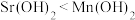 | D.直接加热 无法获得 无法获得 |
(4)固体Y可与
 溶液反应,写出该反应的离子方程式
溶液反应,写出该反应的离子方程式(5)设计实验方案检验气体中除
 以外的两种主要成分
以外的两种主要成分
您最近一年使用:0次
名校
5 . 过氧化锶(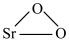 )通常用作分析试剂、氧化剂、漂白剂等。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。
)通常用作分析试剂、氧化剂、漂白剂等。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。
②SrO2在空气中会变质生成碳酸盐,写出该反应的化学方程式
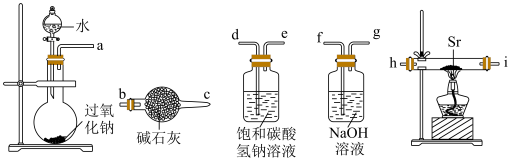
③连接好装置进行实验,实验步骤如下,正确的操作顺序为
a、打开分液漏斗活塞,将水滴入烧瓶中b、检查装置气密性c、在相应装置中装入药品d、加热e、关闭分液漏斗活塞f、停止加热
(2)乙同学在通入氨气的条件下,在水溶液中可制备得到SrO2·8H2O,实验装置如图:
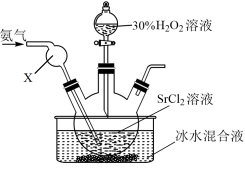
②写出该方法制备SrO2·8H2O的离子方程式
③实验结束后,得到SrO2·8H2O的操作为
(3)除SrO2·8H2O外,请选择下列试剂:FeCl2溶液、HCl溶液、HNO3溶液、KSCN溶液、H2O2溶液设计实验证明SrO2的氧化性比FeCl3的氧化性强:
您最近一年使用:0次
6 . 甲醇是一种可再生的清洁能源,二氧化碳催化加氢制甲醇,有利于实现“碳达峰”、“碳中和”。已知有关 的热化学方程式如下:
的热化学方程式如下:
Ⅰ. ,
,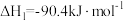 ;
;
Ⅱ. ,
, ;
;
Ⅲ. ,
,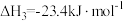 ;
;
Ⅳ. ,
,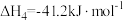 ;
;
请回答下列问题:
(1)

_______ 。
(2)在体积一定的密闭容器中按物质的量比1:2充入CO和 ,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中
,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中 的体积分数在不同压强下随温度变化的平衡曲线。
的体积分数在不同压强下随温度变化的平衡曲线。 ,温度为300℃时,反应Ⅰ的压强平衡常数
,温度为300℃时,反应Ⅰ的压强平衡常数
_______ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②反应Ⅰ达平衡后,下列措施能提高 产率的是
产率的是_______ (填字母)。
A.加入适量一氧化碳 B.升高温度 C.使用高效催化剂 D.增大压强
(3)一定温度下,向容积为1L的恒容密闭容器中,充入 和
和 ,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:
,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:_______ 的浓度随时间的变化; 内,
内, 的平均反应速率为
的平均反应速率为_______  。
。
(4)对于反应Ⅲ,其速率方程式为 ,
, ,
, ,
, 为速率常数且只与温度有关,则该反应的平衡常数
为速率常数且只与温度有关,则该反应的平衡常数
_______ (用含 、
、 的代数式表示)。
的代数式表示)。
已知某温度下,上述反应平衡常数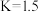 ,在密闭容器中充入一定物质的量的
,在密闭容器中充入一定物质的量的 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:
此时正、逆反应速率的大小:
_______  。
。
 的热化学方程式如下:
的热化学方程式如下:Ⅰ.
 ,
,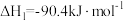 ;
;Ⅱ.
 ,
, ;
;Ⅲ.
 ,
,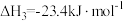 ;
;Ⅳ.
 ,
,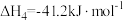 ;
;请回答下列问题:
(1)


(2)在体积一定的密闭容器中按物质的量比1:2充入CO和
 ,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中
,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中 的体积分数在不同压强下随温度变化的平衡曲线。
的体积分数在不同压强下随温度变化的平衡曲线。
 ,温度为300℃时,反应Ⅰ的压强平衡常数
,温度为300℃时,反应Ⅰ的压强平衡常数
②反应Ⅰ达平衡后,下列措施能提高
 产率的是
产率的是A.加入适量一氧化碳 B.升高温度 C.使用高效催化剂 D.增大压强
(3)一定温度下,向容积为1L的恒容密闭容器中,充入
 和
和 ,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:
,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示: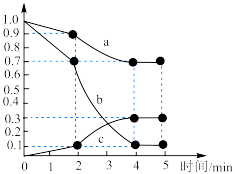
 内,
内, 的平均反应速率为
的平均反应速率为 。
。(4)对于反应Ⅲ,其速率方程式为
 ,
, ,
, ,
, 为速率常数且只与温度有关,则该反应的平衡常数
为速率常数且只与温度有关,则该反应的平衡常数
 、
、 的代数式表示)。
的代数式表示)。已知某温度下,上述反应平衡常数
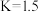 ,在密闭容器中充入一定物质的量的
,在密闭容器中充入一定物质的量的 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:| 物质 |  |  | 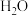 |
| 物质的量/mol | 0.2 | 0.2 | 0.2 |

 。
。
您最近一年使用:0次
解题方法
7 . 乙烯是一种基本化工原料,广泛应用于高新材料合成、医药合成等。工业上,乙烯的制备途径有多种。回答下列问题:
(1)二氧化碳催化加氢制备乙烯
反应原理: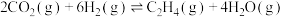
 。已知相关物质的标准摩尔生成焓数据如表所示[标准摩尔生成焓(
。已知相关物质的标准摩尔生成焓数据如表所示[标准摩尔生成焓( )是指在标准压力下,一定温度时,由元素最稳定的单质合成1摩尔物质时的反应焓变]。
)是指在标准压力下,一定温度时,由元素最稳定的单质合成1摩尔物质时的反应焓变]。
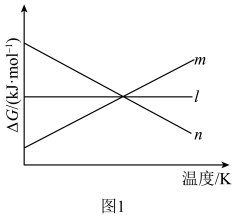
①△H=______ ;△G随着温度变化的三种趋势如图1所示,能用来表示该反应的曲线是________ (填字母标号)。 和3mol
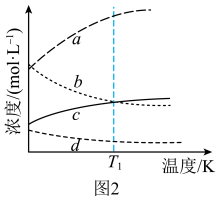
和3mol  ,发生上述反应。平衡体系中各成分的浓度随温度的变化如图2所示。则图中代表
,发生上述反应。平衡体系中各成分的浓度随温度的变化如图2所示。则图中代表 的曲线是
的曲线是______ (填字母标号); K时,该反应的化学平衡常数
K时,该反应的化学平衡常数
___________ 。
主反应:
副反应:
某温度下,向0.5L恒容密闭容器中充入1mol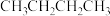 (g),发生上述反应。保持温度不变,正丁烷与乙烯的浓度随时间的变化关系如图3所示。
(g),发生上述反应。保持温度不变,正丁烷与乙烯的浓度随时间的变化关系如图3所示。
①反应开始至达平衡过程中,副反应平均反应速率v(丙烯)=_______ 。
②平衡时乙烯的选择性η(乙烯)=_________ 。
[已知选择性 ]
]
③第12min时,其他条件不变,扩大容器容积至1L,至14min体系再次达到平衡,请在图3中画出乙烯的浓度随时间的变化曲线示意图_________ 。
(1)二氧化碳催化加氢制备乙烯
反应原理:
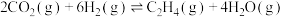
 。已知相关物质的标准摩尔生成焓数据如表所示[标准摩尔生成焓(
。已知相关物质的标准摩尔生成焓数据如表所示[标准摩尔生成焓( )是指在标准压力下,一定温度时,由元素最稳定的单质合成1摩尔物质时的反应焓变]。
)是指在标准压力下,一定温度时,由元素最稳定的单质合成1摩尔物质时的反应焓变]。物质 |
|
|
|
|
|
| 0 | 52.3 |
|
 和3mol
和3mol  ,发生上述反应。平衡体系中各成分的浓度随温度的变化如图2所示。则图中代表
,发生上述反应。平衡体系中各成分的浓度随温度的变化如图2所示。则图中代表 的曲线是
的曲线是 K时,该反应的化学平衡常数
K时,该反应的化学平衡常数
主反应:

副反应:

某温度下,向0.5L恒容密闭容器中充入1mol
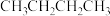 (g),发生上述反应。保持温度不变,正丁烷与乙烯的浓度随时间的变化关系如图3所示。
(g),发生上述反应。保持温度不变,正丁烷与乙烯的浓度随时间的变化关系如图3所示。①反应开始至达平衡过程中,副反应平均反应速率v(丙烯)=
②平衡时乙烯的选择性η(乙烯)=
[已知选择性
 ]
]③第12min时,其他条件不变,扩大容器容积至1L,至14min体系再次达到平衡,请在图3中画出乙烯的浓度随时间的变化曲线示意图

您最近一年使用:0次
8 . 大气中 能通过高温下与
能通过高温下与 反应进行协同转化处理。反应原理为:
反应进行协同转化处理。反应原理为: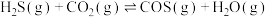 ,工业中测得的产物中有
,工业中测得的产物中有 、
、 、CO等副产物。
、CO等副产物。
(1)一定温度下,在恒容密闭容器中发生以上反应,下列条件能判断反应达到平衡状态的是___________。
(2)在573K下,向2L恒容密闭容器中通入2mol 和1mol
和1mol  ,反应达到平衡后水蒸气的物质的量分数为0.2。
,反应达到平衡后水蒸气的物质的量分数为0.2。
①上述条件下 的平衡转化率
的平衡转化率
___________ %。
②在上述平衡体系中再加2mol 和2mol
和2mol  ,通过数据说明平衡移动的方向
,通过数据说明平衡移动的方向___________ 。
(3)在不同温度下,向密闭容器甲、乙中分别充入2mol 和1mol
和1mol  ,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的
,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的 平衡转化率随温度变化关系如图所示。
平衡转化率随温度变化关系如图所示。___________ 。
A.甲 B.乙 C.甲、乙中任一个
②1173K以后平衡转化率变化的原因可能是___________ 。
 能通过高温下与
能通过高温下与 反应进行协同转化处理。反应原理为:
反应进行协同转化处理。反应原理为: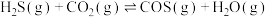 ,工业中测得的产物中有
,工业中测得的产物中有 、
、 、CO等副产物。
、CO等副产物。(1)一定温度下,在恒容密闭容器中发生以上反应,下列条件能判断反应达到平衡状态的是___________。
A.容器内 不再生成 不再生成 | B.容器内压强不再发生变化 |
| C.容器内气体密度不再发生变化 | D. |
(2)在573K下,向2L恒容密闭容器中通入2mol
 和1mol
和1mol  ,反应达到平衡后水蒸气的物质的量分数为0.2。
,反应达到平衡后水蒸气的物质的量分数为0.2。①上述条件下
 的平衡转化率
的平衡转化率
②在上述平衡体系中再加2mol
 和2mol
和2mol  ,通过数据说明平衡移动的方向
,通过数据说明平衡移动的方向(3)在不同温度下,向密闭容器甲、乙中分别充入2mol
 和1mol
和1mol  ,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的
,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的 平衡转化率随温度变化关系如图所示。
平衡转化率随温度变化关系如图所示。
A.甲 B.乙 C.甲、乙中任一个
②1173K以后平衡转化率变化的原因可能是
您最近一年使用:0次
9 . 工业上以铬铁矿( ,含Al,Si氧化物等杂质)为主要原料制备重铬酸钾的工艺流程如图。回答下列问题:
,含Al,Si氧化物等杂质)为主要原料制备重铬酸钾的工艺流程如图。回答下列问题: (铁、铬分别为
(铁、铬分别为 、
、 价)转化为
价)转化为 和
和 ,同时A1、Si氧化物转化为可溶性钠盐。
,同时A1、Si氧化物转化为可溶性钠盐。
(1)“焙烧”过程与 有关的化学反应中,氧化剂和还原剂物质的量之比为
有关的化学反应中,氧化剂和还原剂物质的量之比为___________ 。“浸取”过程所得滤渣的用途有___________ (合理即可)。
(2)矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶组分浓度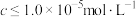 时,可认为已除尽。
时,可认为已除尽。___________ ;从平衡移动的角度解释“酸化”过程加入 的原因
的原因___________ 。
(3)“冷却结晶”时,相关化学反应方程式为___________ 。
(4) 价铬的化合物毒性较大,需将
价铬的化合物毒性较大,需将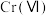 转化为毒性较低的
转化为毒性较低的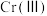 ;工业上可采用电解法处理酸性含铬废水:以铁板做阴、阳极,电解含铬(Ⅵ)废水,示意如图。
;工业上可采用电解法处理酸性含铬废水:以铁板做阴、阳极,电解含铬(Ⅵ)废水,示意如图。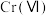 :向含铬(Ⅵ)废水中加入适量
:向含铬(Ⅵ)废水中加入适量 溶液发生反应,生成在乙醚中较稳定存在的
溶液发生反应,生成在乙醚中较稳定存在的 价的含铬氧化物
价的含铬氧化物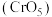 ,1mol
,1mol 中含过氧键
中含过氧键 的数量是
的数量是___________ 。
②电解开始时,A极上主要发生的电极反应式为___________ 。
③电解产生的 将
将 还原为
还原为 同时产生
同时产生 ,其离子方程式为
,其离子方程式为___________ 。
 ,含Al,Si氧化物等杂质)为主要原料制备重铬酸钾的工艺流程如图。回答下列问题:
,含Al,Si氧化物等杂质)为主要原料制备重铬酸钾的工艺流程如图。回答下列问题: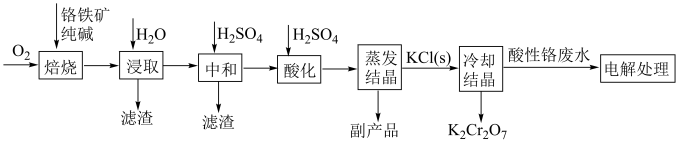
 (铁、铬分别为
(铁、铬分别为 、
、 价)转化为
价)转化为 和
和 ,同时A1、Si氧化物转化为可溶性钠盐。
,同时A1、Si氧化物转化为可溶性钠盐。(1)“焙烧”过程与
 有关的化学反应中,氧化剂和还原剂物质的量之比为
有关的化学反应中,氧化剂和还原剂物质的量之比为(2)矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶组分浓度
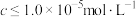 时,可认为已除尽。
时,可认为已除尽。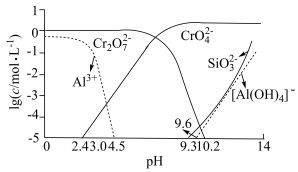
 的原因
的原因(3)“冷却结晶”时,相关化学反应方程式为
(4)
 价铬的化合物毒性较大,需将
价铬的化合物毒性较大,需将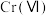 转化为毒性较低的
转化为毒性较低的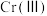 ;工业上可采用电解法处理酸性含铬废水:以铁板做阴、阳极,电解含铬(Ⅵ)废水,示意如图。
;工业上可采用电解法处理酸性含铬废水:以铁板做阴、阳极,电解含铬(Ⅵ)废水,示意如图。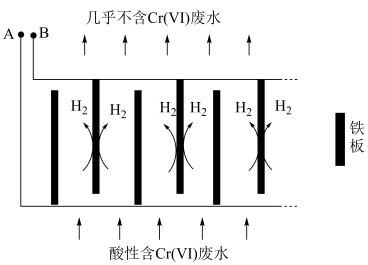
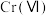 :向含铬(Ⅵ)废水中加入适量
:向含铬(Ⅵ)废水中加入适量 溶液发生反应,生成在乙醚中较稳定存在的
溶液发生反应,生成在乙醚中较稳定存在的 价的含铬氧化物
价的含铬氧化物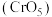 ,1mol
,1mol 中含过氧键
中含过氧键 的数量是
的数量是②电解开始时,A极上主要发生的电极反应式为
③电解产生的
 将
将 还原为
还原为 同时产生
同时产生 ,其离子方程式为
,其离子方程式为
您最近一年使用:0次
2024-04-11更新
|
279次组卷
|
2卷引用:2024届四川省雅安市、遂宁市、眉山市高三第二次诊断性考试理科综合试题-高中化学
名校
10 . 含铬化合物在生产生活中有着广泛的用途。利用含铬废液(主要含Cr3+、Cl-、K+、 等)可制备强氧化剂K2Cr2O7。
等)可制备强氧化剂K2Cr2O7。

已知:pH>6.5时Cr(Ⅵ)主要以 的形式存在,pH<6.5时Cr(Ⅵ)主要以
的形式存在,pH<6.5时Cr(Ⅵ)主要以 的形式存在。
的形式存在。
(1)含铬废液中存在Cr3+,该微粒的核外电子排布式为___________ 。
(2)写出调节pH的为12时Cr3+被氧化为Cr(Ⅵ)的离子方程式:___________ 。
(3)加稀硫酸至溶液pH约为1,若“酸化”前不将溶液煮沸,则K2Cr2O7产率明显偏低,原因是___________ 。
(4)利用K2Cr2O7制备Cr2O3。向密闭反应釜中加入1L1mol/L K2Cr2O7溶液,再加入蔗糖(C12H22O11)充分反应生成Cr(OH)3、K2CO3和CO2。焙烧Cr(OH)3得到Cr2O3。理论上需要向反应釜中加入蔗糖的物质的量为___________ 。
(5)利用K2Cr2O7滴定法测定钢渣(主要含有Fe、Fe2O3、FeO及少量惰性杂质)中Fe的含量的方法如下:取钢渣样品0.2500g,加入足量FeCl3溶液充分反应(Fe2O3、FeO及惰性杂质不反应)后过滤,洗涤滤渣。将洗涤液与滤液合并,用0.1000mol/L K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液20.00mL。计算钢渣中Fe的质量分数_______ (写出计算过程,结果保留1位小数)。
 等)可制备强氧化剂K2Cr2O7。
等)可制备强氧化剂K2Cr2O7。
已知:pH>6.5时Cr(Ⅵ)主要以
 的形式存在,pH<6.5时Cr(Ⅵ)主要以
的形式存在,pH<6.5时Cr(Ⅵ)主要以 的形式存在。
的形式存在。(1)含铬废液中存在Cr3+,该微粒的核外电子排布式为
(2)写出调节pH的为12时Cr3+被氧化为Cr(Ⅵ)的离子方程式:
(3)加稀硫酸至溶液pH约为1,若“酸化”前不将溶液煮沸,则K2Cr2O7产率明显偏低,原因是
(4)利用K2Cr2O7制备Cr2O3。向密闭反应釜中加入1L1mol/L K2Cr2O7溶液,再加入蔗糖(C12H22O11)充分反应生成Cr(OH)3、K2CO3和CO2。焙烧Cr(OH)3得到Cr2O3。理论上需要向反应釜中加入蔗糖的物质的量为
(5)利用K2Cr2O7滴定法测定钢渣(主要含有Fe、Fe2O3、FeO及少量惰性杂质)中Fe的含量的方法如下:取钢渣样品0.2500g,加入足量FeCl3溶液充分反应(Fe2O3、FeO及惰性杂质不反应)后过滤,洗涤滤渣。将洗涤液与滤液合并,用0.1000mol/L K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液20.00mL。计算钢渣中Fe的质量分数
您最近一年使用:0次

 (g)
(g)