1 . 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
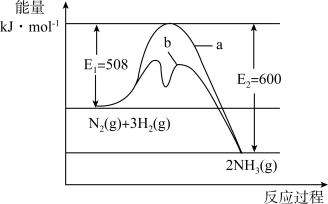
(1)根据图提供的信息,写出该反应的热化学方程式___________ ,在图中曲线___________ (填“a”或“b”)表示加入铁触媒的能量变化曲线,判断理由是___________ 。
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是___________
(3)一定温度下,向2 L密闭容器中充入1 mol N2和3 mol H2,保持体积不变,0.5 min后达到平衡,测得容器中有0.4 mol NH3,则平均反应速率v(N2)=___________ ,该温度下的平衡常数K=___________ 。(小数点后保留3位有效数字)
(4)保持温度和体积不变,向上述平衡体系中再加入1 mol N2、1 mol H2 、1 mol NH3 后该反应的速率大小关系为v正___________ v逆(填“大于”、“小于”或“等于”)。

(1)根据图提供的信息,写出该反应的热化学方程式
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是___________
| A.3v(H2)正=2v(NH3)逆 |
| B.单位时间内生成n mol N2的同时生成2n mol NH3 |
| C.混合气体的密度不再改变 |
| D.容器内压强不随时间的变化而变化 |
(3)一定温度下,向2 L密闭容器中充入1 mol N2和3 mol H2,保持体积不变,0.5 min后达到平衡,测得容器中有0.4 mol NH3,则平均反应速率v(N2)=
(4)保持温度和体积不变,向上述平衡体系中再加入1 mol N2、1 mol H2 、1 mol NH3 后该反应的速率大小关系为v正
您最近一年使用:0次
2023-11-04更新
|
80次组卷
|
2卷引用:甘肃省兰州市教育局第四片区联考2023-2024学年高二上学期期中考试化学试题
名校
解题方法
2 . 某课外活动小组为了探究外界条件对化学平衡的影响,做了如下实验:
(1)已知颜色深浅(I)与有色物质浓度(c)和观察深度(L)的乘积成正比: (式中k为常数)。在a、b两支容积均为30mL的针筒中分别抽入
(式中k为常数)。在a、b两支容积均为30mL的针筒中分别抽入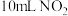 气体,将针筒前端封闭。
气体,将针筒前端封闭。

①将a针筒活塞迅速推至5mL处,从视线1处观察到的现象是___________ ;
②将b针筒活塞迅速拉至20mL处,从视线2处观察到的现象是___________ 。
(2)探究浓度对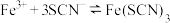 平衡的影响。将
平衡的影响。将 溶液(接近无色)和
溶液(接近无色)和 溶液等体积混合,将得到的红色溶液分为两等份。甲、乙两同学分别取一份向其中加入少量KCl(s)。
溶液等体积混合,将得到的红色溶液分为两等份。甲、乙两同学分别取一份向其中加入少量KCl(s)。
①甲同学根据中学所掌握知识预测红色应该___________ (填“变深”“变浅”或“不变”)。
②乙同学查阅资料得知该反应为配位反应,且学习到更多配离子,如冰晶石中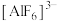 、银氨溶液中
、银氨溶液中 、
、 、
、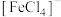 等。因此预测红色应该
等。因此预测红色应该___________ (填“变深”“变浅”或“不变”),理由:___________ 。
(1)已知颜色深浅(I)与有色物质浓度(c)和观察深度(L)的乘积成正比:
 (式中k为常数)。在a、b两支容积均为30mL的针筒中分别抽入
(式中k为常数)。在a、b两支容积均为30mL的针筒中分别抽入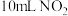 气体,将针筒前端封闭。
气体,将针筒前端封闭。
①将a针筒活塞迅速推至5mL处,从视线1处观察到的现象是
②将b针筒活塞迅速拉至20mL处,从视线2处观察到的现象是
(2)探究浓度对
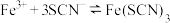 平衡的影响。将
平衡的影响。将 溶液(接近无色)和
溶液(接近无色)和 溶液等体积混合,将得到的红色溶液分为两等份。甲、乙两同学分别取一份向其中加入少量KCl(s)。
溶液等体积混合,将得到的红色溶液分为两等份。甲、乙两同学分别取一份向其中加入少量KCl(s)。①甲同学根据中学所掌握知识预测红色应该
②乙同学查阅资料得知该反应为配位反应,且学习到更多配离子,如冰晶石中
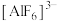 、银氨溶液中
、银氨溶液中 、
、 、
、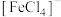 等。因此预测红色应该
等。因此预测红色应该
您最近一年使用:0次
2023-10-12更新
|
120次组卷
|
3卷引用:陕西省西安市鄠邑区2023-2024学年高二上学期期中质量检测化学试题
名校
解题方法
3 . 元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子,原子核外有_______ 种不同能量的电子,写出其最外层电子的轨道表示式_______ ;碘元素在元素周期表中的位置是_______ ;液溴的保存通常采取的方法是_______ 。
(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是_______(填序号)。
(3) 与
与 反应生成
反应生成 和一种黑色固体。在25℃、101kPa下,已知该反应消耗
和一种黑色固体。在25℃、101kPa下,已知该反应消耗 ,放热44.5kJ,该反应的热化学方程式是
,放热44.5kJ,该反应的热化学方程式是_______ 。
(4)已知: 的熔点为1040℃,
的熔点为1040℃, 在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:
在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:_______
(5)HClO有很好的杀菌消毒效果。为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:_______
(6)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是_______ (填字母)。
a.海盐提纯:

b.海水提镁:
c.海带提碘: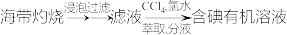

d.海水提溴:
(1)与氯元素同族的短周期元素的原子,原子核外有
(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是_______(填序号)。
A. 、 、 、 、 的氧化性 的氧化性 | B. 、 、 、 、 的熔点 的熔点 |
| C.HCl、HBr、HI的热稳定性 | D.HCl、HBr、HI的酸性 |
 与
与 反应生成
反应生成 和一种黑色固体。在25℃、101kPa下,已知该反应消耗
和一种黑色固体。在25℃、101kPa下,已知该反应消耗 ,放热44.5kJ,该反应的热化学方程式是
,放热44.5kJ,该反应的热化学方程式是(4)已知:
 的熔点为1040℃,
的熔点为1040℃, 在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:
在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:(5)HClO有很好的杀菌消毒效果。为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:
(6)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是
a.海盐提纯:


b.海水提镁:

c.海带提碘:
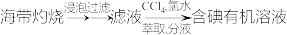

d.海水提溴:

您最近一年使用:0次
2022-11-11更新
|
170次组卷
|
2卷引用:上海市宝山区行知中学2022-2023学年高三上学期期中测试化学试题
名校
解题方法
4 . 雾霾严重危害人类健康和生态环境,开发稳定高效的脱硫脱硝工艺技术是国内外研究的热点。研究表明,氮氧化物(NOx)和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如下图所示。
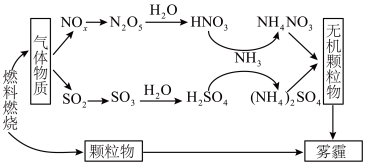
(1)NH4NO3溶液中的离子浓度由大到小顺序是_______ 。
(2)① 已知:SO2生成SO3总反应方程式是:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ/mol
2SO3(g) ΔH=-196.6 kJ/mol
此反应可通过如下两步完成:
2NO(g)+O2 (g ) 2NO2(g) ΔH1=-113 kJ/mol
2NO2(g) ΔH1=-113 kJ/mol
NO2(g)+SO2(g) SO3(g)+NO(g) ΔH2=
SO3(g)+NO(g) ΔH2=_______ 。
② 一定温度下,向2 L恒容密闭容器中充入NO2和SO2各1 mol,5min达到平衡,此时容器中NO2和NO的浓度之比为1∶3,则NO2的平衡转化率是_______ 。
(3)SO2属于酸性氧化物,将其通入NaOH溶液中,得到NaHSO3溶液。
①NaHSO3溶液呈酸性,其原因是_______
② 向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因是_______
(4)某同学用中和滴定法测定某烧碱样品的纯度,实验步骤如下:
Ⅰ、配制待测液:称量5.0 g烧碱样品(杂质不与硫酸反应),配成1000 mL溶液;
Ⅱ、滴定:取20.00mL所配待测液,用0.05mol·L-1的H2SO4标准溶液进行滴定,达到滴定终点后,重复此操作两次;记录数据如下表:
计算烧碱样品的纯度是_______ (计算结果保留三位有效数字)
下列实验操作,会使测定结果偏高的是_______ 。
A.酸式滴定管未润洗就装H2SO4标准溶液滴定
B.锥形瓶在蒸馏水洗净后未用待测液润洗
C.读取H2SO4标准溶液读数时,滴定前仰视,滴定到终点后俯视
D.滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失

(1)NH4NO3溶液中的离子浓度由大到小顺序是
(2)① 已知:SO2生成SO3总反应方程式是:2SO2(g)+O2(g)
 2SO3(g) ΔH=-196.6 kJ/mol
2SO3(g) ΔH=-196.6 kJ/mol此反应可通过如下两步完成:
2NO(g)+O2 (g )
 2NO2(g) ΔH1=-113 kJ/mol
2NO2(g) ΔH1=-113 kJ/molNO2(g)+SO2(g)
 SO3(g)+NO(g) ΔH2=
SO3(g)+NO(g) ΔH2=② 一定温度下,向2 L恒容密闭容器中充入NO2和SO2各1 mol,5min达到平衡,此时容器中NO2和NO的浓度之比为1∶3,则NO2的平衡转化率是
(3)SO2属于酸性氧化物,将其通入NaOH溶液中,得到NaHSO3溶液。
①NaHSO3溶液呈酸性,其原因是
② 向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因是
(4)某同学用中和滴定法测定某烧碱样品的纯度,实验步骤如下:
Ⅰ、配制待测液:称量5.0 g烧碱样品(杂质不与硫酸反应),配成1000 mL溶液;
Ⅱ、滴定:取20.00mL所配待测液,用0.05mol·L-1的H2SO4标准溶液进行滴定,达到滴定终点后,重复此操作两次;记录数据如下表:
| 测定序号 | 待测溶液体积(mL) | 所耗H2SO4标准溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
| 3 | 20.00 | 1.30 | 21.50 |
计算烧碱样品的纯度是
下列实验操作,会使测定结果偏高的是
A.酸式滴定管未润洗就装H2SO4标准溶液滴定
B.锥形瓶在蒸馏水洗净后未用待测液润洗
C.读取H2SO4标准溶液读数时,滴定前仰视,滴定到终点后俯视
D.滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失
您最近一年使用:0次
名校
解题方法
5 . 由γ-丁酸生成γ-丁内酯的反应如下:HOCH2CH2CH2COOH
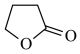 +H2O,在298K下,γ-羟基丁酸水溶液的初始浓度为0.180mol/L,测得γ-丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
+H2O,在298K下,γ-羟基丁酸水溶液的初始浓度为0.180mol/L,测得γ-丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
(1)该反应在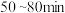 内的平均反应速率为
内的平均反应速率为_______ 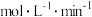 。
。
(2)该反应化学平衡常数K的表达式是_______ ,298K时该反应的平衡常数K=_______ 。
(3)求120min时γ-羟基丁酸的转化率为_______ (请写出计算过程,注意格式规范)
(4)为提高γ-羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是_______

 +H2O,在298K下,γ-羟基丁酸水溶液的初始浓度为0.180mol/L,测得γ-丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
+H2O,在298K下,γ-羟基丁酸水溶液的初始浓度为0.180mol/L,测得γ-丁内酯的浓度随时间变化的数据如表所示。回答下列问题: | 21 | 50 | 80 | 100 | 120 | 160 | 220 |  |
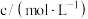 | 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
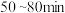 内的平均反应速率为
内的平均反应速率为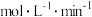 。
。(2)该反应化学平衡常数K的表达式是
(3)求120min时γ-羟基丁酸的转化率为
(4)为提高γ-羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是
您最近一年使用:0次
名校
6 .  温度时,在容积为1L的密闭容器中,X、Y、Z三种气体的浓度随时间变化如图Ⅰ。其它条件不变,当温度分别为
温度时,在容积为1L的密闭容器中,X、Y、Z三种气体的浓度随时间变化如图Ⅰ。其它条件不变,当温度分别为 和
和 时,Y的体积分数与时间关系如图Ⅱ。
时,Y的体积分数与时间关系如图Ⅱ。

(1)写出容器中发生反应的方程式___________ ;正反应为___________ 反应(填“放热”或“吸热”)。
(2)当 时,该反应
时,该反应___________ 达到平衡状态(填“已”或“未”);由图Ⅰ,若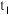 为10min,则
为10min,则 时间内,
时间内,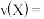
___________ ; 时平衡常数K=
时平衡常数K=___________ (保留小数点后一位)。
(3)其它条件不变,再充入一定量X,平衡___________ 移动(填“正向”、“逆向”、或“不”),X的转化率___________ (填“增大”、“减小”、或“不变”)。
 温度时,在容积为1L的密闭容器中,X、Y、Z三种气体的浓度随时间变化如图Ⅰ。其它条件不变,当温度分别为
温度时,在容积为1L的密闭容器中,X、Y、Z三种气体的浓度随时间变化如图Ⅰ。其它条件不变,当温度分别为 和
和 时,Y的体积分数与时间关系如图Ⅱ。
时,Y的体积分数与时间关系如图Ⅱ。
(1)写出容器中发生反应的方程式
(2)当
 时,该反应
时,该反应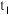 为10min,则
为10min,则 时间内,
时间内,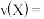
 时平衡常数K=
时平衡常数K=(3)其它条件不变,再充入一定量X,平衡
您最近一年使用:0次
2021-12-18更新
|
226次组卷
|
4卷引用:安徽省黄山市屯溪第一中学2021-2022学年高二上学期期中考试化学试题
名校
7 . I.在水溶液中橙色的 与黄色的
与黄色的 有下列平衡关系:
有下列平衡关系: +H2O⇌2
+H2O⇌2 +2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
(1)向上述溶液中加入NaOH溶液,溶液呈_______ 色。因为_______ 。
(2)向上述溶液中加入较浓硫酸,则溶液呈_______ 色,因为_______ 。
II.KI溶液在酸性条件下能被氧气氧化为I2.现有以下实验记录,回答:
(1)该实验的目的是_______ 。
(2)实验试剂除了1mol/LKI溶液、0.1mol/LH2SO4溶液外,还需要的试剂是_______ 。
(3)由上述实验记录可得出的结论是_______ 。
 与黄色的
与黄色的 有下列平衡关系:
有下列平衡关系: +H2O⇌2
+H2O⇌2 +2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。(1)向上述溶液中加入NaOH溶液,溶液呈
(2)向上述溶液中加入较浓硫酸,则溶液呈
II.KI溶液在酸性条件下能被氧气氧化为I2.现有以下实验记录,回答:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度/℃ | 30 | 40 | 50 | 60 | 70 |
| 显色时间/s | 160 | 80 | 40 | 20 | 10 |
(2)实验试剂除了1mol/LKI溶液、0.1mol/LH2SO4溶液外,还需要的试剂是
(3)由上述实验记录可得出的结论是
您最近一年使用:0次
2021-07-28更新
|
184次组卷
|
2卷引用:内蒙古杭锦后旗奋斗中学2020-2021学年高二上学期期中考试化学试题
解答题-原理综合题
|
较易(0.85)
|
8 . 已知在容积为2.0L的恒容密闭容器中存在可逆反应:M(g)+N(g) P(g)+W(g)。该可逆反应的平衡常数与温度的关系如表:
P(g)+W(g)。该可逆反应的平衡常数与温度的关系如表:
回答下列问题:
(1)温度为300℃时,在容器中加入0.5molM和0.5molN,4min时反应达到平衡。
①平衡时气体的总物质的量为___ mol。
②N的转化率为___ %。
③若保持温度不变,再向容器中充入0.25molM和0.25molN,平衡将___ (填“正向”逆向”或“不”)移动。
(2)某温度下,将一定量的M和N充入该容器中,测得不同条件下反应过程中部分物质的物质的量变化情况如图所示。

①生成物W在4~6min内的平均反应速率 (W)=
(W)=___ mol·L-1·min-1。
②第8min时改变的反应条件可能是___ (填标号)。
A.增大压强 B.减小压强 C.升高温度 D.降低温度
③若反应在第8min时,改变了反应的温度,则反应在第12min时,反应体系的温度为___ (填范围或数值)。
 P(g)+W(g)。该可逆反应的平衡常数与温度的关系如表:
P(g)+W(g)。该可逆反应的平衡常数与温度的关系如表:| 温度/℃ | 300 | 500 | 700 | 900 |
| 平衡常数 |  | 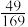 |  |  |
回答下列问题:
(1)温度为300℃时,在容器中加入0.5molM和0.5molN,4min时反应达到平衡。
①平衡时气体的总物质的量为
②N的转化率为
③若保持温度不变,再向容器中充入0.25molM和0.25molN,平衡将
(2)某温度下,将一定量的M和N充入该容器中,测得不同条件下反应过程中部分物质的物质的量变化情况如图所示。

①生成物W在4~6min内的平均反应速率
 (W)=
(W)=②第8min时改变的反应条件可能是
A.增大压强 B.减小压强 C.升高温度 D.降低温度
③若反应在第8min时,改变了反应的温度,则反应在第12min时,反应体系的温度为
您最近一年使用:0次



