名校
解题方法
1 . 完成下列问题。
(1)在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和H2,发生反应CO(g)+2H2(g)⇌CH3OH(g) △H<0,反应达到平衡时CH3OH(g)的体积分数(φ)与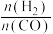 的关系如下图所示。
的关系如下图所示。
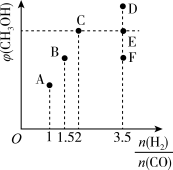
①当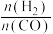 =2时,经过5min达到平衡,CO的转化率为0.6,则该反应的化学平衡常数K=
=2时,经过5min达到平衡,CO的转化率为0.6,则该反应的化学平衡常数K=_______ (保留一位小数)。
②当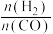 =3.5时,达到平衡后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡后,CH3OH的体积分数可能是图象中的_____ (填“D”“E”或“F”)点。
(2)另一科研小组控制起始时容器中只有amol/LCO和bmol/LH2,测得平衡时混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图2所示。

③若恒温(T1)恒容条件下,起始时 ,测得平衡时混合气体的压强为
,测得平衡时混合气体的压强为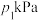 ,则
,则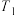 时该反应的压强平衡常数
时该反应的压强平衡常数 =
=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用含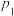 的代数式表示)。
的代数式表示)。
④若在温度为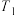 、压强为
、压强为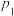 的条件下向密闭容器中加入CO、H2、CH3OH气体的物质的量之比为2∶1∶2,则反应开始时
的条件下向密闭容器中加入CO、H2、CH3OH气体的物质的量之比为2∶1∶2,则反应开始时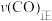
_______  (填“>”、“<”、“=”或“无法确定”)。
(填“>”、“<”、“=”或“无法确定”)。
(1)在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和H2,发生反应CO(g)+2H2(g)⇌CH3OH(g) △H<0,反应达到平衡时CH3OH(g)的体积分数(φ)与
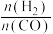 的关系如下图所示。
的关系如下图所示。
①当
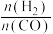 =2时,经过5min达到平衡,CO的转化率为0.6,则该反应的化学平衡常数K=
=2时,经过5min达到平衡,CO的转化率为0.6,则该反应的化学平衡常数K=②当
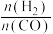 =3.5时,达到平衡后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡后,CH3OH的体积分数可能是图象中的(2)另一科研小组控制起始时容器中只有amol/LCO和bmol/LH2,测得平衡时混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图2所示。

③若恒温(T1)恒容条件下,起始时
 ,测得平衡时混合气体的压强为
,测得平衡时混合气体的压强为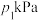 ,则
,则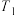 时该反应的压强平衡常数
时该反应的压强平衡常数 =
=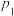 的代数式表示)。
的代数式表示)。④若在温度为
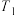 、压强为
、压强为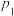 的条件下向密闭容器中加入CO、H2、CH3OH气体的物质的量之比为2∶1∶2,则反应开始时
的条件下向密闭容器中加入CO、H2、CH3OH气体的物质的量之比为2∶1∶2,则反应开始时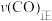
 (填“>”、“<”、“=”或“无法确定”)。
(填“>”、“<”、“=”或“无法确定”)。
您最近半年使用:0次
解题方法
2 . 反应 I2(g)+H2(g) 2HI(g)在密闭容器中达到平衡时,测得:c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.77mmol•L-1。(1mmol•L-1=10-3mol•L-1)
2HI(g)在密闭容器中达到平衡时,测得:c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.77mmol•L-1。(1mmol•L-1=10-3mol•L-1)
(1)该温度下,该反应的化学平衡常数 K=___________ 。
(2)相同温度下,按以下初始浓度进行实验:
① 反应向__________ 方向(填“正反应”或者“逆反应”)进行,结合计算说明理由:___________ 。
②该反应达到平衡时,容器中c(HI)=___________ mmol•L-1,I2 的转化率是___________ 。
 2HI(g)在密闭容器中达到平衡时,测得:c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.77mmol•L-1。(1mmol•L-1=10-3mol•L-1)
2HI(g)在密闭容器中达到平衡时,测得:c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.77mmol•L-1。(1mmol•L-1=10-3mol•L-1)(1)该温度下,该反应的化学平衡常数 K=
(2)相同温度下,按以下初始浓度进行实验:
| 物质 | 初始浓度 |
| c(I2)/mmol•L-1 | 1.00 |
| c(H2)/mmol•L-1 | 1.00 |
| c(HI)/mmol•L-1 | 1.00 |
②该反应达到平衡时,容器中c(HI)=
您最近半年使用:0次
20-21高二上·全国·假期作业
3 . (1)合成氨工艺的一个重要工序是铜洗,其目的是用铜液(醋酸二氨合铜,氨水)吸收在生产过程中产生的CO和CO2等气体,铜液吸收CO的反应是放热反应,其反应的化学方程式如下:Cu(NH3)2Ac+CO+NH3⇌[Cu(NH3)3CO]Ac,如果要提高上述反应的反应速率,可以采取的措施是___________ (填字母)。
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5+OH-⇌O2NC6H4COO-+C2H5OH,两种反应物的初始浓度均为0.050mol·L-1,15℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
列式计算该反应在120~180s与180~240s区间的平均反应速率___________ 、___________ ;比较两者大小可得出的结论是___________ 。
(3)反应AX3(g)+X2(g)⇌AX5(g)在容积为10L的密闭容器中进行,起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
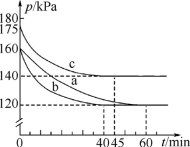
①列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)=___________ 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为___________ (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b___________ ,c___________ 。
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5+OH-⇌O2NC6H4COO-+C2H5OH,两种反应物的初始浓度均为0.050mol·L-1,15℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
| t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
| α/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
列式计算该反应在120~180s与180~240s区间的平均反应速率
(3)反应AX3(g)+X2(g)⇌AX5(g)在容积为10L的密闭容器中进行,起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。

①列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)=
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为
您最近半年使用:0次
名校
解题方法
4 . 氮氧化物是空气的主要污染物之一,研究氮氧化物的性质对于防治空气污染有重要意义。
温度为T1时,在三个容积均为1L的密闭容器中发生反应:2NO(g)+O2(g) 2NO2(g)ΔH<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。回答下列问题:
2NO2(g)ΔH<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。回答下列问题:
(1)温度为T1时, =
=__ ;当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m__ n(填“>”、“<“或“=”)。
(2)若容器Ⅱ中达到平衡时 =1,则NO的转化率为
=1,则NO的转化率为__ 。
(3)容器Ⅲ中起始时v正__ v逆(填“>”、“<”或“=”),理由是__ 。
(4)T1时,在1L密闭容器中按照一定比例充入NO(g)和O2(g),达到平衡时NO2(g)的体积分数Φ(NO2)随 的变化如图所示,则A、B、C三点中NO的转化率最大的是
的变化如图所示,则A、B、C三点中NO的转化率最大的是__ ;当 =2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的
=2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的__ 。

温度为T1时,在三个容积均为1L的密闭容器中发生反应:2NO(g)+O2(g)
 2NO2(g)ΔH<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。回答下列问题:
2NO2(g)ΔH<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。回答下列问题:| 容器编号 | 物质的起始浓度/mol·L−1 | 物质的平衡浓度/mol·L−1 | ||
| c(NO) | c(O2) | c(NO2) | c(O2) | |
| Ⅰ | 0.6 | 0.3 | 0 | 0.2 |
| Ⅱ | 0.5 | x | 0.3 | |
| Ⅲ | 0.3 | 0.25 | 0.2 | |
 =
=(2)若容器Ⅱ中达到平衡时
 =1,则NO的转化率为
=1,则NO的转化率为(3)容器Ⅲ中起始时v正
(4)T1时,在1L密闭容器中按照一定比例充入NO(g)和O2(g),达到平衡时NO2(g)的体积分数Φ(NO2)随
 的变化如图所示,则A、B、C三点中NO的转化率最大的是
的变化如图所示,则A、B、C三点中NO的转化率最大的是 =2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的
=2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的
您最近半年使用:0次
2020-11-09更新
|
313次组卷
|
2卷引用:黑龙江省实验中学2020-2021学年高二上学期期中考试化学试题
5 . 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0。CO和H2O的浓度变化如图所示。
CO2(g)+H2(g) ΔH<0。CO和H2O的浓度变化如图所示。
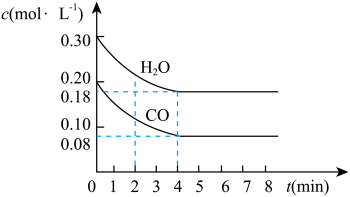
请解答下列各题:
(1)0~4min内的平均反应速率v(CO)=___ mol/(L·min),v(H2)=___ mol/(L·min),v(CO2)=___ mol/(L·min)。
(2)请你在图中标出CO2和H2的浓度变化。___
(3)T℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表。
①表中3min~4min之间,反应处于___ 状态;c1___ 0.08mol/L(填“大于”、“小于”或“等于”)。
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是___ (单选),表中5min~6min之间数值发生变化,可能的原因是___ (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
 CO2(g)+H2(g) ΔH<0。CO和H2O的浓度变化如图所示。
CO2(g)+H2(g) ΔH<0。CO和H2O的浓度变化如图所示。
请解答下列各题:
(1)0~4min内的平均反应速率v(CO)=
(2)请你在图中标出CO2和H2的浓度变化。
(3)T℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表。
| 时间(min) | 0 | 2 | 3 | 4 | 5 | 6 |
| CO | 0.200 | 0.138 | c1 | c1 | 0.116 | 0.096 |
| H2O | 0.300 | 0.238 | c2 | c2 | 0.216 | 0.266 |
| CO2 | 0 | 0.062 | c3 | c3 | 0.084 | 0.104 |
| H2 | 0 | 0.062 | c4 | c4 |
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
您最近半年使用:0次
2019-11-19更新
|
435次组卷
|
2卷引用:辽宁省凌源市联合校2019-2020学年高二上学期期中考试化学试题
6 . 已知工业制氢气的反应为CO(g)+H2O(g)  CO2(g)+H2(g),反应过程中能量变化如下图所示。在500 ℃时的平衡常数K=9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
CO2(g)+H2(g),反应过程中能量变化如下图所示。在500 ℃时的平衡常数K=9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
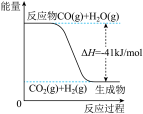
(1)增加H2O(g)的浓度,CO的转化率将________ (填“增大”、“减小”或“不变”)。
(2)平衡常数的表达式K=________ 。400 ℃时平衡常数K______ 9(填“>”、“<” 或“=”)。
(3)已知2H2(g)+O2(g) 2H2O (g) ΔH=-484 kJ/mol。结合上图写出CO完全燃烧生成CO2的热化学方程式:
2H2O (g) ΔH=-484 kJ/mol。结合上图写出CO完全燃烧生成CO2的热化学方程式:____ 。
 CO2(g)+H2(g),反应过程中能量变化如下图所示。在500 ℃时的平衡常数K=9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
CO2(g)+H2(g),反应过程中能量变化如下图所示。在500 ℃时的平衡常数K=9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
(1)增加H2O(g)的浓度,CO的转化率将
(2)平衡常数的表达式K=
(3)已知2H2(g)+O2(g)
 2H2O (g) ΔH=-484 kJ/mol。结合上图写出CO完全燃烧生成CO2的热化学方程式:
2H2O (g) ΔH=-484 kJ/mol。结合上图写出CO完全燃烧生成CO2的热化学方程式:
您最近半年使用:0次
名校
7 . 已知2A2(g)+B2(g) 2C(g)ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。
2C(g)ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。
(1)a________ b(填“>”“=”或“<”)。
(2)该反应的平衡常数表达式为________ ,若将反应温度升高到700 ℃,该反应的平衡常数将________ (填“增大”“减小”或“不变”)。
(3)能说明该反应已经达到平衡状态的是________ 。
a.v(C)=2v(B2) b.容器内压强保持不变 c.v逆(A2)=2v正(B2) d.容器内的密度保持不变
(4)使该反应的反应速率增大,且平衡向正反应方向移动的操作是________ 。
a.及时分离出C气体 b.适当升高温度 c.增大B2的浓度 d.选择高效的催化剂
(5)密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g) H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为________ 。
 2C(g)ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。
2C(g)ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。(1)a
(2)该反应的平衡常数表达式为
(3)能说明该反应已经达到平衡状态的是
a.v(C)=2v(B2) b.容器内压强保持不变 c.v逆(A2)=2v正(B2) d.容器内的密度保持不变
(4)使该反应的反应速率增大,且平衡向正反应方向移动的操作是
a.及时分离出C气体 b.适当升高温度 c.增大B2的浓度 d.选择高效的催化剂
(5)密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)
 H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为
您最近半年使用:0次
2019-01-07更新
|
454次组卷
|
2卷引用:陕西省白水中学2018-2019学年高二上学期第二次月考化学试题
8 . 碘及其化合物在生产、生活和科技等方面都有着重要的应用。回答下列问题:
(1)碘不易溶于水,但易溶于碘化钾溶液并生成多碘离子,反应如下:
①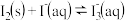
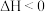
②
反应②的平衡常数的表达式为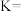
__________ 。温度升高时,反应①的平衡常数将__________ (填“增大”“减小”或“不变”)。
(2)碘与钨在一定温度下可发生如下可逆反应: 。现准确称取0.508g碘和0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应。如图是混合气体中的
。现准确称取0.508g碘和0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应。如图是混合气体中的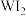 蒸气的物质的量随时间变化关系的图象
蒸气的物质的量随时间变化关系的图象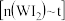 ,其中曲线I(0~
,其中曲线I(0~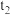 时间段)的反应温度为450
时间段)的反应温度为450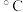 ,曲线II(从
,曲线II(从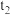 时刻开始)的反应温度为530
时刻开始)的反应温度为530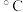 。
。
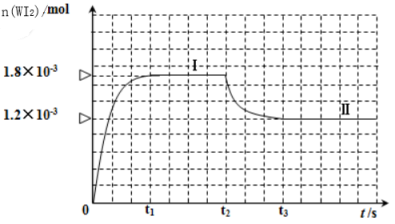
①该反应的
__________ (填“>”或“<”)0。
②反应从开始到 时间内的平均速率
时间内的平均速率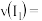
__________ 。
③在450 时,该反应的平衡数
时,该反应的平衡数
__________ 。
④能够说明上述反应已经达到平衡状态的有__________ (填选项字母)。
A.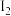 与
与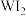 的浓度相等
的浓度相等
B.单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等
C.容器内混合气体的密度不再改变
D.容器内气体压强不发生变化
(1)碘不易溶于水,但易溶于碘化钾溶液并生成多碘离子,反应如下:
①
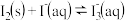
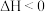
②

反应②的平衡常数的表达式为
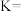
(2)碘与钨在一定温度下可发生如下可逆反应:
 。现准确称取0.508g碘和0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应。如图是混合气体中的
。现准确称取0.508g碘和0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应。如图是混合气体中的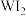 蒸气的物质的量随时间变化关系的图象
蒸气的物质的量随时间变化关系的图象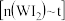 ,其中曲线I(0~
,其中曲线I(0~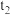 时间段)的反应温度为450
时间段)的反应温度为450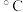 ,曲线II(从
,曲线II(从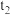 时刻开始)的反应温度为530
时刻开始)的反应温度为530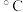 。
。 
①该反应的

②反应从开始到
 时间内的平均速率
时间内的平均速率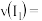
③在450
 时,该反应的平衡数
时,该反应的平衡数
④能够说明上述反应已经达到平衡状态的有
A.
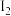 与
与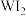 的浓度相等
的浓度相等B.单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等
C.容器内混合气体的密度不再改变
D.容器内气体压强不发生变化
您最近半年使用:0次
名校
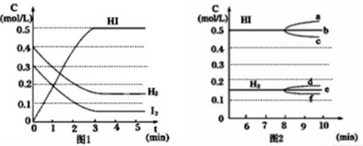
9 . 在某一容积为2 L的密闭容器内,加入0.8 mol的H2和0.6 mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)  2HI(g)+9.4 kJ
2HI(g)+9.4 kJ
反应中各物质的浓度随时间变化情况如图1:
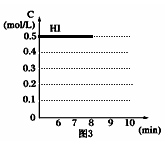
(1)在反应趋向平衡状态的过程中,下列说法正确的是_________ 。
A.HI的生产速率等于分解速率 B.HI的生产速率小于分解速率
C.HI的生产速率大于分解速率 D.无法判断HI的生产速率和分解速率的相对大小
(2)下列说法能说明该反应一定达到平衡的是__________ 。
A.混合气体的密度不再发生变化 B.混合气体的颜色不再发生变化
C.反应放出的热量恰好为9.4 kJ D.混合气体的压强不再发生变化
(3)根据图1数据,反应开始至达到平衡(第3 min)时,平衡速率v(HI)为____________ (用小数表示)。
(4)反应达到平衡后,第8分钟时:
①若升高温度,HI浓度的变化正确的是_________ ;
②若加入I2,H2浓度的变化正确的是____________ 。(用图2中相应编号回答)
(5)反应达到平衡后,第8分钟时,若把容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况。________
 2HI(g)+9.4 kJ
2HI(g)+9.4 kJ反应中各物质的浓度随时间变化情况如图1:


(1)在反应趋向平衡状态的过程中,下列说法正确的是
A.HI的生产速率等于分解速率 B.HI的生产速率小于分解速率
C.HI的生产速率大于分解速率 D.无法判断HI的生产速率和分解速率的相对大小
(2)下列说法能说明该反应一定达到平衡的是
A.混合气体的密度不再发生变化 B.混合气体的颜色不再发生变化
C.反应放出的热量恰好为9.4 kJ D.混合气体的压强不再发生变化
(3)根据图1数据,反应开始至达到平衡(第3 min)时,平衡速率v(HI)为
(4)反应达到平衡后,第8分钟时:
①若升高温度,HI浓度的变化正确的是
②若加入I2,H2浓度的变化正确的是
(5)反应达到平衡后,第8分钟时,若把容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况。
您最近半年使用:0次
9-10高三·湖北·阶段练习
10 . 在一个容积固定为2L的密闭容器中,发生反应 △H=?。反应情况记录如下表:
△H=?。反应情况记录如下表:
请仔细分析根据表中数据,回答下列问题:
(1)a2=_____ ,b=______ ,p=_____ 。(取最小正整数)
(2)第2min到第4min内A的平均反应速率v(A)=________ mol·L-1·min-1[来源:学.科.网]
(3)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、第6min、第8min时分别改变了某一反应条件,则改变的条件分别可能是:
①第2min___________ 或_________
②第6min___________ ;
③第8min_________________ ;
(4)若从开始到第4min建立平衡时反应放出的热量为235。92kJ,则该反应的△H=______ 。
 △H=?。反应情况记录如下表:
△H=?。反应情况记录如下表:时间 | c(A)/mol L-1 | c(B)/mol L-1 | c(C)/mol L-1 |
0min | 1 | 3 | 0 |
第2min | 0.8 | 2.6 | 0.4 |
第4min | 0.4 | 1.8 | 1.2 |
第6min | 0.4 | 1.8 | 1.2 |
第8min | 0.1 | 2.0 | 1.8 |
第9min | 0.05 | 1.9 | 0.3 |
请仔细分析根据表中数据,回答下列问题:
(1)a2=
(2)第2min到第4min内A的平均反应速率v(A)=
(3)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、第6min、第8min时分别改变了某一反应条件,则改变的条件分别可能是:
①第2min
②第6min
③第8min
(4)若从开始到第4min建立平衡时反应放出的热量为235。92kJ,则该反应的△H=
您最近半年使用:0次



