在一个容积固定为2L的密闭容器中,发生反应 △H=?。反应情况记录如下表:
△H=?。反应情况记录如下表:
请仔细分析根据表中数据,回答下列问题:
(1)a2=_____ ,b=______ ,p=_____ 。(取最小正整数)
(2)第2min到第4min内A的平均反应速率v(A)=________ mol·L-1·min-1[来源:学.科.网]
(3)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、第6min、第8min时分别改变了某一反应条件,则改变的条件分别可能是:
①第2min___________ 或_________
②第6min___________ ;
③第8min_________________ ;
(4)若从开始到第4min建立平衡时反应放出的热量为235。92kJ,则该反应的△H=______ 。
 △H=?。反应情况记录如下表:
△H=?。反应情况记录如下表:时间 | c(A)/mol L-1 | c(B)/mol L-1 | c(C)/mol L-1 |
0min | 1 | 3 | 0 |
第2min | 0.8 | 2.6 | 0.4 |
第4min | 0.4 | 1.8 | 1.2 |
第6min | 0.4 | 1.8 | 1.2 |
第8min | 0.1 | 2.0 | 1.8 |
第9min | 0.05 | 1.9 | 0.3 |
请仔细分析根据表中数据,回答下列问题:
(1)a2=
(2)第2min到第4min内A的平均反应速率v(A)=
(3)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、第6min、第8min时分别改变了某一反应条件,则改变的条件分别可能是:
①第2min
②第6min
③第8min
(4)若从开始到第4min建立平衡时反应放出的热量为235。92kJ,则该反应的△H=
9-10高三·湖北·阶段练习 查看更多[1]
(已下线)2011届湖北省部分重点中学高三第二次联考理综)化学部分
更新时间:2011-01-11 16:43:03
|
相似题推荐
计算题
|
适中
(0.65)
【推荐1】在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4 2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
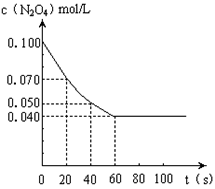
(1)计算在20至40秒时间内,NO2的平均生成速率为____________ mol•L-1•S-1
(2)①该反应的化学平衡常数表达式为__________ ,
(3)求达到平衡状态时N2O4的转化率____________
(4)求平衡时容器内气体压强与反应前的压强之比为__________ (最简整数比)
 2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
(1)计算在20至40秒时间内,NO2的平均生成速率为
(2)①该反应的化学平衡常数表达式为
②求该温度下平衡常数的值
(3)求达到平衡状态时N2O4的转化率
(4)求平衡时容器内气体压强与反应前的压强之比为
您最近半年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐2】在容积为2L的密闭容器中,进行如下反应: A(g)+2B(g) C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
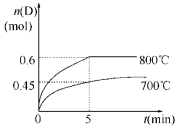
请回答下列问题:
(1)700℃时,0~5min内,以B表示的平均反应速率为_______ ;
(2)不能判断反应达到化学平衡状态的依据是__________ ;
A 容器中压强不变 B 混合气体中c(A)不变
C v正(B)=2v逆(D) D c(A)=c(C)
(3)若最初加入1.0 mol A和2.2 mol B,利用图中数据计算800℃时的平衡常数K=__________ ,该反应为__________ 反应(填“吸热”或“放热”);
(4)800℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06 mol/L,c(B)=0.50 mol/L,c(C)=0.20 mol/L,c(D)=0.018 mol/L,则此时该反应__________ (填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
 C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
请回答下列问题:
(1)700℃时,0~5min内,以B表示的平均反应速率为
(2)不能判断反应达到化学平衡状态的依据是
A 容器中压强不变 B 混合气体中c(A)不变
C v正(B)=2v逆(D) D c(A)=c(C)
(3)若最初加入1.0 mol A和2.2 mol B,利用图中数据计算800℃时的平衡常数K=
(4)800℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06 mol/L,c(B)=0.50 mol/L,c(C)=0.20 mol/L,c(D)=0.018 mol/L,则此时该反应
您最近半年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题
(1)在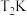 、
、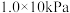 下,等物质的量的CO与
下,等物质的量的CO与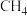 混合气体发生如下反应:
混合气体发生如下反应: 。反应速率
。反应速率 ,
,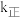 、
、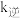 分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压
分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压 体积分数)。用气体分压表示的平衡常数
体积分数)。用气体分压表示的平衡常数 ,则CO转化率为20%时,
,则CO转化率为20%时,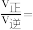
_______ 。
(2)探索氮氧化合物反应的特征及机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
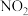 可发生二聚反应生成
可发生二聚反应生成 ,化学方程式为
,化学方程式为 ,上述反应达到平衡后,升高温度可使体系颜色加深。已知该反应的正反应速率方程为
,上述反应达到平衡后,升高温度可使体系颜色加深。已知该反应的正反应速率方程为 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中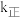 、
、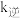 分别为正、逆反应的速率常数。则图lgk表示速率常数的对数;图中A、B、C、D点的纵坐标分别为
分别为正、逆反应的速率常数。则图lgk表示速率常数的对数;图中A、B、C、D点的纵坐标分别为 、
、 ,
, ,
,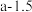 ,则温度T1时化学平衡常数K=
,则温度T1时化学平衡常数K=_______  。上述反应达到平衡后,继续通入一定量的
。上述反应达到平衡后,继续通入一定量的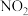 ,则
,则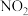 的平衡转化率将
的平衡转化率将_______ ,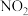 的体积分数将
的体积分数将_______ (填“增大”“减小”或“不变”)。

(3)反应 的反应机理如下:
的反应机理如下:
①第一步: (快速平衡)
(快速平衡)
第二步: (快速平衡)
(快速平衡)
第三步: (慢反应)
(慢反应)
②只需一步完成的反应称为基元反应,基元反应如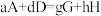 的速率方程,
的速率方程,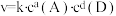 ,k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。
,k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。 与
与 反应生成
反应生成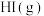 的速率方程为v=
的速率方程为v=_______  (用含
(用含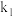 、
、 、
、 …的代数式表示)。
…的代数式表示)。
(4)硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是 的,催化氧化:
的,催化氧化:
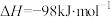 。将组成(物质的量分数)为2m%
。将组成(物质的量分数)为2m%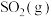 、m%
、m%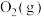 和q%
和q%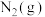 的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若
的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若 转化率为
转化率为 ,则
,则 压强为
压强为_______ ,平衡常数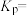
_______ (以分压表示,分压=总压×物质的量分数)
(1)在
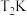 、
、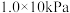 下,等物质的量的CO与
下,等物质的量的CO与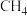 混合气体发生如下反应:
混合气体发生如下反应: 。反应速率
。反应速率 ,
,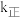 、
、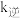 分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压
分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压 体积分数)。用气体分压表示的平衡常数
体积分数)。用气体分压表示的平衡常数 ,则CO转化率为20%时,
,则CO转化率为20%时,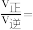
(2)探索氮氧化合物反应的特征及机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
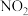 可发生二聚反应生成
可发生二聚反应生成 ,化学方程式为
,化学方程式为 ,上述反应达到平衡后,升高温度可使体系颜色加深。已知该反应的正反应速率方程为
,上述反应达到平衡后,升高温度可使体系颜色加深。已知该反应的正反应速率方程为 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中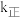 、
、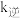 分别为正、逆反应的速率常数。则图lgk表示速率常数的对数;图中A、B、C、D点的纵坐标分别为
分别为正、逆反应的速率常数。则图lgk表示速率常数的对数;图中A、B、C、D点的纵坐标分别为 、
、 ,
, ,
,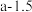 ,则温度T1时化学平衡常数K=
,则温度T1时化学平衡常数K= 。上述反应达到平衡后,继续通入一定量的
。上述反应达到平衡后,继续通入一定量的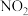 ,则
,则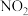 的平衡转化率将
的平衡转化率将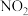 的体积分数将
的体积分数将
(3)反应
 的反应机理如下:
的反应机理如下:①第一步:
 (快速平衡)
(快速平衡)第二步:
 (快速平衡)
(快速平衡)第三步:
 (慢反应)
(慢反应)②只需一步完成的反应称为基元反应,基元反应如
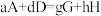 的速率方程,
的速率方程,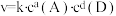 ,k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。
,k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。 与
与 反应生成
反应生成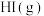 的速率方程为v=
的速率方程为v= (用含
(用含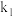 、
、 、
、 …的代数式表示)。
…的代数式表示)。(4)硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是
 的,催化氧化:
的,催化氧化:
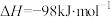 。将组成(物质的量分数)为2m%
。将组成(物质的量分数)为2m%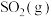 、m%
、m%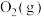 和q%
和q%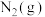 的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若
的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若 转化率为
转化率为 ,则
,则 压强为
压强为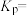
您最近半年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐1】合成氨工业为人类解决粮食问题做出了巨大贡献。一定温度下,在2L恒容密闭容器中发生反应 ,反应过程中的部分数据如下表所示:
,反应过程中的部分数据如下表所示:
求:
(1)0~5min内用NH3表示的平均反应速率为_______ 。
(2)N2的平衡转化率_______ ;初始时与平衡时混合气体压强之比________ (要求写出具体计算过程)。
 ,反应过程中的部分数据如下表所示:
,反应过程中的部分数据如下表所示:| t/min | 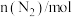 | 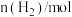 | 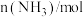 |
| 0 | 1.0 | 1.2 | 0 |
| 5 | 0.9 | 0.9 | x |
| 10 | 0.8 | y | z |
| 15 | w | 0.6 | m |
(1)0~5min内用NH3表示的平均反应速率为
(2)N2的平衡转化率
您最近半年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】把0.6mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:2X(g)+Y(g)=nM(g)+2W(g)2min 末,若测知以W 的浓度变化表示的反应速率为0.05mol•L﹣1•min﹣1,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为5:4,则:
(1)前2min内用Y的浓度变化表示的平均反应速率为___________ 。
(2)2min末时X的浓度为_________ 。
(3)化学反应方程式中n的值是____________ 。
(1)前2min内用Y的浓度变化表示的平均反应速率为
(2)2min末时X的浓度为
(3)化学反应方程式中n的值是
您最近半年使用:0次
计算题
|
适中
(0.65)
【推荐1】在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0。CO和H2O的浓度变化如图所示。
CO2(g)+H2(g) ΔH<0。CO和H2O的浓度变化如图所示。
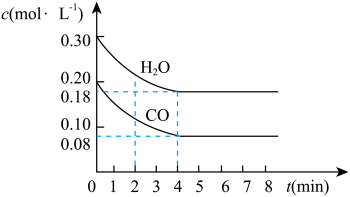
请解答下列各题:
(1)0~4min内的平均反应速率v(CO)=___ mol/(L·min),v(H2)=___ mol/(L·min),v(CO2)=___ mol/(L·min)。
(2)请你在图中标出CO2和H2的浓度变化。___
(3)T℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表。
①表中3min~4min之间,反应处于___ 状态;c1___ 0.08mol/L(填“大于”、“小于”或“等于”)。
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是___ (单选),表中5min~6min之间数值发生变化,可能的原因是___ (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
 CO2(g)+H2(g) ΔH<0。CO和H2O的浓度变化如图所示。
CO2(g)+H2(g) ΔH<0。CO和H2O的浓度变化如图所示。
请解答下列各题:
(1)0~4min内的平均反应速率v(CO)=
(2)请你在图中标出CO2和H2的浓度变化。
(3)T℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表。
| 时间(min) | 0 | 2 | 3 | 4 | 5 | 6 |
| CO | 0.200 | 0.138 | c1 | c1 | 0.116 | 0.096 |
| H2O | 0.300 | 0.238 | c2 | c2 | 0.216 | 0.266 |
| CO2 | 0 | 0.062 | c3 | c3 | 0.084 | 0.104 |
| H2 | 0 | 0.062 | c4 | c4 |
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
您最近半年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】反应 I2(g)+H2(g) 2HI(g)在密闭容器中达到平衡时,测得:c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.77mmol•L-1。(1mmol•L-1=10-3mol•L-1)
2HI(g)在密闭容器中达到平衡时,测得:c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.77mmol•L-1。(1mmol•L-1=10-3mol•L-1)
(1)该温度下,该反应的化学平衡常数 K=___________ 。
(2)相同温度下,按以下初始浓度进行实验:
① 反应向__________ 方向(填“正反应”或者“逆反应”)进行,结合计算说明理由:___________ 。
②该反应达到平衡时,容器中c(HI)=___________ mmol•L-1,I2 的转化率是___________ 。
 2HI(g)在密闭容器中达到平衡时,测得:c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.77mmol•L-1。(1mmol•L-1=10-3mol•L-1)
2HI(g)在密闭容器中达到平衡时,测得:c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.77mmol•L-1。(1mmol•L-1=10-3mol•L-1)(1)该温度下,该反应的化学平衡常数 K=
(2)相同温度下,按以下初始浓度进行实验:
| 物质 | 初始浓度 |
| c(I2)/mmol•L-1 | 1.00 |
| c(H2)/mmol•L-1 | 1.00 |
| c(HI)/mmol•L-1 | 1.00 |
②该反应达到平衡时,容器中c(HI)=
您最近半年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐3】完成下列问题。
(1)在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和H2,发生反应CO(g)+2H2(g)⇌CH3OH(g) △H<0,反应达到平衡时CH3OH(g)的体积分数(φ)与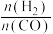 的关系如下图所示。
的关系如下图所示。
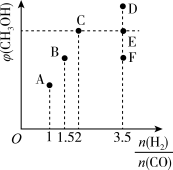
①当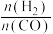 =2时,经过5min达到平衡,CO的转化率为0.6,则该反应的化学平衡常数K=
=2时,经过5min达到平衡,CO的转化率为0.6,则该反应的化学平衡常数K=_______ (保留一位小数)。
②当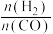 =3.5时,达到平衡后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡后,CH3OH的体积分数可能是图象中的_____ (填“D”“E”或“F”)点。
(2)另一科研小组控制起始时容器中只有amol/LCO和bmol/LH2,测得平衡时混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图2所示。

③若恒温(T1)恒容条件下,起始时 ,测得平衡时混合气体的压强为
,测得平衡时混合气体的压强为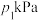 ,则
,则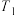 时该反应的压强平衡常数
时该反应的压强平衡常数 =
=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用含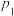 的代数式表示)。
的代数式表示)。
④若在温度为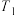 、压强为
、压强为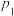 的条件下向密闭容器中加入CO、H2、CH3OH气体的物质的量之比为2∶1∶2,则反应开始时
的条件下向密闭容器中加入CO、H2、CH3OH气体的物质的量之比为2∶1∶2,则反应开始时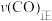
_______  (填“>”、“<”、“=”或“无法确定”)。
(填“>”、“<”、“=”或“无法确定”)。
(1)在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和H2,发生反应CO(g)+2H2(g)⇌CH3OH(g) △H<0,反应达到平衡时CH3OH(g)的体积分数(φ)与
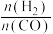 的关系如下图所示。
的关系如下图所示。
①当
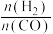 =2时,经过5min达到平衡,CO的转化率为0.6,则该反应的化学平衡常数K=
=2时,经过5min达到平衡,CO的转化率为0.6,则该反应的化学平衡常数K=②当
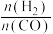 =3.5时,达到平衡后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡后,CH3OH的体积分数可能是图象中的(2)另一科研小组控制起始时容器中只有amol/LCO和bmol/LH2,测得平衡时混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图2所示。

③若恒温(T1)恒容条件下,起始时
 ,测得平衡时混合气体的压强为
,测得平衡时混合气体的压强为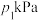 ,则
,则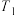 时该反应的压强平衡常数
时该反应的压强平衡常数 =
=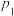 的代数式表示)。
的代数式表示)。④若在温度为
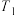 、压强为
、压强为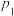 的条件下向密闭容器中加入CO、H2、CH3OH气体的物质的量之比为2∶1∶2,则反应开始时
的条件下向密闭容器中加入CO、H2、CH3OH气体的物质的量之比为2∶1∶2,则反应开始时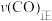
 (填“>”、“<”、“=”或“无法确定”)。
(填“>”、“<”、“=”或“无法确定”)。
您最近半年使用:0次
【推荐1】二氧化硫有以下反应SO2(g)+NO2(g) SO3(g)+NO(g) ΔH=-42 kJ/mol。在1 L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
SO3(g)+NO(g) ΔH=-42 kJ/mol。在1 L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
(1)实验甲中,若2 min时测得放出的热量是4.2 kJ,则0~2 min时间内,用SO2(g)表示的平均反应速率v(SO2)=_______ 。
(2)实验丙中,达到平衡时,NO2的转化率为________ 。
(3)由表中数据可推知,T1________ T2(填“>”“<”或“=”),判断的理由是________ 。
 SO3(g)+NO(g) ΔH=-42 kJ/mol。在1 L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
SO3(g)+NO(g) ΔH=-42 kJ/mol。在1 L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:| 实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(SO2) | n(NO2) | n(NO) | ||
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T2 | 0.20 | 0.30 | a |
(1)实验甲中,若2 min时测得放出的热量是4.2 kJ,则0~2 min时间内,用SO2(g)表示的平均反应速率v(SO2)=
(2)实验丙中,达到平衡时,NO2的转化率为
(3)由表中数据可推知,T1
您最近半年使用:0次
计算题
|
适中
(0.65)
【推荐2】在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(l)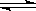 4NH3(g)+3O2(g) △H = akJ•mol-1
4NH3(g)+3O2(g) △H = akJ•mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下:
①该反应的a______ 0(填“>”、“<”或“=”)
②已知:N2(g)+3H2(g)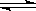 3NH3(g) △H = -92.4kJ•mol-1
3NH3(g) △H = -92.4kJ•mol-1
2H2(g) + O2(g)==2H2O(l) △H = -571.6 kJ•mol-1
则2N2(g) + 6H2O(l)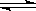 4NH3(g) + 3O2(g)△H =
4NH3(g) + 3O2(g)△H = _________ 。
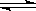 4NH3(g)+3O2(g) △H = akJ•mol-1
4NH3(g)+3O2(g) △H = akJ•mol-1进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
NH3生成量/(10-6mol) | 4.8 | 5.8 | 6.0 |
①该反应的a
②已知:N2(g)+3H2(g)
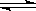 3NH3(g) △H = -92.4kJ•mol-1
3NH3(g) △H = -92.4kJ•mol-12H2(g) + O2(g)==2H2O(l) △H = -571.6 kJ•mol-1
则2N2(g) + 6H2O(l)
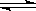 4NH3(g) + 3O2(g)△H =
4NH3(g) + 3O2(g)△H =
您最近半年使用:0次
【推荐3】汽车尾气是城市主要空气污染物,利用反应2NO(g) +2CO(g) ⇌N2+2CO2(g)可实现汽车尾气的无害化处理。向甲、乙两个体积都为2.0 L的恒容密闭容器中分别充入2mol CO和2 mol NO,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(CO2)随时间(t)变化情况见下表:
(1)T1___________ T2(填“>”、“<”或“=”下同),该反应ΔH___________ 0。
(2)乙容器中,2~4s内N2的平均反应速率υ(N2)=___________ 。
(3)甲容器中NO平衡转化率为___________ ,T1温度下该反应的平衡常数为___________ 。
(4)该反应达到平衡后,为提高反应速率同时提高NO的转化率,可采取的措施有___________ (填字母序号)。
a.增大NO浓度 b.压缩容器体积 c.移去部分N2 d.改用高效催化剂
| 时间/s | 0 | 2 | 4 | 6 | 8 | 10 |
| 甲容器(T1)n(CO2)/mol | 0 | 0.72 | 1.20 | 1.60 | 1.60 | 1.60 |
| 乙容器(T2)n(CO2)/mol | 0 | 0.60 | 1.00 | 1.40 | 1.70 | 1.70 |
(1)T1
(2)乙容器中,2~4s内N2的平均反应速率υ(N2)=
(3)甲容器中NO平衡转化率为
(4)该反应达到平衡后,为提高反应速率同时提高NO的转化率,可采取的措施有
a.增大NO浓度 b.压缩容器体积 c.移去部分N2 d.改用高效催化剂
您最近半年使用:0次



