回答下列问题
(1)在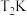 、
、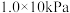 下,等物质的量的CO与
下,等物质的量的CO与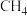 混合气体发生如下反应:
混合气体发生如下反应: 。反应速率
。反应速率 ,
, 、
、 分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压
分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压 体积分数)。用气体分压表示的平衡常数
体积分数)。用气体分压表示的平衡常数 ,则CO转化率为20%时,
,则CO转化率为20%时,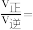
_______ 。
(2)探索氮氧化合物反应的特征及机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
 可发生二聚反应生成
可发生二聚反应生成 ,化学方程式为
,化学方程式为 ,上述反应达到平衡后,升高温度可使体系颜色加深。已知该反应的正反应速率方程为
,上述反应达到平衡后,升高温度可使体系颜色加深。已知该反应的正反应速率方程为 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中 、
、 分别为正、逆反应的速率常数。则图lgk表示速率常数的对数;图中A、B、C、D点的纵坐标分别为
分别为正、逆反应的速率常数。则图lgk表示速率常数的对数;图中A、B、C、D点的纵坐标分别为 、
、 ,
, ,
,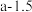 ,则温度T1时化学平衡常数K=
,则温度T1时化学平衡常数K=_______  。上述反应达到平衡后,继续通入一定量的
。上述反应达到平衡后,继续通入一定量的 ,则
,则 的平衡转化率将
的平衡转化率将_______ , 的体积分数将
的体积分数将_______ (填“增大”“减小”或“不变”)。

(3)反应 的反应机理如下:
的反应机理如下:
①第一步: (快速平衡)
(快速平衡)
第二步: (快速平衡)
(快速平衡)
第三步: (慢反应)
(慢反应)
②只需一步完成的反应称为基元反应,基元反应如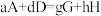 的速率方程,
的速率方程,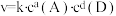 ,k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。
,k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。 与
与 反应生成
反应生成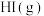 的速率方程为v=
的速率方程为v=_______  (用含
(用含 、
、 、
、 …的代数式表示)。
…的代数式表示)。
(4)硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是 的,催化氧化:
的,催化氧化:
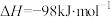 。将组成(物质的量分数)为2m%
。将组成(物质的量分数)为2m%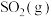 、m%
、m% 和q%
和q% 的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若
的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若 转化率为
转化率为 ,则
,则 压强为
压强为_______ ,平衡常数
_______ (以分压表示,分压=总压×物质的量分数)
(1)在
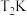 、
、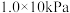 下,等物质的量的CO与
下,等物质的量的CO与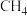 混合气体发生如下反应:
混合气体发生如下反应: 。反应速率
。反应速率 ,
, 、
、 分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压
分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压 体积分数)。用气体分压表示的平衡常数
体积分数)。用气体分压表示的平衡常数 ,则CO转化率为20%时,
,则CO转化率为20%时,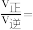
(2)探索氮氧化合物反应的特征及机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
 可发生二聚反应生成
可发生二聚反应生成 ,化学方程式为
,化学方程式为 ,上述反应达到平衡后,升高温度可使体系颜色加深。已知该反应的正反应速率方程为
,上述反应达到平衡后,升高温度可使体系颜色加深。已知该反应的正反应速率方程为 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中 、
、 分别为正、逆反应的速率常数。则图lgk表示速率常数的对数;图中A、B、C、D点的纵坐标分别为
分别为正、逆反应的速率常数。则图lgk表示速率常数的对数;图中A、B、C、D点的纵坐标分别为 、
、 ,
, ,
,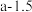 ,则温度T1时化学平衡常数K=
,则温度T1时化学平衡常数K= 。上述反应达到平衡后,继续通入一定量的
。上述反应达到平衡后,继续通入一定量的 ,则
,则 的平衡转化率将
的平衡转化率将 的体积分数将
的体积分数将
(3)反应
 的反应机理如下:
的反应机理如下:①第一步:
 (快速平衡)
(快速平衡)第二步:
 (快速平衡)
(快速平衡)第三步:
 (慢反应)
(慢反应)②只需一步完成的反应称为基元反应,基元反应如
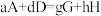 的速率方程,
的速率方程,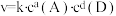 ,k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。
,k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。 与
与 反应生成
反应生成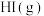 的速率方程为v=
的速率方程为v= (用含
(用含 、
、 、
、 …的代数式表示)。
…的代数式表示)。(4)硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是
 的,催化氧化:
的,催化氧化:
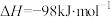 。将组成(物质的量分数)为2m%
。将组成(物质的量分数)为2m%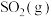 、m%
、m% 和q%
和q% 的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若
的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若 转化率为
转化率为 ,则
,则 压强为
压强为
更新时间:2022-10-11 23:00:04
|
相似题推荐
计算题
|
适中
(0.65)
【推荐1】在25℃时,向100mL含氯化氢14.6g的盐酸溶液里放入5.60g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2min末,收集到1.12L(标准状况)氢气,在此之后,又经过4min,铁粉完全溶解,则:
(1)在前2min内用FeCl2表示的平均反应速率是____________
(2)在后4min内用HCl表示的平均反应速率是______________
(3)前2min与后4min相比,反应速率较快的是_____________ ,其原因是_____________ 。
(4)反应结束后,溶液中Cl-的物质的量浓度为_____________ 。
(1)在前2min内用FeCl2表示的平均反应速率是
(2)在后4min内用HCl表示的平均反应速率是
(3)前2min与后4min相比,反应速率较快的是
(4)反应结束后,溶液中Cl-的物质的量浓度为
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】化学反应速率和限度与生产、生活密切相关。
(1)用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
①实验过程如图所示,分析判断___________ 段化学反应速率最快。
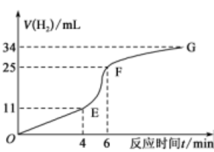
②将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其原因是___________ 。
(2)某温度时,在2 L恒容容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。
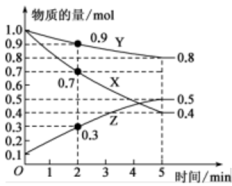
①由图中的数据分析,该反应的化学方程式为:___________ 。
②反应开始至2 min时,Z的平均反应速率为___________ 。
③5 min后Z的生成速率___________ (填“大于”“小于”或“等于”)10 min后Z的生成速率。
(1)用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
①实验过程如图所示,分析判断

②将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其原因是
(2)某温度时,在2 L恒容容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。

①由图中的数据分析,该反应的化学方程式为:
②反应开始至2 min时,Z的平均反应速率为
③5 min后Z的生成速率
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐3】300°C时,向2 L的恒容密闭容器中,充入2 mol CO2(g)和2 mol H2(g)使之发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得各物质的物质的量浓度变化如图所示:
CH3OH(g)+H2O(g),测得各物质的物质的量浓度变化如图所示:
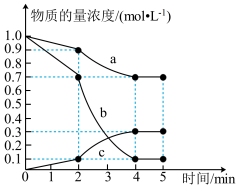
(1)由图可知,CO2(g)的浓度随时间的变化为曲线___________ (填“a”“b”或“c”);0~2 min内的平均反应速率v(CO2 )为___________ 。
(2)已知:反应至2 min时,改变了某一反应条件。由图可知,0~2 min内CH3OH(g)的生成速率___ (填“大于”“小于”或“等于”)2~4 min内CH3OH(g) 的生成速率。
(3)5 min时,CO2(g)的转化率(反应时消耗CO2的物质的量占起始投入CO2的物质的量的百分比)为___________ ,此时容器内气体总压强与反应前容器内气体总压强之比为___ 。
 CH3OH(g)+H2O(g),测得各物质的物质的量浓度变化如图所示:
CH3OH(g)+H2O(g),测得各物质的物质的量浓度变化如图所示:
(1)由图可知,CO2(g)的浓度随时间的变化为曲线
(2)已知:反应至2 min时,改变了某一反应条件。由图可知,0~2 min内CH3OH(g)的生成速率
(3)5 min时,CO2(g)的转化率(反应时消耗CO2的物质的量占起始投入CO2的物质的量的百分比)为
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】在一定温度下,在1L密闭容器中加amolSO2和bmolO2发生反应2SO2+O2 2SO3,反应达到平衡时有cmolSO2发生了反应,试填下列空白:
2SO3,反应达到平衡时有cmolSO2发生了反应,试填下列空白:
(1)生成___ molSO3;
(2)O2的转化率为___ ;
(3)平衡时容器内气体的总物质的量为___ mol;
(4)达到平衡时,c(SO2)=___ mol/L。
 2SO3,反应达到平衡时有cmolSO2发生了反应,试填下列空白:
2SO3,反应达到平衡时有cmolSO2发生了反应,试填下列空白:(1)生成
(2)O2的转化率为
(3)平衡时容器内气体的总物质的量为
(4)达到平衡时,c(SO2)=
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】Na2CO3、NaHCO3及xNa2CO3·yH2O2 (过碳酸钠)在工农业生产上用途非常广泛。
(1)0.1mol·L-1Na2CO3溶液加水稀释时,溶液的pH___________ (填“增大”、“减小”或“不变”)。
(2)25℃时,H2CO3的电离常数Ka1=5×10-7,Ka2=5×10-11,NH3·H2O的电离常数Kb=1.8×10-5,计算下列平衡常数。
①NaHCO3水解反应HCO3-+H2O H2CO3+OH-的平衡常数为K=
H2CO3+OH-的平衡常数为K=___________ (填数值)。
②反应HCO3-+NH3·H2O CO32-+NH4++H2O的平衡常数为K=
CO32-+NH4++H2O的平衡常数为K=___________ (填数值)。
(3)一种测定xNa2CO3·yH2O2中y/x值的方法如下:
①滴定CO 时,终点溶液颜色变化是
时,终点溶液颜色变化是___________ 。
②滴定H2O2时,MnO 被还原为Mn2+,反应的离子方程式为
被还原为Mn2+,反应的离子方程式为___________ 。
③若消耗盐酸25.00mL,消耗KMnO4溶液19.00mL。计算y/x的值(列出计算过程)。
(1)0.1mol·L-1Na2CO3溶液加水稀释时,溶液的pH
(2)25℃时,H2CO3的电离常数Ka1=5×10-7,Ka2=5×10-11,NH3·H2O的电离常数Kb=1.8×10-5,计算下列平衡常数。
①NaHCO3水解反应HCO3-+H2O
 H2CO3+OH-的平衡常数为K=
H2CO3+OH-的平衡常数为K=②反应HCO3-+NH3·H2O
 CO32-+NH4++H2O的平衡常数为K=
CO32-+NH4++H2O的平衡常数为K=(3)一种测定xNa2CO3·yH2O2中y/x值的方法如下:

①滴定CO
 时,终点溶液颜色变化是
时,终点溶液颜色变化是②滴定H2O2时,MnO
 被还原为Mn2+,反应的离子方程式为
被还原为Mn2+,反应的离子方程式为③若消耗盐酸25.00mL,消耗KMnO4溶液19.00mL。计算y/x的值(列出计算过程)。
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐3】向2.0 L恒容密闭容器中充入1.0 mol PCl5,在温度为T℃时发生如下反应PCl5(g)  PCl3(g)+C12(g) ΔH=+124 kJ·mol-1。反应过程中测定的部分数据见下表:
PCl3(g)+C12(g) ΔH=+124 kJ·mol-1。反应过程中测定的部分数据见下表:
回答下列问题:
(1)反应在前50 s的平均速率v(PCl5) =______________ ;
(2)温度为T℃时,该反应的化学平衡常数=________ ;
(3)要提高上述反应的转化率,可采取的措施是________ (任写一种) ;
(4)在温度为T℃时,若起始时充入0.5 mol PCl5和a mol Cl2,平衡时PCl5的转化率仍为20%,则a=________ 。
 PCl3(g)+C12(g) ΔH=+124 kJ·mol-1。反应过程中测定的部分数据见下表:
PCl3(g)+C12(g) ΔH=+124 kJ·mol-1。反应过程中测定的部分数据见下表:| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
回答下列问题:
(1)反应在前50 s的平均速率v(PCl5) =
(2)温度为T℃时,该反应的化学平衡常数=
(3)要提高上述反应的转化率,可采取的措施是
(4)在温度为T℃时,若起始时充入0.5 mol PCl5和a mol Cl2,平衡时PCl5的转化率仍为20%,则a=
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐1】某温度时,在容积为5L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间变化的曲线如图所示:(注:A的转化率= ×100%)
×100%)
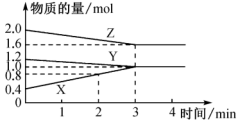
(1)该反应的化学方程式为_______ 。
(2)该反应是从_______ (填“正反应”“逆反应”“正、逆反应同时”)开始的;反应开始至2min末,用X表示的化学反应速率为_______ ,此时Z与Y的物质的量之比为_______ 。
(3)该反应从开始到达到平衡时,Z的转化率与Y的转化率之比为_______ 。
(4)4min时,v(X):v(Y):v(Z)=_______ ;下列哪些数据在反应开始至反应达到平衡时。一直保持不变是_______ (填字母)。
a.压强 b.密度 c.相对平均式量 d.反应物的浓度
 ×100%)
×100%)
(1)该反应的化学方程式为
(2)该反应是从
(3)该反应从开始到达到平衡时,Z的转化率与Y的转化率之比为
(4)4min时,v(X):v(Y):v(Z)=
a.压强 b.密度 c.相对平均式量 d.反应物的浓度
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】在容积为10L的密闭容器中,进行如下反应:A(g)+2B(g) C(g)+D(g),最初加入1.0mol A和2.2mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),最初加入1.0mol A和2.2mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。
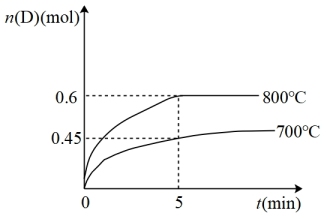
试回答下列问题:
(1)800℃时,0~5min内,以B表示的平均反应速率为_______ 。
(2)能判断反应达到化学平衡状态的依据是_______(填字母)。
(3)若最初加入1.0mol A和2.2mol B,利用图中数据计算800℃时的平衡常数K=_______ ,该反应为_______ 反应(填“吸热”或“放热”)。
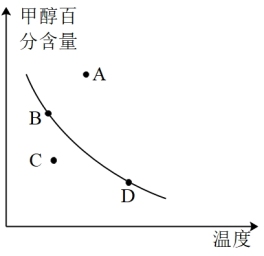
(4)已知 2CH3OH(g) CH3OCH3(g)+H2O(g),在不同温度下的平衡常数:400℃,K=32;500℃,K=44。已知在密闭容器中,测得某时刻各组分的浓度如下:
CH3OCH3(g)+H2O(g),在不同温度下的平衡常数:400℃,K=32;500℃,K=44。已知在密闭容器中,测得某时刻各组分的浓度如下:
①判断该反应的∆H_______ 0(填“>”、“<”或“=”)。若此时系统温度400℃,比较正、逆反应速率的大小:υ正_______ υ逆(填“>”、“<”或“=”)。
②平衡时,若以甲醇百分含量为纵坐标,以温度为横坐标,此时反应点在图象的位置是图中_______ 点,比较图中B、D两点所对应的正反应速率B_______ D(填“>”、“<”或“=”)。
 C(g)+D(g),最初加入1.0mol A和2.2mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),最初加入1.0mol A和2.2mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。
试回答下列问题:
(1)800℃时,0~5min内,以B表示的平均反应速率为
(2)能判断反应达到化学平衡状态的依据是_______(填字母)。
| A.容器中压强不变 | B.混合气体中c(A)不变 |
| C.v正(B)=2v逆(D) | D.c(A)=c(C) |
(4)已知 2CH3OH(g)
 CH3OCH3(g)+H2O(g),在不同温度下的平衡常数:400℃,K=32;500℃,K=44。已知在密闭容器中,测得某时刻各组分的浓度如下:
CH3OCH3(g)+H2O(g),在不同温度下的平衡常数:400℃,K=32;500℃,K=44。已知在密闭容器中,测得某时刻各组分的浓度如下:| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 浓度/(mol·L-1) | 0.54 | 0 68 68 | 0.68 |
②平衡时,若以甲醇百分含量为纵坐标,以温度为横坐标,此时反应点在图象的位置是图中
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐3】一定温度下,在容积为2 L的恒容密闭容器中分别充入2.4 mol NO和2.4 mol CO,发生可逆反应: △H<0,反应过程中部分反应物和生成物的物质的量的变化关系如图所示:
△H<0,反应过程中部分反应物和生成物的物质的量的变化关系如图所示:
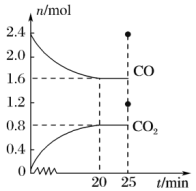
(1)当反应达到平衡时,NO和CO的转化率之比是___________ 。0~20 min内反应速率v(N2)=___________ 。
(2)该温度下的平衡常数K=___________ ,25 min时,若温度不变,向容器中再分别充入0.4 mol CO和0.4 mol N2,则化学平衡___________ 将 填“向左”“向右”或“不”
填“向左”“向右”或“不” 移动。
移动。
(3)25 min时,保持其它条件不变,将反应体系中的c(CO)、c(NO)、c(N2)、c(CO2)均同时减半,化学平衡将___________ 将 填“向左”“向右”或“不”
填“向左”“向右”或“不” 移动。
移动。
(4)若换用一个恒容、绝热的容器,使容器内温度迅速升至原来的2倍,则平衡将___________  填“向左”“向右”或“不”
填“向左”“向右”或“不” 移动。达到新平衡后,容器内温度
移动。达到新平衡后,容器内温度___________  填“大于”“小于”或“等于”
填“大于”“小于”或“等于” 原来的2倍。
原来的2倍。
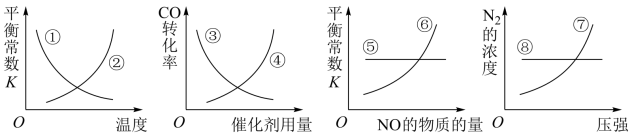
(5)反应达到平衡后,若改变某一个条件,下列八条曲线(①~⑧)正确的是___________  填序号
填序号 。
。
(6)汽车尾气治理的方法之一是使用催化转化装置,其中的反应原理之一是: ,△H=-113.0 kJ/mol,室温条件下,该反应的△S=-145.3 J/(mol·K),则该反应
,△H=-113.0 kJ/mol,室温条件下,该反应的△S=-145.3 J/(mol·K),则该反应___________  填“能”或“不能”
填“能”或“不能” 自发进行。
自发进行。
 △H<0,反应过程中部分反应物和生成物的物质的量的变化关系如图所示:
△H<0,反应过程中部分反应物和生成物的物质的量的变化关系如图所示:
(1)当反应达到平衡时,NO和CO的转化率之比是
(2)该温度下的平衡常数K=
 填“向左”“向右”或“不”
填“向左”“向右”或“不” 移动。
移动。(3)25 min时,保持其它条件不变,将反应体系中的c(CO)、c(NO)、c(N2)、c(CO2)均同时减半,化学平衡将
 填“向左”“向右”或“不”
填“向左”“向右”或“不” 移动。
移动。(4)若换用一个恒容、绝热的容器,使容器内温度迅速升至原来的2倍,则平衡将
 填“向左”“向右”或“不”
填“向左”“向右”或“不” 移动。达到新平衡后,容器内温度
移动。达到新平衡后,容器内温度 填“大于”“小于”或“等于”
填“大于”“小于”或“等于” 原来的2倍。
原来的2倍。(5)反应达到平衡后,若改变某一个条件,下列八条曲线(①~⑧)正确的是
 填序号
填序号 。
。
(6)汽车尾气治理的方法之一是使用催化转化装置,其中的反应原理之一是:
 ,△H=-113.0 kJ/mol,室温条件下,该反应的△S=-145.3 J/(mol·K),则该反应
,△H=-113.0 kJ/mol,室温条件下,该反应的△S=-145.3 J/(mol·K),则该反应 填“能”或“不能”
填“能”或“不能” 自发进行。
自发进行。
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐1】以二氧化碳加氢合成甲醇的反应为例,在容积为 的密闭容器中加入
的密闭容器中加入 和
和 ,体系中发生的反应有
,体系中发生的反应有
① ;
;
② 。
。
 后体系达到平衡,此时
后体系达到平衡,此时 的转化率为
的转化率为 ,
, 的选择性为
的选择性为 。已知:
。已知: 的选择性
的选择性 。
。
反应①的平衡常数
_______ (写出计算式即可)。
 的密闭容器中加入
的密闭容器中加入 和
和 ,体系中发生的反应有
,体系中发生的反应有①
 ;
;②
 。
。 后体系达到平衡,此时
后体系达到平衡,此时 的转化率为
的转化率为 ,
, 的选择性为
的选择性为 。已知:
。已知: 的选择性
的选择性 。
。反应①的平衡常数

您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】按要求回答下列问题:
(1)甲醇是一种重要的化工原料,有着重要的用途和应用前景。工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)⇌CH3OH(g);△H1
反应II:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g);△H2
①上述反应中原子利用率百分之百的是______ (填“I”或“Ⅱ”)
②下表所列数据是反应I在不同温度下的化学平衡常数(K)
由表中数据判断△H1______ 0,T℃时,将2mol CO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,此时T为______ 。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______ 。
(1)甲醇是一种重要的化工原料,有着重要的用途和应用前景。工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)⇌CH3OH(g);△H1
反应II:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g);△H2
①上述反应中原子利用率百分之百的是
②下表所列数据是反应I在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐3】t ℃时,将2mol A 和 6 mol B 充入容积固定为 2 L 的密闭容器中发生反应: A(g)+2B(g)  2C(g)。 反应 2 min 时测得 C 的浓度为 0.4 mol·L- 1 ,4 min 末反应达到平衡, B 的转化率为 50%。试计算:
2C(g)。 反应 2 min 时测得 C 的浓度为 0.4 mol·L- 1 ,4 min 末反应达到平衡, B 的转化率为 50%。试计算:
(1)第 2 min 到第 4 min 内 A 的平均反应速率为_______
(2)t ℃时该反应的平衡常数为_______
(3)若从反应开始到建立平衡时放出热量 353.88 kJ,则该反应的 ΔH=_______ 。(写出三个题 完整计算过程,无计算过程不给分)
 2C(g)。 反应 2 min 时测得 C 的浓度为 0.4 mol·L- 1 ,4 min 末反应达到平衡, B 的转化率为 50%。试计算:
2C(g)。 反应 2 min 时测得 C 的浓度为 0.4 mol·L- 1 ,4 min 末反应达到平衡, B 的转化率为 50%。试计算:(1)第 2 min 到第 4 min 内 A 的平均反应速率为
(2)t ℃时该反应的平衡常数为
(3)若从反应开始到建立平衡时放出热量 353.88 kJ,则该反应的 ΔH=
您最近一年使用:0次



