名校
1 . 甲、乙、丙三个容器中最初存在的物质及其数量如图所示,三个容器最初的容积相等、温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是
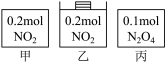
| A.平衡时各容器内c(NO2)的大小顺序为乙>甲>丙 |
| B.平衡时N2O4的百分含量:乙>甲=丙 |
| C.平衡时甲中NO2与丙中N2O4的转化率不可能相同 |
| D.平衡时混合物的平均相对分子质量:甲>乙>丙 |
您最近一年使用:0次
2019-11-06更新
|
2233次组卷
|
28卷引用:黑龙江省哈尔滨师范大学附属中学2021-2022学年高二上学期开学考试化学试题
黑龙江省哈尔滨师范大学附属中学2021-2022学年高二上学期开学考试化学试题山西省朔州市怀仁一中2019-2020学年高二上学期期中考试化学试题山东省新泰市第二中学2019-2020学年高二上学期期中考试化学试题步步为赢 高二化学寒假作业:作业六 化学平衡中的模型构建与等效平衡辽宁省辽阳市集美中学2020届高二12月月考化学试题江西省万载中学2019-2020学年高二12月月考(创新班)化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节综合训练高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 第二节综合训练黑龙江省哈尔滨三中2021届高三上学期期中考试化学试题天津市第一中学2021届高三上学期第二次月考化学试题(已下线)练习4 化学平衡-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)山西省寿阳县第一中学2020—2021学年高二上学期第二次月考化学试题黑龙江省龙东南六校2020-2021学年高二上学期期末联考化学试题河南省林州市第一中学2020-2021学年高二下学期第二次月考化学试题选择性必修1 专题2 第三单元综合训练(已下线)选择性必修1 期中检测(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)山东省临沂市平邑县第一中学实验部2021-2022学年高二上学期第二次月考化学试题湖北省武汉市长虹中学2021-2022学年高二上学期10月月考化学试卷河南省洛阳市2021-2022学年高二上期期中考试化学试题天津市外国语大学附属外国语学校2021-2022学年高二上学期期中阶段性检测化学试题江西省新余市2021-2022学年高二上学期期末检测化学试题云南省凤庆县第一中学2021-2022学年高二下学期3月份考试化学试题四川省广安市华蓥中学校2021-2022学年高二上学期11月月考化学试题山西省山西大学附属中学2022-2023学年高二上学期10月考化学试题2.3.1浓度 压强变化对化学平衡的影响 课后安徽省安庆市第二中学2023-2024学年高二上学期期中考试化学试卷山东省青岛第十七中学2023-2024学年高二上学期12月月考化学试题福建师范大学附属中学2023-2024学年高二上学期期中考试化学试题
名校
2 . 在一密闭容器中,可逆反应:aA(g) + bB(g)  cC(g)达平衡后,测得此时C的浓度为0.6 mol/L。若保持温度不变,将容器的容积压缩为原来的2/3,当重新达平衡后,C的浓度是0.8 mol/L。下列说法正确的是
cC(g)达平衡后,测得此时C的浓度为0.6 mol/L。若保持温度不变,将容器的容积压缩为原来的2/3,当重新达平衡后,C的浓度是0.8 mol/L。下列说法正确的是
 cC(g)达平衡后,测得此时C的浓度为0.6 mol/L。若保持温度不变,将容器的容积压缩为原来的2/3,当重新达平衡后,C的浓度是0.8 mol/L。下列说法正确的是
cC(g)达平衡后,测得此时C的浓度为0.6 mol/L。若保持温度不变,将容器的容积压缩为原来的2/3,当重新达平衡后,C的浓度是0.8 mol/L。下列说法正确的是| A.a + b > c | B.平衡向正反应方向移动 |
| C.物质A的转化率降低 | D.物质C的质量分数增加 |
您最近一年使用:0次
2017-11-07更新
|
302次组卷
|
2卷引用:四川省成都市七中实验学校2018届高三上学期入学考试化学试题
3 . 处理、回收CO是环境科学家研究的热点课题。
(1)CO用于处理犬气污染物N2O所发生的反应为:N2O(g)+CO(g) CO2(g)+N2(g)ΔH,几种物质的相对能量如下:
CO2(g)+N2(g)ΔH,几种物质的相对能量如下:
①ΔH=______ kJ·mol-1;改变下列“量”,一定会引起ΔH发生变化的是____ 填代号)
A.反应物浓度B.催化剂C.化学计量数
②有人提出上述反应可以用Fe作催化剂。其总反应分两步进行:第一步:Fe+N2O=FeO+N2,第二步:______ (写化学方程式)。第二步反应不影响总反应达到平衡所用时间,由此推知,第二步反应活化能____ 第一步反应活化能(填“大于”、“小于”或等于”)。
(2)在实验室,采用I2O5测定空气中CO的含量。在密闭容器中充入足量的I2O5粉末和一定量的CO,发生反应:I2O5(g)+5CO(g) 5CO2(g)+I2(s)。测得CO的转化率如图1所示。
5CO2(g)+I2(s)。测得CO的转化率如图1所示。
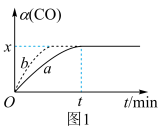
①相对曲线a,曲线b仅改变一个条件,改变的条件可能是______ 。
②在此温度下,该可逆反应的平衡常数K=_____ (用含x的代数式表示)。
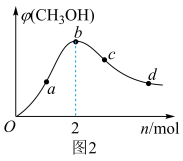
(3)工业上,用CO和H2合成CH3OH。在1L恒容密闭容器中充入1 mol CO(g)和n mol H2,在250℃发生反应:CO(g)+2H2(g) CH3OH(g),测得混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是
CH3OH(g),测得混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是___ 。
(4)CO-空气碱性燃料电池(用KOH作电解质),当恰好完全生成KHCO3时停止放电。写出此时负极的电极反应式:______ 。
(1)CO用于处理犬气污染物N2O所发生的反应为:N2O(g)+CO(g)
 CO2(g)+N2(g)ΔH,几种物质的相对能量如下:
CO2(g)+N2(g)ΔH,几种物质的相对能量如下:| 物质 | N2O(g) | CO(g) | CO2(g) | N2(g) |
| 相对能量kJ·mol-1 | 475.5 | 283 | 0 | 393.5 |
①ΔH=
A.反应物浓度B.催化剂C.化学计量数
②有人提出上述反应可以用Fe作催化剂。其总反应分两步进行:第一步:Fe+N2O=FeO+N2,第二步:
(2)在实验室,采用I2O5测定空气中CO的含量。在密闭容器中充入足量的I2O5粉末和一定量的CO,发生反应:I2O5(g)+5CO(g)
 5CO2(g)+I2(s)。测得CO的转化率如图1所示。
5CO2(g)+I2(s)。测得CO的转化率如图1所示。
①相对曲线a,曲线b仅改变一个条件,改变的条件可能是
②在此温度下,该可逆反应的平衡常数K=
(3)工业上,用CO和H2合成CH3OH。在1L恒容密闭容器中充入1 mol CO(g)和n mol H2,在250℃发生反应:CO(g)+2H2(g)
 CH3OH(g),测得混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是
CH3OH(g),测得混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是
(4)CO-空气碱性燃料电池(用KOH作电解质),当恰好完全生成KHCO3时停止放电。写出此时负极的电极反应式:
您最近一年使用:0次
2019-09-15更新
|
318次组卷
|
2卷引用:重庆市第一中学2020届高三上学期摸底考试理科综合化学试题
名校
4 . 在一定条件下某体积一定的密闭容器中发生的反应aA(g)+bB(g) xC(g)符合下图甲所示关系(c%表示平衡混合气体中C的百分含量,T表示温度,p表示压强)。则图乙中纵轴y是指
xC(g)符合下图甲所示关系(c%表示平衡混合气体中C的百分含量,T表示温度,p表示压强)。则图乙中纵轴y是指
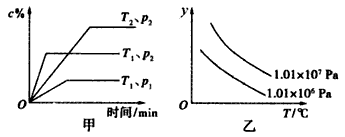
 xC(g)符合下图甲所示关系(c%表示平衡混合气体中C的百分含量,T表示温度,p表示压强)。则图乙中纵轴y是指
xC(g)符合下图甲所示关系(c%表示平衡混合气体中C的百分含量,T表示温度,p表示压强)。则图乙中纵轴y是指
| A.平衡混合气的密度 |
| B.平衡混合气中B的百分含量 |
| C.平衡混合气的总物质的量 |
| D.平衡混合气的平均相对分子质量 |
您最近一年使用:0次
2017-08-30更新
|
709次组卷
|
9卷引用:黑龙江省大庆中学2018届高三上学期开学考试化学试题
黑龙江省大庆中学2018届高三上学期开学考试化学试题辽宁省盘锦市育才学校2020-2021学年高二下学期期初考试化学试题内蒙古第一机械制造(集团)有限公司第一中学2019-2020学年高二10月月考化学试题江西省鹰潭市2020-2021学年高二上学期期末质量检测化学试题山东省淄博市沂源县第二中学2020-2021学年高二下学期期中考试化学试题福建省宁化第一中学2021-2022学年高二上学期第一次阶段考试化学试题贵州省黔西南州赛文高级中学 2021-2022学年高二上学期期中考试化学试题江西省赣州市教育发展联盟2021-2022学年高二上学期第7次联考化学试题 江西省新余市2021-2022学年高二上学期期末检测化学试题



