1 . 将1mol水在100 ℃, 101.3 kPa下全部蒸发为水蒸气,再沿着p/V=a (常数)的可逆过程压缩,终态压力为152.0kPa.设水蒸气为理想气体,在此过程温度范围内,它的摩尔等压热容Cpm=33.20Jmol-1K-1.水的气化热为40.66J ·mol-1 (假设-定温度范围内水的气化热不变)。
(1)计算整个过程终态的热力学温度T2___________ 。
(2)通过计算,判断终态时体系中是否存在液态水,若存在,液态水的量是多少___________ 。
(3)计算整个过程发生后,体系的焓变 ΔH___________ 。
(4)若整个过程的熵变为132.5JK-1,推算可逆过程的熵变ΔS___________ 。
(1)计算整个过程终态的热力学温度T2
(2)通过计算,判断终态时体系中是否存在液态水,若存在,液态水的量是多少
(3)计算整个过程发生后,体系的焓变 ΔH
(4)若整个过程的熵变为132.5JK-1,推算可逆过程的熵变ΔS
您最近一年使用:0次
名校
2 . 氮及其化合物在生活及工业生产中有着重要应用。请回答以下问题:
(1)如图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为___________________ .
②过程(Ⅰ)和过程(Ⅱ)的反应热________ (填“相同”或“不同”).
③某温度下,在1 L恒温恒容容器中充入1molN2和3 mol H2进行上述反应,10 min达到平衡,此时容器内压强变为原来的7/8.
a.该过程的平衡常数的表达式为____________ .
b.N2的平衡转化率为________ .
c.此时若保持容器温度和体积不变,向其中再加入2.25 molN2和0.5 mol NH3,则平衡________ (填“正向”“逆向”或“不”)移动.
(2)用NH3可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
反应Ⅱ:N2(g)+O2(g) 2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
反应Ⅲ:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
则反应Ⅱ中的b=_____ (用含a、c的代数式表示),K3=_____ (用K1和K2表示).反应Ⅲ中的ΔS______ (填“>”“<”或“=”)0.
(3)在恒容的密闭器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图所示:
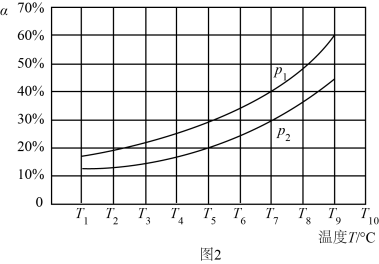
①分析得p1________ p2.(填“>”“<”或“=”)
②下列叙述中,不能作为判断反应Ⅲ已经达到平衡状态的标志的是________ (填序号).
a.N2的浓度不再改变 b.断裂6 mol N—H键的同时,有6 mol H—O键形成
c.容器中压强不再变化 d.混合气体的密度保持不变
(1)如图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:
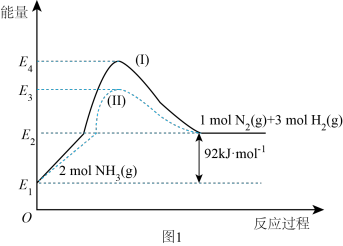
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为
②过程(Ⅰ)和过程(Ⅱ)的反应热
③某温度下,在1 L恒温恒容容器中充入1molN2和3 mol H2进行上述反应,10 min达到平衡,此时容器内压强变为原来的7/8.
a.该过程的平衡常数的表达式为
b.N2的平衡转化率为
c.此时若保持容器温度和体积不变,向其中再加入2.25 molN2和0.5 mol NH3,则平衡
(2)用NH3可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1反应Ⅱ:N2(g)+O2(g)
 2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2反应Ⅲ:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3则反应Ⅱ中的b=
(3)在恒容的密闭器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图所示:

①分析得p1
②下列叙述中,不能作为判断反应Ⅲ已经达到平衡状态的标志的是
a.N2的浓度不再改变 b.断裂6 mol N—H键的同时,有6 mol H—O键形成
c.容器中压强不再变化 d.混合气体的密度保持不变
您最近一年使用:0次
2019-04-28更新
|
1183次组卷
|
7卷引用:【全国百强校】四川省阆中中学2018-2019学年高二下学期期中考试化学试题



