名校
解题方法
1 . I.Mg(OH)2具有广泛的用途。以菱镁矿(主要成分是MgCO3,含少量Al2O3、FeO等)为原料制备Mg(OH)2的工艺流程如下:
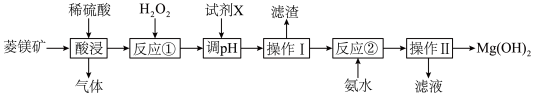
已知:常温下,部分氢氧化物开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“气体”的电子式是___________ 。
(2)下列操作不能显著增大“酸浸”速率的是___________ (填标号)。
a.适当增大稀硫酸的浓度 b.适当升高浸取液的温度 c.增大压强 d.将菱镁矿粉碎
(3)写出反应①的离子方程式:___________ 。
(4)“调pH”时,合适的pH是___________ (填标号)。
a.1.9 b.3.4 c.7.6 d.9.6
常温下,滴加氨水时,Mg2+的浓度为1.0×10-5 mol⋅L-1时被认为完全沉淀,这时的pH为x,x=___________ (已知:常温下, ,
, )。
)。
II.聚合硫酸铁 是一种无机高分子絮凝剂,可用于水的处理。
是一种无机高分子絮凝剂,可用于水的处理。
聚合硫酸铁 产品的组成可通过下列实验测定:
产品的组成可通过下列实验测定:
①称取一定质量的聚合硫酸铁样品配成100.00mL溶液A;
②准确量取20.00mL溶液A,加入足量盐酸酸化后,加BaCl2(ag)至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65g;
③准确量取20.00mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00mL溶液B;
④准确量取25.00mL溶液B,用0.1000mol⋅L-1的KMnO4(H+)滴定至终点,消耗KMnO4(ag)8.00mL。
(5)该聚合硫酸铁的化学式为___________ 。若步骤③配制溶液B操作时间过长,则y会___________ (选填“偏大”“偏小”或“不变”)。

已知:常温下,部分氢氧化物开始沉淀和完全沉淀的pH如下表所示:
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 7.6 | 1.9 | 3.4 | 9.1 |
| 完全沉淀的pH | 9.6 | 3.2 | 4.8 |  |
(1)“气体”的电子式是
(2)下列操作不能显著增大“酸浸”速率的是
a.适当增大稀硫酸的浓度 b.适当升高浸取液的温度 c.增大压强 d.将菱镁矿粉碎
(3)写出反应①的离子方程式:
(4)“调pH”时,合适的pH是
a.1.9 b.3.4 c.7.6 d.9.6
常温下,滴加氨水时,Mg2+的浓度为1.0×10-5 mol⋅L-1时被认为完全沉淀,这时的pH为x,x=
 ,
, )。
)。II.聚合硫酸铁
 是一种无机高分子絮凝剂,可用于水的处理。
是一种无机高分子絮凝剂,可用于水的处理。聚合硫酸铁
 产品的组成可通过下列实验测定:
产品的组成可通过下列实验测定:①称取一定质量的聚合硫酸铁样品配成100.00mL溶液A;
②准确量取20.00mL溶液A,加入足量盐酸酸化后,加BaCl2(ag)至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65g;
③准确量取20.00mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00mL溶液B;
④准确量取25.00mL溶液B,用0.1000mol⋅L-1的KMnO4(H+)滴定至终点,消耗KMnO4(ag)8.00mL。
(5)该聚合硫酸铁的化学式为
您最近一年使用:0次
名校
2 . 下表中的物质为化学实验室常用药品:
回答下列问题:
(1)NH4Cl溶液呈弱酸性的原因(用离子方程式表示):_______ ;常温时,0.1mol·L-1的溶液呈碱性的是_______ (填序号)。
(2)标准状况下,5.6LHCl气体完全溶于蒸馏水中,形成2500mL溶液,则该溶液的pH=_______ ;常温时,pH=3的H2SO4溶液中,由水电离出的c水(H+)=_______ mol‧L-1;pH=10的Na2CO3溶液中由水电离出的c水(OH-)=_______ mol‧L-1。
(3)常温时,向CH3COOH溶液中加入少量NH4Cl固体,电离平衡常数Ka_______ (填“增大”“减小”或“不变”。
(4)写出NaHCO3在生活中的一种用途:_______ 。
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 物质 | H2SO4 | CH3COOH | NaHCO3 | Na2CO3 | NH4Cl | NH3·H2O | HCl | NaCl |
(1)NH4Cl溶液呈弱酸性的原因(用离子方程式表示):
(2)标准状况下,5.6LHCl气体完全溶于蒸馏水中,形成2500mL溶液,则该溶液的pH=
(3)常温时,向CH3COOH溶液中加入少量NH4Cl固体,电离平衡常数Ka
(4)写出NaHCO3在生活中的一种用途:
您最近一年使用:0次
2023-02-12更新
|
202次组卷
|
2卷引用:广东省汕头市潮阳区教师发展中心教学研究室 2022-2023学年高二上学期期末质量检测化学试题
3 . 砷( )是第四周期第VA族元素,可以形成
)是第四周期第VA族元素,可以形成 、
、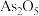 、
、 、
、 等化合物,有着广泛的用途。回答下列问题:
等化合物,有着广泛的用途。回答下列问题:
(1)工业上常将含砷废渣(主要成分为 )制成浆状,通入O2氧化,生成
)制成浆状,通入O2氧化,生成 和单质硫。发生反应的化学方程式:
和单质硫。发生反应的化学方程式: 该反应平衡常数表达式
该反应平衡常数表达式___________ 。该反应需要在加压下进行,原因是___________ 。
(2)298 K时,将20 mL3x mol/L的 、20 mL3x mol/L的I2和20 mL NaOH溶液混合,发生反应:
、20 mL3x mol/L的I2和20 mL NaOH溶液混合,发生反应: 。溶液中c(
。溶液中c( )与反应时间t的关系如图所示。
)与反应时间t的关系如图所示。

①下列可判断反应达到平衡状态的是___________ (填序号)
a.溶液的pH不再变化b.v(I-)=2v( )
)
c.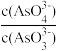 不再变化d.c(I-)=y mol/L
不再变化d.c(I-)=y mol/L
②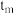 时,v正
时,v正___________ (填“大于”“小于”或“等于”)v逆。
③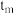 时v逆
时v逆___________ (填“大于”“小于”或“等于”)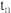 时v逆。
时v逆。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________ 。
 )是第四周期第VA族元素,可以形成
)是第四周期第VA族元素,可以形成 、
、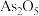 、
、 、
、 等化合物,有着广泛的用途。回答下列问题:
等化合物,有着广泛的用途。回答下列问题:(1)工业上常将含砷废渣(主要成分为
 )制成浆状,通入O2氧化,生成
)制成浆状,通入O2氧化,生成 和单质硫。发生反应的化学方程式:
和单质硫。发生反应的化学方程式: 该反应平衡常数表达式
该反应平衡常数表达式(2)298 K时,将20 mL3x mol/L的
 、20 mL3x mol/L的I2和20 mL NaOH溶液混合,发生反应:
、20 mL3x mol/L的I2和20 mL NaOH溶液混合,发生反应: 。溶液中c(
。溶液中c( )与反应时间t的关系如图所示。
)与反应时间t的关系如图所示。
①下列可判断反应达到平衡状态的是
a.溶液的pH不再变化b.v(I-)=2v(
 )
)c.
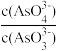 不再变化d.c(I-)=y mol/L
不再变化d.c(I-)=y mol/L②
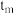 时,v正
时,v正③
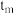 时v逆
时v逆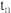 时v逆。
时v逆。④若平衡时溶液的pH=14,则该反应的平衡常数K为
您最近一年使用:0次
4 . 有一应用前景广阔的纳米材料甲,其由A、B两种短周期非金属元素组成,难溶于水,且硬度大,熔点高。取材料甲与熔融的烧碱反应,生成一种含A元素的含氧酸盐乙和一种含B元素的气体丙,丙能使湿润的红色石蕊试纸变蓝;乙能溶于水,加盐酸产生白色沉淀,盐酸过量沉淀不溶解。
(1)甲的化学式为____________ ,其晶体属于____________ 晶体。
(2)乙的水溶液可以用来做________________________ (写出一种用途)。
(3)B元素的一种氢化物丁,相对分子质量为32,常温下为液体,其燃烧放热多且燃烧产物对环境无污染,因此可用作火箭燃料、燃料电池燃料等。则
①丁的电子式为_____ 。
②丁可由次氯酸钠与过量氨气反应制得,其化学方程式________________________ 。
甲的制备过程中氨气需要过量的理由是____________________________________ 。
③丁的水溶液呈弱碱性,室温下其电离常数K1≈1.0×10-6,则0.01 mol·L-1丁水溶液的pH等于____________ (忽略丁的二级电离和H2O的电离)。
(1)甲的化学式为
(2)乙的水溶液可以用来做
(3)B元素的一种氢化物丁,相对分子质量为32,常温下为液体,其燃烧放热多且燃烧产物对环境无污染,因此可用作火箭燃料、燃料电池燃料等。则
①丁的电子式为
②丁可由次氯酸钠与过量氨气反应制得,其化学方程式
甲的制备过程中氨气需要过量的理由是
③丁的水溶液呈弱碱性,室温下其电离常数K1≈1.0×10-6,则0.01 mol·L-1丁水溶液的pH等于
您最近一年使用:0次
2019-09-06更新
|
249次组卷
|
2卷引用:浙江省浙南名校联盟2018-2019学年高二下学期期末考试化学试题



