1 . I.某学生用0.1000 mol/L NaOH标准溶液测未知浓度的盐酸,其操作步骤如下:
A.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
B.用标准溶液润洗滴定管2~3次
C.调节液面至0或0以下刻度,记下读数
D.量取25.00mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴指示剂
E.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
F.取标准NaOH溶液注入碱式滴定管至0刻度以上2~3cm
(1)请为以上操作进行排序D___ ECA
(2)为便于观察,减少实验误差,你认为最好选择_______ 作为指示剂,判断到达滴定终点的实验现象是_______ 。
(3)盛NaOH标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用图中的_______ 操作。(填“甲”、“乙”、“丙”)。

(4)某学生进行3次实验得到相关数据如表所示。
①则盐酸的物质的量浓度为_______ 。
②在中和滴定的实验中,下列操作能使测定结果偏低的是_______ 。
A.滴定前碱式滴定管尖嘴中有气泡,滴定后气泡消失
B.标准液的读数开始时平视,终点读数时仰视
C.装待测液的锥形瓶没有用待测液润洗
D.装待测液的滴定管没有用待测液润洗
II.氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将4mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL 1.0×l0-4mol/L的KMnO4溶液。
(5)该滴定实验中,是否需要加入指示剂_______ (填写“是”或者“否”),计算血液中含钙离子的浓度为_______ 。
A.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
B.用标准溶液润洗滴定管2~3次
C.调节液面至0或0以下刻度,记下读数
D.量取25.00mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴指示剂
E.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
F.取标准NaOH溶液注入碱式滴定管至0刻度以上2~3cm
(1)请为以上操作进行排序D
(2)为便于观察,减少实验误差,你认为最好选择
(3)盛NaOH标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用图中的

(4)某学生进行3次实验得到相关数据如表所示。
| 滴定次数 | 待测盐酸的体积/mL | 消耗0.1000 mol/L NaOH溶液的体积/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 1.10 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 |
| 第三次 | 25.00 | 1.32 | 26.31 |
②在中和滴定的实验中,下列操作能使测定结果偏低的是
A.滴定前碱式滴定管尖嘴中有气泡,滴定后气泡消失
B.标准液的读数开始时平视,终点读数时仰视
C.装待测液的锥形瓶没有用待测液润洗
D.装待测液的滴定管没有用待测液润洗
II.氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将4mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL 1.0×l0-4mol/L的KMnO4溶液。
(5)该滴定实验中,是否需要加入指示剂
您最近一年使用:0次
名校
解题方法
2 . 某学生用0.1500 mol/L NaOH溶液测定某未知浓度的盐酸溶液,其操作可分解为如下几步:

A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸25.00 mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用序号字母填写):_______ 。_____→_______→F→_______→_______→_______→D。
(2)操作F中应该选择图中滴定管_______ (填标号)。
(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察_______ 。
(4)滴定结果如表所示:
计算该盐酸的物质的量浓度为_______ (精确至0.0001)。
(5)下列操作会导致测定结果偏高的是_______。
(6)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20 mL1.0×10-4 mol/L的KMnO4溶液。
写出用KMnO4滴定H2C2O4的离子方程式_______ 。判断滴定终点是_______ 。

A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸25.00 mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用序号字母填写):
(2)操作F中应该选择图中滴定管
(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察
(4)滴定结果如表所示:
| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 0.60 | 20.60 |
| 3 | 25.00 | 0.20 | 20.19 |
(5)下列操作会导致测定结果偏高的是_______。
| A.碱式滴定管在装液前未用标准NaOH溶液润洗 |
| B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出 |
| C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡 |
| D.达到滴定终点时,仰视读数 |
①可将2 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20 mL1.0×10-4 mol/L的KMnO4溶液。
写出用KMnO4滴定H2C2O4的离子方程式
您最近一年使用:0次
2022-11-10更新
|
258次组卷
|
2卷引用:天津市天津中学2022-2023学年高二上学期期中测试化学试题
3 . I.用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液测定计算中和反应的反应热。回答下列问题:
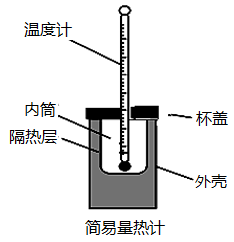
(1)从实验装置上看,图中缺少的一种玻璃用品是___________ 。
(2)如改用0.0275 mol NaOH固体与该盐酸进行实验,则实验中测得的“中和热”数值将___________ (填“偏大”、“偏小”或“无影响”)。
II.氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:(H2C2O4为弱酸)
①可将2 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20.00 mL l.0×l0﹣4 mol/L的KMnO4溶液。
(3)写出用KMnO4滴定H2C2O4的离子方程式___________ 。
(4)滴定时,将KMnO4溶液装在___________ (填“酸式”或“碱式”)滴定管中。
(5)判断滴定终点的方法是___________ 。
(6)误差分析:(填“偏高”、“偏低”或“无影响”)
①如果滴定管用蒸馏水洗后未用酸性KMnO4标准液润洗,则测量结果___________ 。
②滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则测量结果___________ 。
(7)计算:血液中含钙离子的浓度为___________ mol/L

(1)从实验装置上看,图中缺少的一种玻璃用品是
(2)如改用0.0275 mol NaOH固体与该盐酸进行实验,则实验中测得的“中和热”数值将
II.氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:(H2C2O4为弱酸)
①可将2 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20.00 mL l.0×l0﹣4 mol/L的KMnO4溶液。
(3)写出用KMnO4滴定H2C2O4的离子方程式
(4)滴定时,将KMnO4溶液装在
(5)判断滴定终点的方法是
(6)误差分析:(填“偏高”、“偏低”或“无影响”)
①如果滴定管用蒸馏水洗后未用酸性KMnO4标准液润洗,则测量结果
②滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则测量结果
(7)计算:血液中含钙离子的浓度为
您最近一年使用:0次
名校
4 . 实验室用下列方法测定某水样中O2的含量。
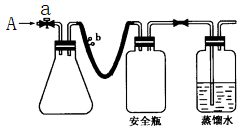
(1)实验原理
①用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为_________________________________________________________ 。
②在酸性条件下,再用I-将生成的MnO(OH)2还原为Mn2+,反应的离子方程式为________________________ 。然后用Na2S2O3标准溶液滴定生成的I2,反应方程式为I2+2Na2S2O3=2NaI+Na2S4O6。
(2)实验步骤
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是_____________________________ ;
②用注射器抽取某水样20.00 mL从A处注入锥形瓶;
③再分别从A处注入含m mol NaOH溶液及过量的MnSO4溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A处注入足量NaI溶液及含n mol H2SO4的硫酸;
⑥重复④的操作;
⑦取下锥形瓶,向其中加入2~3滴__________ 作指示剂;
⑧用0.005 mol·L-1 Na2S2O3溶液滴定至终点。滴定终点的现象是________________________ 。
(3)数据分析
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为__________ mg·L-1。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将__________ (填“偏大”“偏小”或“不变”)。

(1)实验原理
①用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为
②在酸性条件下,再用I-将生成的MnO(OH)2还原为Mn2+,反应的离子方程式为
(2)实验步骤
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是
②用注射器抽取某水样20.00 mL从A处注入锥形瓶;
③再分别从A处注入含m mol NaOH溶液及过量的MnSO4溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A处注入足量NaI溶液及含n mol H2SO4的硫酸;
⑥重复④的操作;
⑦取下锥形瓶,向其中加入2~3滴
⑧用0.005 mol·L-1 Na2S2O3溶液滴定至终点。滴定终点的现象是
(3)数据分析
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将
您最近一年使用:0次
2017-08-24更新
|
475次组卷
|
6卷引用:天津市第一中学2021-2022学年高二上学期期中质量调查化学试题
天津市第一中学2021-2022学年高二上学期期中质量调查化学试题河南省安阳县第一高级中学2017-2018学年高一上学期期中考试化学试题山东省东营市第一中学2021-2022学年高二上学期期中考试化学试题河南省师范大学附属中学2018届高三8月开学考试理科综合化学试题(已下线)2017-2018学年第一学期期末复习备考之精准复习模拟题高三化学(单科)(A卷)四川省威远中学2021届高三上学期第一次月考理综化学试题



