1 . 已知: ①亚硝酸钠(NaNO2)是一种食品添加剂,为无色、无气味的同体,具有防腐和抗氧化作用。②AgNO2 是一种微溶于水、易溶于酸的浅黄色固体。
I.问题探究
(1)人体正常的血红蛋白中应含Fe2+,误食亚硝酸盐(如NaNO2)会致使机体组织缺氧,出现青紫而中毒,原因是___________ 。若发生中毒时,你认为下列物质有助于解毒的是____ (填字母)。
A.牛奶 B.Mg(OH)2 C.维生素C D.小苏打
(2)由于亚硝酸钠和食盐性状相似,曾多次发生过将NaNO2误当食盐食用的事件。要区别NaNO2和NaCl 两种固体,你需用的试剂是_______________ 。
II.实验测定
为了测定某样品中NaNO2的含量,某同学进行如下实验:
①称取样品ag,加水溶解,配制成100 mL 溶液。
②取25.00mL 溶液于锥形瓶中,用0.0200mol/LKMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液VmL。
(1)上述实验①所需玻璃仪器除玻璃棒、胶头滴管之外还有________ 。
(2)在进行滴定操作时,KMnO4溶液盛装在______ (填“酸式”或“碱式”)滴定管中。当滴入最后一滴溶液,________ 时达到滴定终点。
(3) 滴定过程中发生反应的离子方程式是________ ;测得该样品中NaNO2的质量分数为_____ 。
(4)若滴定管未用KMnO4标准溶液润洗就直接注入,则测定结果______ (填“偏大”、“偏小”或“无影响”,下同);若滴定过程中刚出现颜色变化就停止滴定,则测定结果________ 。
I.问题探究
(1)人体正常的血红蛋白中应含Fe2+,误食亚硝酸盐(如NaNO2)会致使机体组织缺氧,出现青紫而中毒,原因是
A.牛奶 B.Mg(OH)2 C.维生素C D.小苏打
(2)由于亚硝酸钠和食盐性状相似,曾多次发生过将NaNO2误当食盐食用的事件。要区别NaNO2和NaCl 两种固体,你需用的试剂是
II.实验测定
为了测定某样品中NaNO2的含量,某同学进行如下实验:
①称取样品ag,加水溶解,配制成100 mL 溶液。
②取25.00mL 溶液于锥形瓶中,用0.0200mol/LKMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液VmL。
(1)上述实验①所需玻璃仪器除玻璃棒、胶头滴管之外还有
(2)在进行滴定操作时,KMnO4溶液盛装在
(3) 滴定过程中发生反应的离子方程式是
(4)若滴定管未用KMnO4标准溶液润洗就直接注入,则测定结果
您最近一年使用:0次
名校
2 . 用现代分析仪器测定 粒子的大小。用氧化还原滴定法测定
粒子的大小。用氧化还原滴定法测定 的质量分数:一定条件下,将
的质量分数:一定条件下,将 溶解并还原为
溶解并还原为 ,再以KSCN溶液作指示剂,用
,再以KSCN溶液作指示剂,用 标准溶液滴定
标准溶液滴定 至全部生成
至全部生成 。
。
(1)滴定终点颜色变化为___________ 。
(2)滴定分析时,称取 (摩尔质量为Mg/mol)试样wg,消耗cmol/L
(摩尔质量为Mg/mol)试样wg,消耗cmol/L 标准溶液VmL,则
标准溶液VmL,则 质量分数表达式为
质量分数表达式为___________ 。
(3)下列操作对 质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的 溶液有少量溅出,使测定结果
溶液有少量溅出,使测定结果___________ 。
②若在滴定开始滴定管尖嘴处无气泡,滴定后滴定管尖嘴产生气泡,则测定结果___________ 。
 粒子的大小。用氧化还原滴定法测定
粒子的大小。用氧化还原滴定法测定 的质量分数:一定条件下,将
的质量分数:一定条件下,将 溶解并还原为
溶解并还原为 ,再以KSCN溶液作指示剂,用
,再以KSCN溶液作指示剂,用 标准溶液滴定
标准溶液滴定 至全部生成
至全部生成 。
。(1)滴定终点颜色变化为
(2)滴定分析时,称取
 (摩尔质量为Mg/mol)试样wg,消耗cmol/L
(摩尔质量为Mg/mol)试样wg,消耗cmol/L 标准溶液VmL,则
标准溶液VmL,则 质量分数表达式为
质量分数表达式为(3)下列操作对
 质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)①若在配制标准溶液过程中,烧杯中的
 溶液有少量溅出,使测定结果
溶液有少量溅出,使测定结果②若在滴定开始滴定管尖嘴处无气泡,滴定后滴定管尖嘴产生气泡,则测定结果
您最近一年使用:0次
2023-12-20更新
|
93次组卷
|
2卷引用:天津市第四十七中学2023-2024学年高二上学期12月月考化学试题
名校
3 . 滴定法是化学分析常用的方法,是一种简便、快速和应用广泛的定量分析方法。
I.某学生用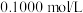 的盐酸来测定未知物质的量浓度的
的盐酸来测定未知物质的量浓度的 溶液时,选择甲基橙作指示剂。请填写下列空白:
溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的 溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到加入最后半滴盐酸后,溶液由
溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到加入最后半滴盐酸后,溶液由______ 色变为______ 色,且 不改变为止。
不改变为止。
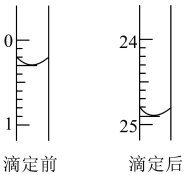
(2)有关数据记录如表:
第一次滴定前、后滴定管中液面的位置如图所示,则该次滴定所消耗盐酸标准溶液的体积为____  。
。
(3)根据所给数据,计算待测 溶液的物质的量浓度为
溶液的物质的量浓度为______  (小数点后保留四位数字)。
(小数点后保留四位数字)。
(4)下列操作中可能使所测 溶液的浓度偏高的是________(填字母);
溶液的浓度偏高的是________(填字母);
(5)用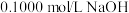 溶液分别滴定
溶液分别滴定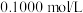 的盐酸和醋酸溶液各
的盐酸和醋酸溶液各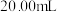 。滴定过程中溶液
。滴定过程中溶液 随滴入的
随滴入的 溶液体积变化的两条滴定曲线如图所示:
溶液体积变化的两条滴定曲线如图所示:
加入 溶液体积/
溶液体积/ 加入
加入 溶液体积/
溶液体积/
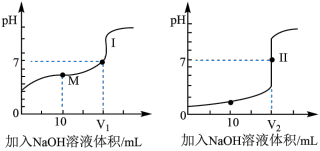
①滴定醋酸的曲线是_______ (填“I”或“Ⅱ”);
② 和
和 的关系:
的关系:
____  (填“>”、“=”或“<)。
(填“>”、“=”或“<)。
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______ 。
Ⅱ.某实验小组为了分析补血剂 中铁元素的质量分数,用
中铁元素的质量分数,用 标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是: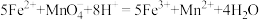
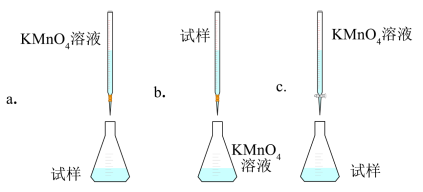
(6)某同学设计的下列滴定方式中,最合理的是_______ (填字母)。
Ⅲ.在化学分析中采用 为指示剂,以
为指示剂,以 标准溶液滴定溶液中的,利用
标准溶液滴定溶液中的,利用 与
与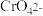 生成砖红色沉淀,指示到达滴定终点。
生成砖红色沉淀,指示到达滴定终点。
(7)当溶液中 恰好完全沉淀(浓度等于
恰好完全沉淀(浓度等于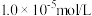 )时,溶液中
)时,溶液中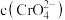 等于
等于_______  。(已知
。(已知 、
、 的
的 分别为
分别为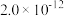 和
和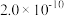 )
)
I.某学生用
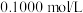 的盐酸来测定未知物质的量浓度的
的盐酸来测定未知物质的量浓度的 溶液时,选择甲基橙作指示剂。请填写下列空白:
溶液时,选择甲基橙作指示剂。请填写下列空白:(1)用标准的盐酸滴定待测的
 溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到加入最后半滴盐酸后,溶液由
溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到加入最后半滴盐酸后,溶液由 不改变为止。
不改变为止。(2)有关数据记录如表:
| 序号 | 待测样品溶液体积/ | 盐酸标准溶液体积/ | ||
| 滴定前的刻度 | 滴定后的刻度 | 消耗的体积 | ||
| 1 | 25.00 | |||
| 2 | 25.00 | 0.10 | 24.68 | 24.58 |
| 3 | 25.00 | 1.23 | 25.85 | 24.62 |
 。
。
(3)根据所给数据,计算待测
 溶液的物质的量浓度为
溶液的物质的量浓度为 (小数点后保留四位数字)。
(小数点后保留四位数字)。(4)下列操作中可能使所测
 溶液的浓度偏高的是________(填字母);
溶液的浓度偏高的是________(填字母);A.滴定前盛放 溶液的锥形瓶用蒸馏水洗净后没有干燥 溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| B.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| C.酸式滴定管在滴定前无气泡,滴定后出现气泡 |
| D.读取盐酸体积时,开始时俯视读数,滴定结束时仰视读数 |
(5)用
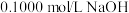 溶液分别滴定
溶液分别滴定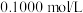 的盐酸和醋酸溶液各
的盐酸和醋酸溶液各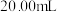 。滴定过程中溶液
。滴定过程中溶液 随滴入的
随滴入的 溶液体积变化的两条滴定曲线如图所示:
溶液体积变化的两条滴定曲线如图所示:
加入
 溶液体积/
溶液体积/ 加入
加入 溶液体积/
溶液体积/
①滴定醋酸的曲线是
②
 和
和 的关系:
的关系:
 (填“>”、“=”或“<)。
(填“>”、“=”或“<)。③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是
Ⅱ.某实验小组为了分析补血剂
 中铁元素的质量分数,用
中铁元素的质量分数,用 标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是: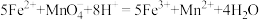
(6)某同学设计的下列滴定方式中,最合理的是

Ⅲ.在化学分析中采用
 为指示剂,以
为指示剂,以 标准溶液滴定溶液中的,利用
标准溶液滴定溶液中的,利用 与
与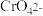 生成砖红色沉淀,指示到达滴定终点。
生成砖红色沉淀,指示到达滴定终点。(7)当溶液中
 恰好完全沉淀(浓度等于
恰好完全沉淀(浓度等于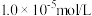 )时,溶液中
)时,溶液中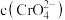 等于
等于 。(已知
。(已知 、
、 的
的 分别为
分别为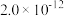 和
和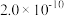 )
)
您最近一年使用:0次
名校
解题方法
4 . 化学是一门以实验为基础的学科。回答下列问题:
Ⅰ.中和反应反应热的测定。
测定50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液中和反应时放出的热量。
(1)采用稍过量的NaOH溶液的原因是_______ 。
(2)若两种溶液的密度均为 ,反应后生成溶液的比热容
,反应后生成溶液的比热容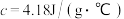 ,反应过程中测得体系温度升高4℃,则该反应放出
,反应过程中测得体系温度升高4℃,则该反应放出_______ kJ热量。
Ⅱ.简易原电池反应。
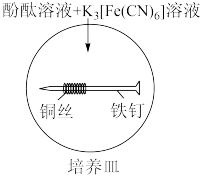
(3)培养皿内装有含NaCl饱和溶液的琼脂,再滴入5~6滴酚酞溶液和 溶液,混合均匀,铁钉用砂纸磨光,缠上铜丝放入培养皿中。一段时间后,可观察到没有缠铜丝的铁钉附近产生蓝色的
溶液,混合均匀,铁钉用砂纸磨光,缠上铜丝放入培养皿中。一段时间后,可观察到没有缠铜丝的铁钉附近产生蓝色的_______ (填化学式)沉淀;铜丝周围的现象是_______ ,发生的电极反应式为_______ 。
Ⅲ.已知某烧碱样品中含有NaCl杂质,为测定样品中NaOH的质量分数,进行如下步骤实验:
①称量1.0g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.10mol/L的盐酸标准溶液滴定三次,每次消耗盐酸的体积记录如下:
请回答:
(4)观察滴定到终点时溶液颜色的变化为_______ 。
(5)烧碱样品的纯度为_______ 。
(6)若出现下列情况,测定结果偏低的是_______ 。
a.滴定前用待测液冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.盛装标准液的滴定管水洗后未用标准液再润洗
Ⅰ.中和反应反应热的测定。
测定50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液中和反应时放出的热量。
(1)采用稍过量的NaOH溶液的原因是
(2)若两种溶液的密度均为
 ,反应后生成溶液的比热容
,反应后生成溶液的比热容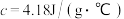 ,反应过程中测得体系温度升高4℃,则该反应放出
,反应过程中测得体系温度升高4℃,则该反应放出Ⅱ.简易原电池反应。

(3)培养皿内装有含NaCl饱和溶液的琼脂,再滴入5~6滴酚酞溶液和
 溶液,混合均匀,铁钉用砂纸磨光,缠上铜丝放入培养皿中。一段时间后,可观察到没有缠铜丝的铁钉附近产生蓝色的
溶液,混合均匀,铁钉用砂纸磨光,缠上铜丝放入培养皿中。一段时间后,可观察到没有缠铜丝的铁钉附近产生蓝色的Ⅲ.已知某烧碱样品中含有NaCl杂质,为测定样品中NaOH的质量分数,进行如下步骤实验:
①称量1.0g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.10mol/L的盐酸标准溶液滴定三次,每次消耗盐酸的体积记录如下:
| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 21.60 |
| 2 | 25.00 | 6.00 | 27.00 |
| 3 | 25.00 | 1.10 | 22.00 |
(4)观察滴定到终点时溶液颜色的变化为
(5)烧碱样品的纯度为
(6)若出现下列情况,测定结果偏低的是
a.滴定前用待测液冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.盛装标准液的滴定管水洗后未用标准液再润洗
您最近一年使用:0次
5 . 用中和滴定法测定某烧碱的纯度,试根据实验回答:
(1)称取4.1g烧碱样品。将样品配成 待测液,需要的主要玻璃仪器除烧杯、玻璃棒、胶头滴管外还需
待测液,需要的主要玻璃仪器除烧杯、玻璃棒、胶头滴管外还需_______ 。
(2)用_______ 量取10.00mL烧碱溶液。
(3)用0.2010mol/L标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,直到看到_______ 即可判断达到滴定终点。
(4)根据表中数据,计算样品烧碱的质量分数为_______ (结果保留四位有效数字。假设烧碱中不含有与酸反应的杂质)
(5)滴定过程,下列情况会使测定结果偏高的是_______ (填序号)。
①记录起始体积时,仰视读数,终点时俯视;
②碱式滴定管水洗后,就用来量取待测液;
③滴定前,酸式滴定管有气泡,滴定后消失;
④锥形瓶水洗后,又用待测液润洗。
(1)称取4.1g烧碱样品。将样品配成
 待测液,需要的主要玻璃仪器除烧杯、玻璃棒、胶头滴管外还需
待测液,需要的主要玻璃仪器除烧杯、玻璃棒、胶头滴管外还需(2)用
(3)用0.2010mol/L标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,直到看到
(4)根据表中数据,计算样品烧碱的质量分数为
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 |  |  |  |
| 第二次 |  |  |  |
①记录起始体积时,仰视读数,终点时俯视;
②碱式滴定管水洗后,就用来量取待测液;
③滴定前,酸式滴定管有气泡,滴定后消失;
④锥形瓶水洗后,又用待测液润洗。
您最近一年使用:0次
6 . I.某学生用0.1000 mol/L NaOH标准溶液测未知浓度的盐酸,其操作步骤如下:
A.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
B.用标准溶液润洗滴定管2~3次
C.调节液面至0或0以下刻度,记下读数
D.量取25.00mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴指示剂
E.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
F.取标准NaOH溶液注入碱式滴定管至0刻度以上2~3cm
(1)请为以上操作进行排序D___ ECA
(2)为便于观察,减少实验误差,你认为最好选择_______ 作为指示剂,判断到达滴定终点的实验现象是_______ 。
(3)盛NaOH标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用图中的_______ 操作。(填“甲”、“乙”、“丙”)。

(4)某学生进行3次实验得到相关数据如表所示。
①则盐酸的物质的量浓度为_______ 。
②在中和滴定的实验中,下列操作能使测定结果偏低的是_______ 。
A.滴定前碱式滴定管尖嘴中有气泡,滴定后气泡消失
B.标准液的读数开始时平视,终点读数时仰视
C.装待测液的锥形瓶没有用待测液润洗
D.装待测液的滴定管没有用待测液润洗
II.氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将4mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL 1.0×l0-4mol/L的KMnO4溶液。
(5)该滴定实验中,是否需要加入指示剂_______ (填写“是”或者“否”),计算血液中含钙离子的浓度为_______ 。
A.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
B.用标准溶液润洗滴定管2~3次
C.调节液面至0或0以下刻度,记下读数
D.量取25.00mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴指示剂
E.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
F.取标准NaOH溶液注入碱式滴定管至0刻度以上2~3cm
(1)请为以上操作进行排序D
(2)为便于观察,减少实验误差,你认为最好选择
(3)盛NaOH标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用图中的

(4)某学生进行3次实验得到相关数据如表所示。
| 滴定次数 | 待测盐酸的体积/mL | 消耗0.1000 mol/L NaOH溶液的体积/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 1.10 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 |
| 第三次 | 25.00 | 1.32 | 26.31 |
②在中和滴定的实验中,下列操作能使测定结果偏低的是
A.滴定前碱式滴定管尖嘴中有气泡,滴定后气泡消失
B.标准液的读数开始时平视,终点读数时仰视
C.装待测液的锥形瓶没有用待测液润洗
D.装待测液的滴定管没有用待测液润洗
II.氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将4mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL 1.0×l0-4mol/L的KMnO4溶液。
(5)该滴定实验中,是否需要加入指示剂
您最近一年使用:0次
名校
解题方法
7 . 某学生用0.1500 mol/L NaOH溶液测定某未知浓度的盐酸溶液,其操作可分解为如下几步:

A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸25.00 mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用序号字母填写):_______ 。_____→_______→F→_______→_______→_______→D。
(2)操作F中应该选择图中滴定管_______ (填标号)。
(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察_______ 。
(4)滴定结果如表所示:
计算该盐酸的物质的量浓度为_______ (精确至0.0001)。
(5)下列操作会导致测定结果偏高的是_______。
(6)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20 mL1.0×10-4 mol/L的KMnO4溶液。
写出用KMnO4滴定H2C2O4的离子方程式_______ 。判断滴定终点是_______ 。

A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸25.00 mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用序号字母填写):
(2)操作F中应该选择图中滴定管
(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察
(4)滴定结果如表所示:
| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 0.60 | 20.60 |
| 3 | 25.00 | 0.20 | 20.19 |
(5)下列操作会导致测定结果偏高的是_______。
| A.碱式滴定管在装液前未用标准NaOH溶液润洗 |
| B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出 |
| C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡 |
| D.达到滴定终点时,仰视读数 |
①可将2 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20 mL1.0×10-4 mol/L的KMnO4溶液。
写出用KMnO4滴定H2C2O4的离子方程式
您最近一年使用:0次
2022-11-10更新
|
256次组卷
|
2卷引用:天津市天津中学2022-2023学年高二上学期期中测试化学试题
8 . 某兴趣小组用铬铁矿[Fe(CrO2)2]制备K2Cr2O7晶体,流程如下:
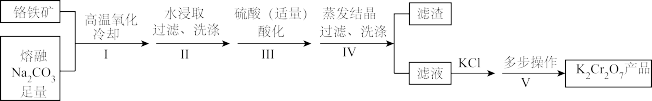
已知:4Fe (CrO2)2 + 10Na2CO3+7O2 8Na2CrO4 +4NaFeO2+10CO2
8Na2CrO4 +4NaFeO2+10CO2
2H++2CrO
 Cr2O
Cr2O +H2O
+H2O
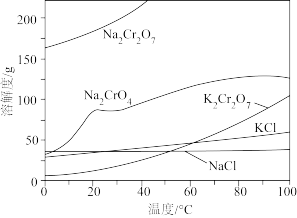
相关物质的溶解度随温度变化如下图。
请回答:
(1)步骤I,将铬铁矿粉碎有利于加快高温氧化的速率,其理由是______ 。
(2)下列说法正确的是______ 。
A.步骤II,低温可提高浸取率
B.步骤II,过滤可除去NaFeO2水解产生的Fe(OH)3
C.步骤III,酸化的目的主要是使Na2CrO4转变为Na2Cr2O7
D.步骤IV,所得滤渣的主要成分是Na2SO4和Na2CO3
(3)步骤V,重结晶前,为了得到杂质较少的K2Cr2O7粗产品,从下列选项中选出合理的操作(操作不能重复使用)并排序:溶解KCl →______ →______ →______ →______ →重结晶。
a.50℃蒸发溶剂;
b.100℃ 蒸发溶剂;
c.抽滤;
d.冷却至室温;
e.蒸发至溶液出现晶膜,停止加热;
f.蒸发至溶液中出现大量晶体,停止加热。
(4)为了测定K2Cr2O7产品的纯度,可采用氧化还原滴定法。
①下列关于滴定分析的操作,不正确的是______ 。
A.用量筒量取25.00mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
②在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,______ 继续摇动锥形瓶,观察颜色变化。(请在横线上补全操作)
(5)该小组用滴定法准确测得产品中K2Cr2O7的质量分数为98.50%。某同学还用分光光度法测定产品纯度(K2Cr2O7溶液的吸光度与其浓度成正比例),但测得的质量分数明显偏低。分析其原因,发现配制K2Cr2O7待测水溶液时少加了一种试剂。该试剂是______ ,添加该试剂的理由是______ 。
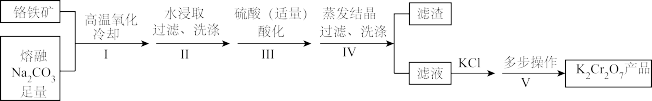
已知:4Fe (CrO2)2 + 10Na2CO3+7O2
 8Na2CrO4 +4NaFeO2+10CO2
8Na2CrO4 +4NaFeO2+10CO22H++2CrO

 Cr2O
Cr2O +H2O
+H2O相关物质的溶解度随温度变化如下图。

请回答:
(1)步骤I,将铬铁矿粉碎有利于加快高温氧化的速率,其理由是
(2)下列说法正确的是
A.步骤II,低温可提高浸取率
B.步骤II,过滤可除去NaFeO2水解产生的Fe(OH)3
C.步骤III,酸化的目的主要是使Na2CrO4转变为Na2Cr2O7
D.步骤IV,所得滤渣的主要成分是Na2SO4和Na2CO3
(3)步骤V,重结晶前,为了得到杂质较少的K2Cr2O7粗产品,从下列选项中选出合理的操作(操作不能重复使用)并排序:溶解KCl →
a.50℃蒸发溶剂;
b.100℃ 蒸发溶剂;
c.抽滤;
d.冷却至室温;
e.蒸发至溶液出现晶膜,停止加热;
f.蒸发至溶液中出现大量晶体,停止加热。
(4)为了测定K2Cr2O7产品的纯度,可采用氧化还原滴定法。
①下列关于滴定分析的操作,不正确的是
A.用量筒量取25.00mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
②在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,
(5)该小组用滴定法准确测得产品中K2Cr2O7的质量分数为98.50%。某同学还用分光光度法测定产品纯度(K2Cr2O7溶液的吸光度与其浓度成正比例),但测得的质量分数明显偏低。分析其原因,发现配制K2Cr2O7待测水溶液时少加了一种试剂。该试剂是
您最近一年使用:0次
2021-01-09更新
|
8401次组卷
|
16卷引用:天津市天津一中2020-2021学年高三第二学期五月月考化学试题
天津市天津一中2020-2021学年高三第二学期五月月考化学试题天津市咸水沽第一中学2023届高三上学期第一次模拟考试化学试题2021年1月新高考浙江化学高考真题(已下线)大题02 化学工艺流程题(二)-【考前抓大题】备战2021年高考化学(全国通用)(已下线)解密12 实验化学(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点31 化学实验与工艺流程-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考向09 工艺流程初探-备战2022年高考化学一轮复习考点微专题(已下线)专题21.化学工艺流程分析-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)2021年1月浙江高考化学试题变式题26-31(已下线)解密13 实验化学(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)微专题27 化学工艺流程题-----物质的分离与提纯-备战2023年高考化学一轮复习考点微专题浙江省金华市曙光学校2021-2022学年高三下学期5月模拟考试化学试题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
9 . I.用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液测定计算中和反应的反应热。回答下列问题:
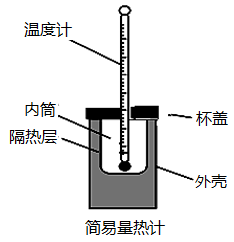
(1)从实验装置上看,图中缺少的一种玻璃用品是___________ 。
(2)如改用0.0275 mol NaOH固体与该盐酸进行实验,则实验中测得的“中和热”数值将___________ (填“偏大”、“偏小”或“无影响”)。
II.氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:(H2C2O4为弱酸)
①可将2 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20.00 mL l.0×l0﹣4 mol/L的KMnO4溶液。
(3)写出用KMnO4滴定H2C2O4的离子方程式___________ 。
(4)滴定时,将KMnO4溶液装在___________ (填“酸式”或“碱式”)滴定管中。
(5)判断滴定终点的方法是___________ 。
(6)误差分析:(填“偏高”、“偏低”或“无影响”)
①如果滴定管用蒸馏水洗后未用酸性KMnO4标准液润洗,则测量结果___________ 。
②滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则测量结果___________ 。
(7)计算:血液中含钙离子的浓度为___________ mol/L

(1)从实验装置上看,图中缺少的一种玻璃用品是
(2)如改用0.0275 mol NaOH固体与该盐酸进行实验,则实验中测得的“中和热”数值将
II.氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:(H2C2O4为弱酸)
①可将2 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20.00 mL l.0×l0﹣4 mol/L的KMnO4溶液。
(3)写出用KMnO4滴定H2C2O4的离子方程式
(4)滴定时,将KMnO4溶液装在
(5)判断滴定终点的方法是
(6)误差分析:(填“偏高”、“偏低”或“无影响”)
①如果滴定管用蒸馏水洗后未用酸性KMnO4标准液润洗,则测量结果
②滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则测量结果
(7)计算:血液中含钙离子的浓度为
您最近一年使用:0次
解题方法
10 . 某同学为测定烧碱样品(含有少量NaCl杂质)中NaOH的质量分数,进行如下实验操作:
a.将洁净的酸式滴定管和碱式滴定管分别用要盛装的酸、碱溶液润洗2遍
b.用碱式滴定管量取25.00 mL烧碱溶液于锥形瓶中,滴入2滴酚酞溶液
c.在天平上准确称取烧碱样品10.0 g,在烧杯中用蒸馏水溶解
d.将浓度为1.000 mol·L-1盐酸标准液装入酸式滴定管中,将烧碱溶液装入碱式滴定管中,并分别调节液面,记下开始时的读数
e.在锥形瓶下垫一张白纸,然后开始滴定,边滴加边振荡,至滴定终点,记下读数
f.在250 mL的容量瓶中定容,配制成250 mL烧碱溶液
请回答下列问题:
(1)正确操作步骤的顺序是(用字母填空)____ →____ →____ →d→b→____ 。
(2)下列仪器,实验中不需要的是(填序号)_________________
①托盘天平(带砝码,镊子) ②酸式滴定管 ③碱式滴定管 ④250 mL容量瓶
⑤烧杯 ⑥漏斗 ⑦锥形瓶 ⑧铁架台(带滴定管夹) ⑨药匙
实验中除上述仪器外,还缺少的仪器有(填名称)_______________________ 。
(3)滴定至终点,溶液由____ 色变为________ 色,且30秒内不褪色。
(4)重复四次的实验数据如下表所示:
根据以上数据,待测烧碱溶液物质的量浓度是_________ mol/L,该样品中NaOH的质量分数是__________ (精确到0.01%)。
(5)上述实验中,下列操作可能会造成结果偏高的是____________
A.f操作中,定容时俯视
B.滴定终点读数时仰视
C.使用前,碱式滴定管未用待装液润洗
D.锥形瓶水洗后未干燥就直接盛待测溶液
a.将洁净的酸式滴定管和碱式滴定管分别用要盛装的酸、碱溶液润洗2遍
b.用碱式滴定管量取25.00 mL烧碱溶液于锥形瓶中,滴入2滴酚酞溶液
c.在天平上准确称取烧碱样品10.0 g,在烧杯中用蒸馏水溶解
d.将浓度为1.000 mol·L-1盐酸标准液装入酸式滴定管中,将烧碱溶液装入碱式滴定管中,并分别调节液面,记下开始时的读数
e.在锥形瓶下垫一张白纸,然后开始滴定,边滴加边振荡,至滴定终点,记下读数
f.在250 mL的容量瓶中定容,配制成250 mL烧碱溶液
请回答下列问题:
(1)正确操作步骤的顺序是(用字母填空)
(2)下列仪器,实验中不需要的是(填序号)
①托盘天平(带砝码,镊子) ②酸式滴定管 ③碱式滴定管 ④250 mL容量瓶
⑤烧杯 ⑥漏斗 ⑦锥形瓶 ⑧铁架台(带滴定管夹) ⑨药匙
实验中除上述仪器外,还缺少的仪器有(填名称)
(3)滴定至终点,溶液由
(4)重复四次的实验数据如下表所示:
| 实验序号 | 盐酸溶液 /mol·L-1 | 滴定完成时消耗盐酸 溶液体积/mL | 待测烧碱溶液 体积/mL |
| 1 | 1.000 | 19.96 | 25.00 |
| 2 | 1.000 | 19.00 | 25.00 |
| 3 | 1.000 | 20.04 | 25.00 |
| 4 | 1.000 | 20.00 | 25.00 |
根据以上数据,待测烧碱溶液物质的量浓度是
(5)上述实验中,下列操作可能会造成结果偏高的是
A.f操作中,定容时俯视
B.滴定终点读数时仰视
C.使用前,碱式滴定管未用待装液润洗
D.锥形瓶水洗后未干燥就直接盛待测溶液
您最近一年使用:0次



