1 . 一定条件下,乙酸酐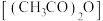 醇解反应
醇解反应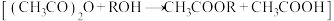 可进行完全,利用此反应定量测定有机醇
可进行完全,利用此反应定量测定有机醇 中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:
中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:
①配制一定浓度的乙酸酐-苯溶液。
②量取一定体积乙酸酐-苯溶液置于锥形瓶中,加入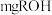 样品,充分反应后,加适量水使剩余乙酸酐完全水解:
样品,充分反应后,加适量水使剩余乙酸酐完全水解: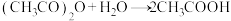 。
。
③加指示剂并用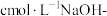 甲醇标准溶液滴定至终点,消耗标准溶液
甲醇标准溶液滴定至终点,消耗标准溶液 。
。
④在相同条件下,量取相同体积的乙酸酐-苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用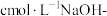 甲醇标准溶液滴定至终点,消耗标准溶液
甲醇标准溶液滴定至终点,消耗标准溶液 。
。 样品中羟基含量(质量分数)计算正确的是
样品中羟基含量(质量分数)计算正确的是
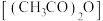 醇解反应
醇解反应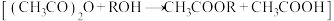 可进行完全,利用此反应定量测定有机醇
可进行完全,利用此反应定量测定有机醇 中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:
中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:①配制一定浓度的乙酸酐-苯溶液。
②量取一定体积乙酸酐-苯溶液置于锥形瓶中,加入
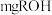 样品,充分反应后,加适量水使剩余乙酸酐完全水解:
样品,充分反应后,加适量水使剩余乙酸酐完全水解: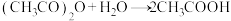 。
。③加指示剂并用
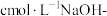 甲醇标准溶液滴定至终点,消耗标准溶液
甲醇标准溶液滴定至终点,消耗标准溶液 。
。④在相同条件下,量取相同体积的乙酸酐-苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用
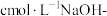 甲醇标准溶液滴定至终点,消耗标准溶液
甲醇标准溶液滴定至终点,消耗标准溶液 。
。 样品中羟基含量(质量分数)计算正确的是
样品中羟基含量(质量分数)计算正确的是A.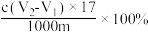 | B.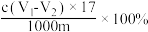 |
C.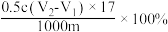 | D.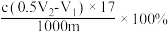 |
您最近一年使用:0次
2023-06-19更新
|
6579次组卷
|
8卷引用:陕西省西安市西北工业大学附属中学2023-2024学年高二上学期第一次月考化学试题
陕西省西安市西北工业大学附属中学2023-2024学年高二上学期第一次月考化学试题2023年高考山东卷化学真题(已下线)2023年高考山东卷化学真题变式题(选择题6-10)(已下线)专题11 化学实验(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题03 化学计量-2023年高考化学真题题源解密(全国通用)(已下线)考点46 定量分析实验(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)选择题11-14
名校
2 . 过氧化碳酰胺[CO(NH2)2•H2O2]是一种高效、安全的固体消毒剂,白色晶体,易溶于水,稍高温度时可发生分解。某化学小组欲制备少量过氧化碳酰胺,并测定其活性氧的含量,回答下列问题。
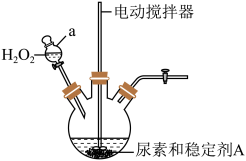
(一)过氧化碳酰胺的制备
(1)制备过氧化碳酰胺的发生装置如图所示(夹持装置略去),在组装仪器前应对a装置进行的操作是________ 。
(2)该反应的最佳温度为35℃,采用的合适加热方式为________ 。
(二)过氧化碳酰胺中活性氧含量的测定(以产品中过氧化氢所含氧原子的质量分数为准计算)。称取10.0g产品,配成250mL溶液,取25.00mL溶液于锥形瓶中,加入适量稀硫酸,用0.10mol•L-1高锰酸钾标准溶液滴定三次,消耗高锰酸钾溶液的体积分别为21.02mL、21.23mL、20.98mL。
(1)写出KMnO4标准溶液与H2O2反应的化学方程式____________ 。
(2)过氧化碳酰胺中活性氧含量为_____ %。若配制过氧化碳酰胺溶液定容时俯视刻度线,则测得过氧化碳酰胺中活性氧含量______ (填“偏高”“偏低”或“无影响”)。
(三)稳定剂A对过氧化碳酰胺的制备有一定的影响,小组成员查阅文献资料得到有关稳定剂及数据如表所示。则选择最佳稳定剂A为________ ,理由是_____________ 。

(一)过氧化碳酰胺的制备
(1)制备过氧化碳酰胺的发生装置如图所示(夹持装置略去),在组装仪器前应对a装置进行的操作是
(2)该反应的最佳温度为35℃,采用的合适加热方式为
(二)过氧化碳酰胺中活性氧含量的测定(以产品中过氧化氢所含氧原子的质量分数为准计算)。称取10.0g产品,配成250mL溶液,取25.00mL溶液于锥形瓶中,加入适量稀硫酸,用0.10mol•L-1高锰酸钾标准溶液滴定三次,消耗高锰酸钾溶液的体积分别为21.02mL、21.23mL、20.98mL。
(1)写出KMnO4标准溶液与H2O2反应的化学方程式
(2)过氧化碳酰胺中活性氧含量为
(三)稳定剂A对过氧化碳酰胺的制备有一定的影响,小组成员查阅文献资料得到有关稳定剂及数据如表所示。则选择最佳稳定剂A为
| 稳定剂名称 | 过氧化碳酰胺活性氧的含量/10-2 | ||||
| 初始数 | 室温储存30天后数 | 减少量 | 热储存保温1天后数 | 减少量 | |
| EDTA | 16.96 | 16.87 | 0.09 | 16.92 | 0.04 |
| 柠檬酸 | 16.94 | 16.90 | 0.04 | 16.91 | 0.03 |
| EDTA与柠檬酸混合物 | 16.95 | 16.90 | 0.05 | 16.90 | 0.05 |
| 柠檬酸与焦磷酸钠混合物 | 16.90 | 16.86 | 0.04 | 16.87 | 0.03 |
您最近一年使用:0次
2020-06-22更新
|
304次组卷
|
2卷引用:陕西省西北工业大学附属中学2022-2023学年高二上学期1月期末考试化学试题
名校
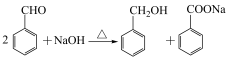
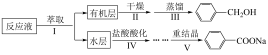
3 . 苯甲醇与苯甲酸是重要的化工原料,可通过苯甲醛在氢氧化钠水溶液中的歧化反应制得,某研究小组在实验室制备苯甲醇与苯甲酸,并测定苯甲酸的纯度。
I.制备反应原理及反应结束后对反应液的处理步骤如下:
溴酚蓝:是一种pH指示剂,变色范围为pH=3.0(黄)~4.6(蓝);易溶于氢氧化钠溶液,溶于甲醇、乙醇和苯,微溶于水。
(1)关于制备、提纯过程下列说法正确的是_____。
(2)该小组拟用如图装置进行步骤Ⅲ,装置a应选用_____ (填字母代号),选择减压蒸馏的理由是_____ 。
Ⅱ.苯甲酸的纯度测定:
(3)为精确测定产品纯度,拟用以下实验方案:称取mg苯甲酸样品,溶于V1mL浓度为0.5 的氢氧化钠溶液中,加入1滴酚酞指示剂,用0.5
的氢氧化钠溶液中,加入1滴酚酞指示剂,用0.5 盐酸调至酚酞红色消失。加入适量乙醚、溴酚蓝指示剂,摇匀,用0.5
盐酸调至酚酞红色消失。加入适量乙醚、溴酚蓝指示剂,摇匀,用0.5 盐酸滴定,边滴定边将水层和乙醚层充分摇匀,达到滴定终点,记录耗酸体积。做3组平行实验,所消耗盐酸的平均体积为V2mL;
盐酸滴定,边滴定边将水层和乙醚层充分摇匀,达到滴定终点,记录耗酸体积。做3组平行实验,所消耗盐酸的平均体积为V2mL;
①“用0.5 盐酸调至酚酞红色消失”这一操作的作用是
盐酸调至酚酞红色消失”这一操作的作用是_____ 。
②滴定终点现象是_____ ;
③产品的纯度是_____ (以质量分数表示)。
I.制备反应原理及反应结束后对反应液的处理步骤如下:
| 名称 | 相对分子质量 | 熔点℃ | 沸点℃ | 溶解性 | 其他 |
| 苯甲醇 | 108 |  15.3 15.3 | 205.7 | 在水中溶解度较小,易溶于乙醚、乙醇 | 该品可燃,有毒,具刺激性 |
| 苯甲酸 | 122 | 122.4(100℃左右开始升华) | 248 | 微溶于冷水,易溶于乙醇、热水 | 毒性较小,引起皮肤刺 |

(1)关于制备、提纯过程下列说法正确的是_____。
| A.步骤I:可用乙醚作为萃取剂 |
| B.步骤Ⅳ:具体操作为热水溶解、加入活性炭脱色、冷却结晶 |
| C.步骤V:产品宜用冷水洗涤 |
| D.步骤V:产品可用酒精灯、沸水浴加热烘干 |
(2)该小组拟用如图装置进行步骤Ⅲ,装置a应选用
Ⅱ.苯甲酸的纯度测定:
(3)为精确测定产品纯度,拟用以下实验方案:称取mg苯甲酸样品,溶于V1mL浓度为0.5
 的氢氧化钠溶液中,加入1滴酚酞指示剂,用0.5
的氢氧化钠溶液中,加入1滴酚酞指示剂,用0.5 盐酸调至酚酞红色消失。加入适量乙醚、溴酚蓝指示剂,摇匀,用0.5
盐酸调至酚酞红色消失。加入适量乙醚、溴酚蓝指示剂,摇匀,用0.5 盐酸滴定,边滴定边将水层和乙醚层充分摇匀,达到滴定终点,记录耗酸体积。做3组平行实验,所消耗盐酸的平均体积为V2mL;
盐酸滴定,边滴定边将水层和乙醚层充分摇匀,达到滴定终点,记录耗酸体积。做3组平行实验,所消耗盐酸的平均体积为V2mL;①“用0.5
 盐酸调至酚酞红色消失”这一操作的作用是
盐酸调至酚酞红色消失”这一操作的作用是②滴定终点现象是
③产品的纯度是
您最近一年使用:0次
2024-04-03更新
|
422次组卷
|
2卷引用:陕西省宝鸡实验高级中学2023-2024学年高三上学期12月联考理科综合试题
名校
解题方法
4 . Ⅰ.某同学欲用0.10000 的标准盐酸测定未知浓度的氢氧化钠溶液,选择酚酞作指示剂。其操作步骤可分为以下几步:
的标准盐酸测定未知浓度的氢氧化钠溶液,选择酚酞作指示剂。其操作步骤可分为以下几步:
A.移取20.00mL待测氢氧化钠溶液注入洁净的锥形瓶中,并滴加2~3滴酚酞溶液。
B.用标准溶液润洗滴定管2~3次。
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液。
D.取标准溶液注入酸式滴定管至“0”刻度以上2~3cm处。
E.调节液面至“0”或“0”以下刻度,记下读数。
F.把锥形瓶放在滴定管的下面,用标准溶液滴定至终点,并记下滴定管液面的刻度。请填写下列空白:
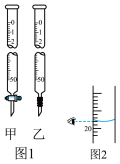
(1)正确的操作步骤顺序是______ (用字母表示)。
(2)步骤B中应选择图1中的滴定管______ (填“甲”或“乙”),该步操作的目的是______ 。
(3)若某次滴定结束时,酸式滴定管中的液面如图2所示,则读数为______ mL。若仰视,会使读数偏______ (填“大”或“小”)。
(4)结合下表数据,计算被测氢氧化钠溶液的物质的量浓度为______  (保留两位有效数字)。
(保留两位有效数字)。
Ⅱ.氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。硫代硫酸钠( )又称大苏打,可用作定影剂、还原剂。现有某种硫代硫酸钠样品,为了测定该样品纯度,某兴趣小组设计如下实验方案,回答下列问题:
)又称大苏打,可用作定影剂、还原剂。现有某种硫代硫酸钠样品,为了测定该样品纯度,某兴趣小组设计如下实验方案,回答下列问题:
(5)现在称取10.00g硫代硫酸钠固体样品,配成100mL溶液;
滴定:取0.10 的
的 (硫酸酸化)标准溶液20.00mL,加入过量KI,发生反应:
(硫酸酸化)标准溶液20.00mL,加入过量KI,发生反应: ,然后加入
,然后加入______ 溶液作为指示剂,用硫代硫酸钠样品溶液滴定至终点,发生反应: ,到达滴定终点时的现象为
,到达滴定终点时的现象为______ 。重复实验2-3次,平均消耗 样品溶液的体积为20.0mL。
样品溶液的体积为20.0mL。
(6)样品纯度的计算:根据上述有关数据,该样品中 的质量分数为
的质量分数为______ 。
 的标准盐酸测定未知浓度的氢氧化钠溶液,选择酚酞作指示剂。其操作步骤可分为以下几步:
的标准盐酸测定未知浓度的氢氧化钠溶液,选择酚酞作指示剂。其操作步骤可分为以下几步:A.移取20.00mL待测氢氧化钠溶液注入洁净的锥形瓶中,并滴加2~3滴酚酞溶液。
B.用标准溶液润洗滴定管2~3次。
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液。
D.取标准溶液注入酸式滴定管至“0”刻度以上2~3cm处。
E.调节液面至“0”或“0”以下刻度,记下读数。
F.把锥形瓶放在滴定管的下面,用标准溶液滴定至终点,并记下滴定管液面的刻度。请填写下列空白:

(1)正确的操作步骤顺序是
(2)步骤B中应选择图1中的滴定管
(3)若某次滴定结束时,酸式滴定管中的液面如图2所示,则读数为
(4)结合下表数据,计算被测氢氧化钠溶液的物质的量浓度为
 (保留两位有效数字)。
(保留两位有效数字)。| 滴定次数 | 待测溶液体积/mL | 标准盐酸体积 | |
| 滴定前的刻度/mL | 滴定后的刻度/mL | ||
| 第一次 | 20.00 | 2.34 | 20.39 |
| 第二次 | 20.00 | 3.20 | 20.30 |
| 第三次 | 20.00 | 0.60 | 17.50 |
Ⅱ.氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。硫代硫酸钠(
 )又称大苏打,可用作定影剂、还原剂。现有某种硫代硫酸钠样品,为了测定该样品纯度,某兴趣小组设计如下实验方案,回答下列问题:
)又称大苏打,可用作定影剂、还原剂。现有某种硫代硫酸钠样品,为了测定该样品纯度,某兴趣小组设计如下实验方案,回答下列问题:(5)现在称取10.00g硫代硫酸钠固体样品,配成100mL溶液;
滴定:取0.10
 的
的 (硫酸酸化)标准溶液20.00mL,加入过量KI,发生反应:
(硫酸酸化)标准溶液20.00mL,加入过量KI,发生反应: ,然后加入
,然后加入 ,到达滴定终点时的现象为
,到达滴定终点时的现象为 样品溶液的体积为20.0mL。
样品溶液的体积为20.0mL。(6)样品纯度的计算:根据上述有关数据,该样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
名校
5 . 滴定实验是化学学科中重要的定量实验。
Ⅰ.酸碱中和滴定——已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
①称量1.00g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴甲基橙指示剂;
④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
(1)该酸碱中和滴定(题干中②③④步)所需仪器有___________ (填字母)。
A.酸式滴定管(50mL) B.碱式滴定管(50mL) C.量筒(10mL) D.铁架台 E.滴定管夹 F.玻璃棒
(2)排去碱式滴定管中气泡的方法应采用操作___________ 。

(3)滴定达到终点的现象是___________ 。
(4)试样中NaOH的质量分数为___________ 。
(5)若出现下列情况,测定结果偏高的是___________ 。
a.滴定前用蒸馏水冲洗锥形瓶
b.酸式滴定管滴至终点时,俯视读数
c.酸式滴定管用蒸馏水洗后,未用标准液润洗
d.酸式滴定管尖嘴部分有气泡,滴定后消失
Ⅱ.氧化还原滴定—取草酸(H2C2O4,弱酸)溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定。
(6)发生反应的离子方程式为:___________ 。
(7)滴定时,KMnO4溶液应装在酸式滴定管中,滴定终点时锥形瓶内的颜色变化为:由___________ 变为___________ 。
Ⅰ.酸碱中和滴定——已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
①称量1.00g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴甲基橙指示剂;
④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
| 滴定序号 | 待测液体积(mL) | 消耗盐酸标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
A.酸式滴定管(50mL) B.碱式滴定管(50mL) C.量筒(10mL) D.铁架台 E.滴定管夹 F.玻璃棒
(2)排去碱式滴定管中气泡的方法应采用操作

(3)滴定达到终点的现象是
(4)试样中NaOH的质量分数为
(5)若出现下列情况,测定结果偏高的是
a.滴定前用蒸馏水冲洗锥形瓶
b.酸式滴定管滴至终点时,俯视读数
c.酸式滴定管用蒸馏水洗后,未用标准液润洗
d.酸式滴定管尖嘴部分有气泡,滴定后消失
Ⅱ.氧化还原滴定—取草酸(H2C2O4,弱酸)溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定。
(6)发生反应的离子方程式为:
(7)滴定时,KMnO4溶液应装在酸式滴定管中,滴定终点时锥形瓶内的颜色变化为:由
您最近一年使用:0次
2023-06-07更新
|
711次组卷
|
5卷引用:陕西西安市第八十三中学2023-2024学年高二上学期10月月考化学试题
名校
解题方法
6 . 高锰酸钾生产过程中产生的废锰渣(主要成分为MnO2、KOH、MgO和Fe2O3)可用于制备MnSO4晶体,工艺流程如图:

该工艺条件下金属离子开始沉淀和完全沉淀的pH如表所示:
回答以下问题:
(1)提高“反应Ⅰ”速率可采取的措施是_______ (除“加热”外,任写一种),滤渣A的主要成分为_______ (填化学式)。
(2)“反应Ⅱ”中硫铁矿(FeS2)的作用为______ 。
(3)“反应Ⅲ”的离子方程式为______ 。
(4)“调pH”步骤中,应调节pH不低于_______ 。
(5)取0.1510gMnSO4固体,溶于适量水中,加硫酸酸化,用过量NaBiO3(难溶于水)将其完全氧化为MnO ,过滤,洗涤,洗涤液并入滤液后,加入0.5360gNa2C2O4固体,充分反应后,用0.0320mol•L-1KMnO4溶液滴定,用去20.00mL,计算样品中MnSO4的质量分数
,过滤,洗涤,洗涤液并入滤液后,加入0.5360gNa2C2O4固体,充分反应后,用0.0320mol•L-1KMnO4溶液滴定,用去20.00mL,计算样品中MnSO4的质量分数________ (保留三位有效数字)。

该工艺条件下金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Fe3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀pH | 2.10 | 7.45 | 9.27 | 9.60 |
| 完全沉淀pH | 3.20 | 8.95 | 10.87 | 11.13 |
(1)提高“反应Ⅰ”速率可采取的措施是
(2)“反应Ⅱ”中硫铁矿(FeS2)的作用为
(3)“反应Ⅲ”的离子方程式为
(4)“调pH”步骤中,应调节pH不低于
(5)取0.1510gMnSO4固体,溶于适量水中,加硫酸酸化,用过量NaBiO3(难溶于水)将其完全氧化为MnO
 ,过滤,洗涤,洗涤液并入滤液后,加入0.5360gNa2C2O4固体,充分反应后,用0.0320mol•L-1KMnO4溶液滴定,用去20.00mL,计算样品中MnSO4的质量分数
,过滤,洗涤,洗涤液并入滤液后,加入0.5360gNa2C2O4固体,充分反应后,用0.0320mol•L-1KMnO4溶液滴定,用去20.00mL,计算样品中MnSO4的质量分数
您最近一年使用:0次
2023-06-28更新
|
88次组卷
|
2卷引用:陕西省西安市长安区第一中学2022-2023学年高二下学期第二次质量检测化学试题
7 . 重铬酸铵[(NH4)2Cr2O7 ]可用作媒染剂和有机合成催化剂,具有强氧化性。实验室将NH3通入重铬酸(H2Cr2O7)溶液中制备[(NH4)2Cr2O7 ],的装置如图所示(夹持装置略)。回答下列问题:
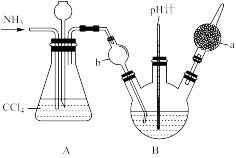
已知: (橙色)+ H2O
(橙色)+ H2O 2
2 (黄色)+2H+。
(黄色)+2H+。
(1)仪器a的名称是_______ , b处的作用为_______ ;实验时控制三颈烧瓶内溶液pH约为4,pH不宜过大的原因是_______ ;A 装置的作用为_______ 。
(2)在试管中加入少量(NH4)2Cr2O7固体,加水溶解,再滴加足量KOH浓溶液,振荡,微热,观察到的主要现象是_______ 。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的产品中(NH4)2Cr2O7的质量分数,其反应原理为2Ba2+ + +H2O=2BaCrO4 +2H+、4
+H2O=2BaCrO4 +2H+、4 +6HCHO=(CH2)6N4H+ +6H2O+ 3H+,然后用NaOH标准溶液滴定反应生成的酸。实验步骤:
+6HCHO=(CH2)6N4H+ +6H2O+ 3H+,然后用NaOH标准溶液滴定反应生成的酸。实验步骤:
Ⅰ.称取样品12. 00 g,配成250 mL溶液。
Ⅱ.量取25.00mL样品溶液,用氯化钡溶液使 完全沉淀后,加入足量的20%中性甲醛溶液,摇匀,静置5 min。
完全沉淀后,加入足量的20%中性甲醛溶液,摇匀,静置5 min。
Ⅲ.以酚酞作指示剂,用1. 00 mol·L-1的NaOH标准溶液滴定,记录数据。
Ⅳ.重复步骤Ⅱ、Ⅲ2~3次,处理数据。
①滴定终点的颜色变化为_______ 。
②用_______ (填“酸式”或“碱式”)滴定 管量取25.00 mL样品溶液于 250 mL锥形瓶中。
③与NaOH反应时,1 mol(CH2)6N4H+与1 mol H+相当,步骤III中(CH2)6N4H+与NaOH发生反应的离子方程式是_______ 。
④若实验平均消耗NaOH溶液的体积为16.00mL,则所得产物中(NH4)2Cr2O7 (摩尔质量为252 g·mol-1)的质量分数为_______ %。
⑤若滴定终点时仰视读数,则测定的质量分数将_______ (填“偏大”、“偏小”或“不变”)。
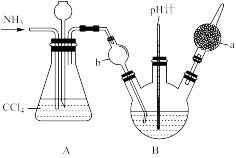
已知:
 (橙色)+ H2O
(橙色)+ H2O 2
2 (黄色)+2H+。
(黄色)+2H+。(1)仪器a的名称是
(2)在试管中加入少量(NH4)2Cr2O7固体,加水溶解,再滴加足量KOH浓溶液,振荡,微热,观察到的主要现象是
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的产品中(NH4)2Cr2O7的质量分数,其反应原理为2Ba2+ +
 +H2O=2BaCrO4 +2H+、4
+H2O=2BaCrO4 +2H+、4 +6HCHO=(CH2)6N4H+ +6H2O+ 3H+,然后用NaOH标准溶液滴定反应生成的酸。实验步骤:
+6HCHO=(CH2)6N4H+ +6H2O+ 3H+,然后用NaOH标准溶液滴定反应生成的酸。实验步骤: Ⅰ.称取样品12. 00 g,配成250 mL溶液。
Ⅱ.量取25.00mL样品溶液,用氯化钡溶液使
 完全沉淀后,加入足量的20%中性甲醛溶液,摇匀,静置5 min。
完全沉淀后,加入足量的20%中性甲醛溶液,摇匀,静置5 min。Ⅲ.以酚酞作指示剂,用1. 00 mol·L-1的NaOH标准溶液滴定,记录数据。
Ⅳ.重复步骤Ⅱ、Ⅲ2~3次,处理数据。
①滴定终点的颜色变化为
②用
③与NaOH反应时,1 mol(CH2)6N4H+与1 mol H+相当,步骤III中(CH2)6N4H+与NaOH发生反应的离子方程式是
④若实验平均消耗NaOH溶液的体积为16.00mL,则所得产物中(NH4)2Cr2O7 (摩尔质量为252 g·mol-1)的质量分数为
⑤若滴定终点时仰视读数,则测定的质量分数将
您最近一年使用:0次
8 . 锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃; 易水解、易被氧化;
易水解、易被氧化; 极易水解、熔点为-33℃、沸点为114℃。请按要求回答下列相关问题:
极易水解、熔点为-33℃、沸点为114℃。请按要求回答下列相关问题:
(1)用于镀锡工业的硫酸亚锡(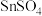 )的制备步骤如下:
)的制备步骤如下:
Ⅰ. 加入盐酸和Sn粉;
加入盐酸和Sn粉;
Ⅱ. 分离滤渣和滤液;
Ⅲ. 滤液用 调节pH至
调节pH至 得混合物(含不溶物SnO);
得混合物(含不溶物SnO);
Ⅳ. 从混合物中分离得SnO;
Ⅴ.SnO和稀硫酸反应,经一系列操作后,最终得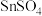 晶体。
晶体。
①步骤Ⅰ加入Sn粉的作用:_______ 及调节溶液pH。
②步骤Ⅲ生成SnO的离子方程式:_______ 。
③步骤Ⅳ中检验SnO是否洗涤干净的操作是_______ ,证明已洗净。
④步骤Ⅴ操作依次为_______ 、_______ 、过滤、洗涤、低温干燥。
(2) 蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为
蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为_______ 。实验室欲用下图装置制备少量 (夹持装置略),该装置存在明显缺陷,改进方法是
(夹持装置略),该装置存在明显缺陷,改进方法是_______ 。

(3)利用改进后的装置进行实验,当开始装置C中收集到有 时即可熄灭B处酒精灯,反应仍可持续进行的理由是
时即可熄灭B处酒精灯,反应仍可持续进行的理由是_______ 。
(4)用于微电子器件生产的锡粉纯度测定:
①取1.19g试样溶于较浓硫酸中(杂质不参与反应),使Sn完全转化为 ;
;
②加入过量的 ;
;
③用 溶液滴定,消耗20.00mL。步骤②中加入
溶液滴定,消耗20.00mL。步骤②中加入 的作用是:
的作用是:_______ ;此锡粉样品中锡的质量分数:_______ 。
 易水解、易被氧化;
易水解、易被氧化; 极易水解、熔点为-33℃、沸点为114℃。请按要求回答下列相关问题:
极易水解、熔点为-33℃、沸点为114℃。请按要求回答下列相关问题:(1)用于镀锡工业的硫酸亚锡(
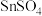 )的制备步骤如下:
)的制备步骤如下:Ⅰ.
 加入盐酸和Sn粉;
加入盐酸和Sn粉;Ⅱ. 分离滤渣和滤液;
Ⅲ. 滤液用
 调节pH至
调节pH至 得混合物(含不溶物SnO);
得混合物(含不溶物SnO);Ⅳ. 从混合物中分离得SnO;
Ⅴ.SnO和稀硫酸反应,经一系列操作后,最终得
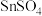 晶体。
晶体。①步骤Ⅰ加入Sn粉的作用:
②步骤Ⅲ生成SnO的离子方程式:
③步骤Ⅳ中检验SnO是否洗涤干净的操作是
④步骤Ⅴ操作依次为
(2)
 蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为
蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为 (夹持装置略),该装置存在明显缺陷,改进方法是
(夹持装置略),该装置存在明显缺陷,改进方法是
(3)利用改进后的装置进行实验,当开始装置C中收集到有
 时即可熄灭B处酒精灯,反应仍可持续进行的理由是
时即可熄灭B处酒精灯,反应仍可持续进行的理由是(4)用于微电子器件生产的锡粉纯度测定:
①取1.19g试样溶于较浓硫酸中(杂质不参与反应),使Sn完全转化为
 ;
;②加入过量的
 ;
;③用
 溶液滴定,消耗20.00mL。步骤②中加入
溶液滴定,消耗20.00mL。步骤②中加入 的作用是:
的作用是:
您最近一年使用:0次
9 . (I)测定某品牌洁厕灵的酸(盐酸)含量,某学生欲用已知物质的量浓度的 溶液来测定该洁厕灵中酸(盐酸)的物质的量浓度,并选择酚酞作指示剂,完成实验并填空。
溶液来测定该洁厕灵中酸(盐酸)的物质的量浓度,并选择酚酞作指示剂,完成实验并填空。
实验步骤如下:
A.取 待测洁厕灵溶液注入洁净的锥形瓶中,并加入2~3滴指示剂;
待测洁厕灵溶液注入洁净的锥形瓶中,并加入2~3滴指示剂;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准 溶液注入碱式滴定管至刻度“0”以上1~2cm处;
溶液注入碱式滴定管至刻度“0”以上1~2cm处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,瓶下垫一张白纸,用标准 溶液滴定至终点并记下滴定管液面的刻度。
溶液滴定至终点并记下滴定管液面的刻度。
(1)正确操作步骤的顺序是___________  (填字母)。
(填字母)。
(2)下列操作会导致实验结果偏低的是___________(填字母)。
(II)某化学探究学习小组拟研究草酸晶体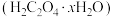 的组成和性质。为了测定
的组成和性质。为了测定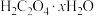 中x的值,该学习小组设计了如下实验:
中x的值,该学习小组设计了如下实验:
实验步骤:
①称取1.260g纯草酸晶体,将其配成100.00mL溶液作为待测液;
②取25.00mL待测液装入锥形瓶中,再加入适量的稀硫酸;
③用浓度为 的酸性标准溶液进行三次滴定,达到终点时消耗标准溶液的体积见下表(其中第1组的起始刻度a的读数如图)。
的酸性标准溶液进行三次滴定,达到终点时消耗标准溶液的体积见下表(其中第1组的起始刻度a的读数如图)。

请回答下列问题:
(3)滴定时,将酸性 标准溶液装在
标准溶液装在___________ (填“甲”或“乙”)滴定管中,起始读数
___________ 。

(4)写出草酸与酸性高锰酸钾溶液反应的离子方程式:___________ 。
(5)本实验达到滴定终点的标志是___________ 。
(6)处理数据时计算得x=___________ 。
 溶液来测定该洁厕灵中酸(盐酸)的物质的量浓度,并选择酚酞作指示剂,完成实验并填空。
溶液来测定该洁厕灵中酸(盐酸)的物质的量浓度,并选择酚酞作指示剂,完成实验并填空。实验步骤如下:
A.取
 待测洁厕灵溶液注入洁净的锥形瓶中,并加入2~3滴指示剂;
待测洁厕灵溶液注入洁净的锥形瓶中,并加入2~3滴指示剂;B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准
 溶液注入碱式滴定管至刻度“0”以上1~2cm处;
溶液注入碱式滴定管至刻度“0”以上1~2cm处;E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,瓶下垫一张白纸,用标准
 溶液滴定至终点并记下滴定管液面的刻度。
溶液滴定至终点并记下滴定管液面的刻度。(1)正确操作步骤的顺序是
 (填字母)。
(填字母)。(2)下列操作会导致实验结果偏低的是___________(填字母)。
A.碱式滴定管用蒸馏水洗涤后未用 标准溶液润洗 标准溶液润洗 |
| B.锥形瓶用蒸馏水洗过后未干燥 |
| C.达到滴定终点时,俯视读数 |
| D.滴定过程中锥形瓶中有少量待测溶液溅出 |
(II)某化学探究学习小组拟研究草酸晶体
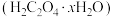 的组成和性质。为了测定
的组成和性质。为了测定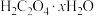 中x的值,该学习小组设计了如下实验:
中x的值,该学习小组设计了如下实验:实验步骤:
①称取1.260g纯草酸晶体,将其配成100.00mL溶液作为待测液;
②取25.00mL待测液装入锥形瓶中,再加入适量的稀硫酸;
③用浓度为
 的酸性标准溶液进行三次滴定,达到终点时消耗标准溶液的体积见下表(其中第1组的起始刻度a的读数如图)。
的酸性标准溶液进行三次滴定,达到终点时消耗标准溶液的体积见下表(其中第1组的起始刻度a的读数如图)。
| 编号 |  的酸性 的酸性 标准溶液 标准溶液 | |
| 起始刻度/mL | 终点刻度/mL | |
| 1 | a | 10.80 |
| 2 | 7.10 | 17.00 |
| 3 | 4.50 | 14.50 |
(3)滴定时,将酸性
 标准溶液装在
标准溶液装在

(4)写出草酸与酸性高锰酸钾溶液反应的离子方程式:
(5)本实验达到滴定终点的标志是
(6)处理数据时计算得x=
您最近一年使用:0次
名校
解题方法
10 . 食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于0.035g/mL,实验室用标准NaOH溶液测定食醋中醋酸的浓度,以检测食醋是否符合国家标准,某品牌白醋的醋酸浓度测定过程如图所示,请回答:
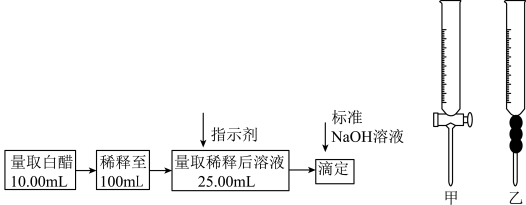
(1)选用上述___________ (填“甲”或“乙”)滴定管量取10.00mL白醋后,将白醋稀释至100mL时,需要使用的玻璃仪器有烧杯、玻璃棒和___________ 。
(2)某同学用酸碱中和滴定法测定该品牌白醋的醋酸浓度,当醋酸与氢氧化钠恰好完全反应时,测得溶液中 ,则此时溶液中的pH=
,则此时溶液中的pH=___________ 。(已知:室温下醋酸的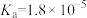 )
)
(3)根据该同学的计算结果,应该选___________ 作指示剂。(填“酚酞”、“甲基橙”或“石蕊”)
(4)该滴定达到终点时的现象是___________ 。
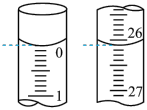
(5)某次实验滴定开始和结束时,碱式滴定管中的液面如下图所示,则所用NaOH溶液的体积为___________ mL。
(6)用标准的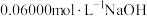 溶液滴定上述稀释后的醋酸溶液,滴定结果如下表所示:
溶液滴定上述稀释后的醋酸溶液,滴定结果如下表所示:
则该品牌白醋中醋酸含量为___________ mg/mL。
(7)下列操作中,可能使所测白醋中醋酸的浓度数值偏高的是___________。(填编号)。
(8)有一支50mL的酸式滴定管,其中盛有溶液,液面恰好在10.00mL刻度处,现把管内液体全部放出,用量筒接收,得到溶液的体积是___________。

(1)选用上述
(2)某同学用酸碱中和滴定法测定该品牌白醋的醋酸浓度,当醋酸与氢氧化钠恰好完全反应时,测得溶液中
 ,则此时溶液中的pH=
,则此时溶液中的pH=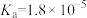 )
)(3)根据该同学的计算结果,应该选
(4)该滴定达到终点时的现象是
(5)某次实验滴定开始和结束时,碱式滴定管中的液面如下图所示,则所用NaOH溶液的体积为

(6)用标准的
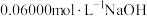 溶液滴定上述稀释后的醋酸溶液,滴定结果如下表所示:
溶液滴定上述稀释后的醋酸溶液,滴定结果如下表所示:| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00mL | 0.02 | 25.01 |
| 2 | 25.00mL | 0.70 | 25.71 |
| 3 | 25.00mL | 0.50 | 24.2 |
(7)下列操作中,可能使所测白醋中醋酸的浓度数值偏高的是___________。(填编号)。
| A.取待测液的滴管,取液前滴定管尖嘴处无气泡,取液后尖嘴处出现气泡 |
| B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液 |
| D.读取NaOH溶液体积时,开始时俯视读数,滴定结束时仰视读数 |
| A.等于10mL | B.等于40mL | C.大于40mL | D.不能确定 |
您最近一年使用:0次
2023-04-21更新
|
206次组卷
|
2卷引用:陕西省西安市长安区第一中学2023-2024学年高二上学期第一次月考化学试题



