1 . 硼氢化钠(NaBH4)是合成中常用的还原剂。采用NaBO2为主要原料制备NaBH4(B元素化合价为+3)的反应为NaBO2+SiO2+Na+H2 NaBH4+Na2SiO3(未配平)。请回答下列问题:
NaBH4+Na2SiO3(未配平)。请回答下列问题:
(1)在该反应加料之前,需要将反应容器加热至100 ℃以上并通入氩气,通入氩气的目的是_______ 。
(2)上述反应中H2与Na的物质的量之比为_______ 。
(3)硅酸钠水溶液俗称水玻璃,能产生硅酸(H2SiO3),硬化粘结,且有碱性,其原因是_______ (用离子方程式表示)。铸造工艺中可用氯化铵作为水玻璃的硬化剂。请用平衡原理加以解释:_______ 。
(4)在强碱性条件下,常用NaBH4处理含Au3+的废液生成单质Au,已知,反应后硼元素以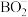 形式存在,反应前后硼元素化合价不变,且无气体生成,则发生反应的离子方程式为
形式存在,反应前后硼元素化合价不变,且无气体生成,则发生反应的离子方程式为_______ 。
(5)最新研究发现以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,则每消耗1 L 6 mol·L−1 H2O2溶液,理论上流过电路中的电子数为_______ (用NA表示阿伏加德罗常数的值)。
 NaBH4+Na2SiO3(未配平)。请回答下列问题:
NaBH4+Na2SiO3(未配平)。请回答下列问题:(1)在该反应加料之前,需要将反应容器加热至100 ℃以上并通入氩气,通入氩气的目的是
(2)上述反应中H2与Na的物质的量之比为
(3)硅酸钠水溶液俗称水玻璃,能产生硅酸(H2SiO3),硬化粘结,且有碱性,其原因是
(4)在强碱性条件下,常用NaBH4处理含Au3+的废液生成单质Au,已知,反应后硼元素以
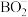 形式存在,反应前后硼元素化合价不变,且无气体生成,则发生反应的离子方程式为
形式存在,反应前后硼元素化合价不变,且无气体生成,则发生反应的离子方程式为(5)最新研究发现以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,则每消耗1 L 6 mol·L−1 H2O2溶液,理论上流过电路中的电子数为
您最近一年使用:0次
名校
解题方法
2 . 以钛铁矿(主要成分为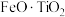 ,还含有
,还含有 、
、 、
、 等杂质)为原料合成锂离子电池的电极材料钛酸锂(
等杂质)为原料合成锂离子电池的电极材料钛酸锂( )和磷酸亚铁锂(
)和磷酸亚铁锂( )的工艺流程如下:
)的工艺流程如下:

回答下列问题:
(1)“溶浸”后溶液中的金属阳离子主要包括 、
、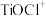
_______ 。“滤液”经加热水解后转化为富钛渣(钛元素主要以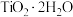 形式存在),写出上述制备
形式存在),写出上述制备 的离子方程式:
的离子方程式:_______ 。在制备时加入大量的水,同时加热的目的是_______
(2)“溶钛”过程反应温度不能太高,其原因是_______ 。
(3)“沉铁”步骤反应的化学方程式为_______ ,“沉铁”后的滤液经处理后可返回_______ 工序循环利用。
(4)“煅烧”制备 过程中,
过程中, 和
和 的理论投入量的物质的量之比为
的理论投入量的物质的量之比为_______ 。
(5)以 和
和 作电极组成电池,充电时发生反应:
作电极组成电池,充电时发生反应: (
(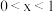 ),阳极的电极反应式为
),阳极的电极反应式为_______ 。
(6)从废旧 电极中可回收锂元素。用硝酸充分溶浸废旧
电极中可回收锂元素。用硝酸充分溶浸废旧 电极,测得浸取液中
电极,测得浸取液中 ,加入等体积的碳酸钠溶液将
,加入等体积的碳酸钠溶液将 转化为
转化为 沉淀,若沉淀中的锂元素占浸取液中锂元素总量的90%,则反应后的溶液中
沉淀,若沉淀中的锂元素占浸取液中锂元素总量的90%,则反应后的溶液中 的浓度为
的浓度为_______  [已知
[已知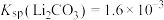 ,假设反应后溶液体积为反应前两溶液之和]。
,假设反应后溶液体积为反应前两溶液之和]。
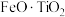 ,还含有
,还含有 、
、 、
、 等杂质)为原料合成锂离子电池的电极材料钛酸锂(
等杂质)为原料合成锂离子电池的电极材料钛酸锂( )和磷酸亚铁锂(
)和磷酸亚铁锂( )的工艺流程如下:
)的工艺流程如下:
回答下列问题:
(1)“溶浸”后溶液中的金属阳离子主要包括
 、
、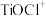
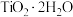 形式存在),写出上述制备
形式存在),写出上述制备 的离子方程式:
的离子方程式:(2)“溶钛”过程反应温度不能太高,其原因是
(3)“沉铁”步骤反应的化学方程式为
(4)“煅烧”制备
 过程中,
过程中, 和
和 的理论投入量的物质的量之比为
的理论投入量的物质的量之比为(5)以
 和
和 作电极组成电池,充电时发生反应:
作电极组成电池,充电时发生反应: (
(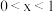 ),阳极的电极反应式为
),阳极的电极反应式为(6)从废旧
 电极中可回收锂元素。用硝酸充分溶浸废旧
电极中可回收锂元素。用硝酸充分溶浸废旧 电极,测得浸取液中
电极,测得浸取液中 ,加入等体积的碳酸钠溶液将
,加入等体积的碳酸钠溶液将 转化为
转化为 沉淀,若沉淀中的锂元素占浸取液中锂元素总量的90%,则反应后的溶液中
沉淀,若沉淀中的锂元素占浸取液中锂元素总量的90%,则反应后的溶液中 的浓度为
的浓度为 [已知
[已知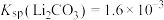 ,假设反应后溶液体积为反应前两溶液之和]。
,假设反应后溶液体积为反应前两溶液之和]。
您最近一年使用:0次
名校
解题方法
3 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。
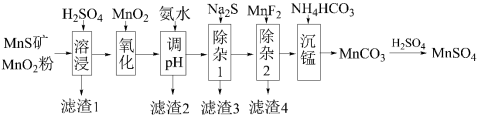
已知:①“滤渣1”含有S和 ;
;
②相关金属离子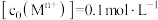 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)“氧化”中添加适量的 的作用是
的作用是________ 。
(2)“调pH”的目的是除铁和铝,则溶液的pH范围应调节为________ ~6之间。
(3)“除杂1”的目的是除去 和
和 ,“滤渣3”的主要成分是
,“滤渣3”的主要成分是________ 。
(4)“除杂2”的目的是生成 时沉淀除去
时沉淀除去 。该步骤维持溶液pH恒为4.0,若1 L溶液中
。该步骤维持溶液pH恒为4.0,若1 L溶液中 的初始浓度为0.1 mol/L,现欲将
的初始浓度为0.1 mol/L,现欲将 沉淀完全(即剩余离子浓度小于
沉淀完全(即剩余离子浓度小于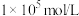 时),则需要加入的
时),则需要加入的 固体至少达到
固体至少达到________ mol( 为易溶的强电解质,忽略加入固体时溶液体积改变)。若溶液中酸度过高,
为易溶的强电解质,忽略加入固体时溶液体积改变)。若溶液中酸度过高, 沉淀不完全,原因是
沉淀不完全,原因是________ 。(已知: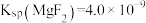 ;
; )
)
(5)写出“沉猛”的离子方程式:________ 。
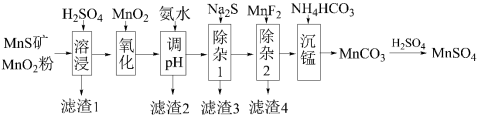
已知:①“滤渣1”含有S和
 ;
;②相关金属离子
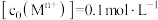 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:| 金属离子 |  |  |  |  |  |  |  |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“氧化”中添加适量的
 的作用是
的作用是(2)“调pH”的目的是除铁和铝,则溶液的pH范围应调节为
(3)“除杂1”的目的是除去
 和
和 ,“滤渣3”的主要成分是
,“滤渣3”的主要成分是(4)“除杂2”的目的是生成
 时沉淀除去
时沉淀除去 。该步骤维持溶液pH恒为4.0,若1 L溶液中
。该步骤维持溶液pH恒为4.0,若1 L溶液中 的初始浓度为0.1 mol/L,现欲将
的初始浓度为0.1 mol/L,现欲将 沉淀完全(即剩余离子浓度小于
沉淀完全(即剩余离子浓度小于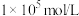 时),则需要加入的
时),则需要加入的 固体至少达到
固体至少达到 为易溶的强电解质,忽略加入固体时溶液体积改变)。若溶液中酸度过高,
为易溶的强电解质,忽略加入固体时溶液体积改变)。若溶液中酸度过高, 沉淀不完全,原因是
沉淀不完全,原因是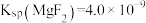 ;
; )
)(5)写出“沉猛”的离子方程式:
您最近一年使用:0次
2022-03-08更新
|
184次组卷
|
2卷引用:河南省范县第一中学等学校2021-2022学年高二上学期联考检测化学试题



