名校
解题方法
1 . 某研究小组在实验室以含铁的铜屑为原料制备Cu(NO3)2·3H2O晶体,并进一步探究用SOCl2制备少量无水Cu(NO3)2。设计的合成路线如下:
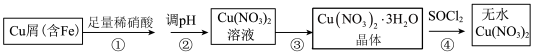
已知:SOCl2熔点-105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。请回答:
(1)写出第②步调 pH适合的一种物质______ (填化学式),调 pH 后需进行的操作是_____ 。
(2)第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是将溶液转移至蒸发皿中,缓缓加热至______ 。
(3)第④步中发生反应的化学方程式是______ 。
(4)第④步,某同学设计的实验装置示意图(如图,夹持及控温装置省略)有一处不合理,请提出改进方案并说明理由_______ 。
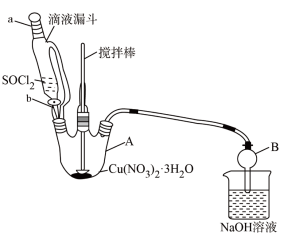
装置改进后,向仪器 A 中缓慢滴加 SOCl2时,需打开活塞_____ (填“a”“b”或“a 和 b”)。
(5)Cu(NO3)2·3H2O在170℃可失去结晶水变成Cu(NO3)2,若加热时间过长,Cu(NO3)2则会分解为一种黑色的固体,一种红棕色气体和另一种单质气体,写出反应的化学方程式:_______ 。
(6)为测定无水Cu(NO3)2产品的纯度,可用分光光度法。
已知:4NH3·H2O+Cu2+=Cu(NH3)42++4H2O;Cu(NH3)42+对特定波长光的吸收程度(用吸光度A表示)与 Cu2+在一定浓度范围内成正比。现测得Cu(NH3)42+的吸光度A与 Cu2+标准溶液浓度关系如图所示:
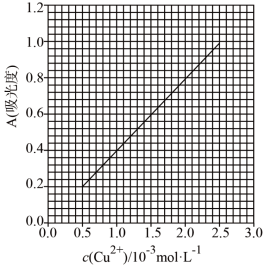
准确称取0.3150g无水Cu(NO3)2,用蒸馏水溶解并定容至100mL,准确移取该溶液10.00mL,加过量NH3·H2O,再用蒸馏水定容至100mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是_______ (以质量分数表示)。

已知:SOCl2熔点-105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。请回答:
(1)写出第②步调 pH适合的一种物质
(2)第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是将溶液转移至蒸发皿中,缓缓加热至
(3)第④步中发生反应的化学方程式是
(4)第④步,某同学设计的实验装置示意图(如图,夹持及控温装置省略)有一处不合理,请提出改进方案并说明理由

装置改进后,向仪器 A 中缓慢滴加 SOCl2时,需打开活塞
(5)Cu(NO3)2·3H2O在170℃可失去结晶水变成Cu(NO3)2,若加热时间过长,Cu(NO3)2则会分解为一种黑色的固体,一种红棕色气体和另一种单质气体,写出反应的化学方程式:
(6)为测定无水Cu(NO3)2产品的纯度,可用分光光度法。
已知:4NH3·H2O+Cu2+=Cu(NH3)42++4H2O;Cu(NH3)42+对特定波长光的吸收程度(用吸光度A表示)与 Cu2+在一定浓度范围内成正比。现测得Cu(NH3)42+的吸光度A与 Cu2+标准溶液浓度关系如图所示:

准确称取0.3150g无水Cu(NO3)2,用蒸馏水溶解并定容至100mL,准确移取该溶液10.00mL,加过量NH3·H2O,再用蒸馏水定容至100mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题:
(1)泡沫灭火器原理(用离子方程式表示)___________
(2)碳酸钠溶液蒸干灼烧得到的固体是_____ , 原因是____________
(3)已知NaHR溶液中c(H2R)<c(R2-),则该溶液中c(H+)________ c(OH-)(填写“<”或“=”或“>”)
(4)相同条件下,同浓度的NH3•H2O , NH4Cl,NH4Al(SO4)2,NH4HSO4水溶液,NH4+浓度分别为a,b,c,d,则几种物质NH4+浓度由大到小的顺序为_______ (用a,b,c,d,表示)
(5)二氯亚砜(SOCl2)是一种无色易挥发液体,与水剧烈水解生成两种气体,常做脱水剂。用硫磺(用S表示)、液氯和三氧化硫为原料在一定条件下合成二氯亚砜,原子利用率达到百分之百,则三者的物质的量之比为____________ 写出SOCl2吸收水蒸气的化学方程式___________
(1)泡沫灭火器原理(用离子方程式表示)
(2)碳酸钠溶液蒸干灼烧得到的固体是
(3)已知NaHR溶液中c(H2R)<c(R2-),则该溶液中c(H+)
(4)相同条件下,同浓度的NH3•H2O , NH4Cl,NH4Al(SO4)2,NH4HSO4水溶液,NH4+浓度分别为a,b,c,d,则几种物质NH4+浓度由大到小的顺序为
(5)二氯亚砜(SOCl2)是一种无色易挥发液体,与水剧烈水解生成两种气体,常做脱水剂。用硫磺(用S表示)、液氯和三氧化硫为原料在一定条件下合成二氯亚砜,原子利用率达到百分之百,则三者的物质的量之比为
您最近一年使用:0次
名校
3 . CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法.
Ⅰ.甲醇可以补充和部分替代石油燃料,缓解能源紧张,利用CO可以合成甲醇.
(1)已知:CO(g)+1/2O2(g)═CO2(g)ΔH1=-283.0kJ·mol-1
H2(g)+1/2O2(g)═H2O(l)ΔH2=-285.8kJ·mol-1
CH3OH(g)+3/2O2(g)═CO2(g)+2H2O(l)ΔH3=-764.6kJ·mol-1
请写出CO与H2合成甲醇蒸汽的热化学方程式____________________
(2)一定条件下,在溶剂为VL的密闭容器中充入amolCO与2amolH2合成甲醇,平衡转化率与温度、压强的关系如图所示.

①该反应在A点的平衡常数K=_________________ (用a和V表示)
②下列能说明反应达到平衡状态的是_____
A.v(CO)=v(H2)B.混合气体的密度不变
C.混合气体的平均相对分子质量不变D.c(CO)=c(H2)
③写出能增大v(CO)又能提高CO转化率的一项措施_____________________________
Ⅱ.某学习小组以SO2为原料,采用电化学方法制取硫酸。
(3)原电池原理:该小组设计的原理示意图如左下图,写出该电池负极的电极反应式______ 。
(4)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如图,写出开始电解时阳极的电极反应式________________ 。


(5)已知25℃时由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,则该混合溶液中各离子浓度的大小顺序为________________________________ (已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)
Ⅰ.甲醇可以补充和部分替代石油燃料,缓解能源紧张,利用CO可以合成甲醇.
(1)已知:CO(g)+1/2O2(g)═CO2(g)ΔH1=-283.0kJ·mol-1
H2(g)+1/2O2(g)═H2O(l)ΔH2=-285.8kJ·mol-1
CH3OH(g)+3/2O2(g)═CO2(g)+2H2O(l)ΔH3=-764.6kJ·mol-1
请写出CO与H2合成甲醇蒸汽的热化学方程式
(2)一定条件下,在溶剂为VL的密闭容器中充入amolCO与2amolH2合成甲醇,平衡转化率与温度、压强的关系如图所示.

①该反应在A点的平衡常数K=
②下列能说明反应达到平衡状态的是
A.v(CO)=v(H2)B.混合气体的密度不变
C.混合气体的平均相对分子质量不变D.c(CO)=c(H2)
③写出能增大v(CO)又能提高CO转化率的一项措施
Ⅱ.某学习小组以SO2为原料,采用电化学方法制取硫酸。
(3)原电池原理:该小组设计的原理示意图如左下图,写出该电池负极的电极反应式
(4)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如图,写出开始电解时阳极的电极反应式


(5)已知25℃时由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,则该混合溶液中各离子浓度的大小顺序为
您最近一年使用:0次
2018-10-24更新
|
1007次组卷
|
2卷引用:天津市南开中学2018届高三下学期6月模拟理科综合化学试题



