名校
1 . 下列有关说法正确的是
| A.由MgCl2溶液制备无水MgCl2,将MgCl2溶液加热蒸干 |
| B.室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O=NH3·H2O+H3O+ |
| C.配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 |
| D.AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 |
您最近一年使用:0次
2019-01-08更新
|
204次组卷
|
2卷引用:【全国百强校】山西省长治市第二中学2018-2019学年高二上学期第二次月考(期中)化学试题
名校
2 . 下列实验方案设计、现象和结论中正确的是
| 选项 | 实验方案设计 | 现象和结论 |
| A | 取A、B两支试管,各加入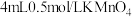 ,然后向A中加入 ,然后向A中加入 ,同时向B中加入 ,同时向B中加入 | A、B中溶液均褪色且B中褪色快,说明其他条件不变时,反应物浓度越大,反应速率越快 |
| B | 将 相同的 相同的 溶液和 溶液和 溶液均稀释10倍 溶液均稀释10倍 |  ,说明 ,说明 酸性弱于 酸性弱于 |
| C | 鉴别 和 和 时,分别取少量固体于两支试管中,加水溶解,再滴加 时,分别取少量固体于两支试管中,加水溶解,再滴加 溶液 溶液 | 产生白色沉淀的试管内为 |
| D | 将乙醇和 共热产生的气体依次通入足量的 共热产生的气体依次通入足量的 溶液、稀酸性高锰酸钾溶液 溶液、稀酸性高锰酸钾溶液 | 高锰酸钾溶液褪色,证明发生了消去反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-19更新
|
1131次组卷
|
6卷引用:浙江省宁波“十校”2021-2022学年高三下学期3月份联考化学试题
浙江省宁波“十校”2021-2022学年高三下学期3月份联考化学试题(已下线)卷04 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)2022年浙江省6月高考真题变式题21-25(已下线)2022年浙江1月高考真题变式题(21-25)浙江省舟山市舟山中学2021-2022学年高三上学期开学考试化学试题浙江省舟山市普陀中学2022-2023学年高三上学期9月月考化学试题
名校
解题方法
3 . 室温下,下列实验过程能达到预期目的的是
| 选项 | 实验过程 | 实验目的 |
| A | 向 NaCl、NaI 的混合溶液中滴加少量 AgNO3 溶液,生成淡黄色沉淀 | 证明 Ksp(AgCl)> Ksp(AgI) |
| B | 相同条件下,分别用 pH 试纸测定0.1 mol/LNaClO 溶液、0.1mol/LCH3COONa 溶液的 pH | 比较HClO 和 CH3COOH 的酸性强弱 |
| C | 苯和液溴的混合液中加入铁粉,将产生的气体通入硝酸酸化的AgNO3 溶液中,产生淡黄色沉淀 | 证明苯与液溴在Fe 催化下发生取代反应 |
| D | 向 NaAlO2 溶液中加入NaHCO3 溶液,观察到有白色沉淀生成 | 证明AlO 得质子的能力强于CO 得质子的能力强于CO |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-04-08更新
|
961次组卷
|
3卷引用:重庆市第一中学2021届高三下学期第二次月考(4月)化学试题
名校
4 . 下列操作能达到预期目的是
| 选项 | 操作内容 | 操作目的 |
| A | 室温下,用pH试纸分别测定浓度均为0.1 mol·L-1的NaClO溶液和CH3COOH溶液的pH | 比较HClO和 CH3COOH的酸性强弱 |
| B | 将FeCl2溶于稀盐酸中,并加入适量铁粉 | 配制FeCl2溶液 |
| C | 常温下,测得饱和溶液的pH:NaA>NaB | 证明水解程度:A— > B— |
| D | 常温下,等体积pH均为2的HA和HB两种酸分别与足量Zn反应,HA放出的H2多 | 证明HB是强酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
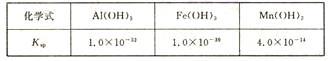
5 . 软锰矿(主要成分MnO2,含Fe,Al2O3,MgO杂质)的水悬浊液与烟气中的SO2反应可制备MnSO4·H2O,MnO2与SO2反应的化学方程式为MnO2 +SO2=MnSO4。已知下列信息:
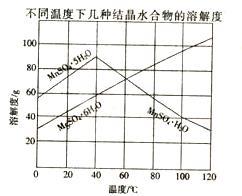
室温下几种氢氧化物的溶度积
回答下列问题:
(1)质量为17.40 g纯净MnO2最多能氧化____ L(标准状况) SO2。
(2)悬浊液吸收烟气后,Fe首先转化为Fe2+进入溶液,然后被_____ 氧化为Fe3+;要证明溶液中存在Fe3+,可选择的试剂是_____ (填标号)。
a.KMnO4溶液 b.KCl溶液 c.KSCN溶液 d.KNO3溶液
(3)室温下,将吸收液过滤,在滤液中加入CaCO3,可除去MnSO4溶液中的Fe3+、Al3+,原因是________ 。
(4)从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为__________ 。

室温下几种氢氧化物的溶度积

回答下列问题:
(1)质量为17.40 g纯净MnO2最多能氧化
(2)悬浊液吸收烟气后,Fe首先转化为Fe2+进入溶液,然后被
a.KMnO4溶液 b.KCl溶液 c.KSCN溶液 d.KNO3溶液
(3)室温下,将吸收液过滤,在滤液中加入CaCO3,可除去MnSO4溶液中的Fe3+、Al3+,原因是
(4)从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为
您最近一年使用:0次
名校
解题方法
6 . 已知液氨的电离类似水的电离,碳酸钠在液氨中完全电离并发生类似水解的氨解。肼( )为二元弱碱,在水中的电离方程式与氨相似。下列说法错误的是
)为二元弱碱,在水中的电离方程式与氨相似。下列说法错误的是
 )为二元弱碱,在水中的电离方程式与氨相似。下列说法错误的是
)为二元弱碱,在水中的电离方程式与氨相似。下列说法错误的是A.元素的电负性: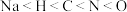 |
B.肼在水中第一步电离的方程式为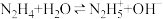 |
C.肼与硫酸反应生成的酸式盐中阳离子的电子式为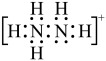 |
D.碳酸钠在液氨中第一步氨解的离子方程式为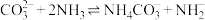 |
您最近一年使用:0次
名校
解题方法
7 . 常温下,用 盐酸滴定25.00mL
盐酸滴定25.00mL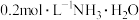 溶液,所得溶液pH、
溶液,所得溶液pH、 和
和 的物质的量分数与滴加盐酸体积的关系如图所示。下列说法不正确的是
的物质的量分数与滴加盐酸体积的关系如图所示。下列说法不正确的是

 盐酸滴定25.00mL
盐酸滴定25.00mL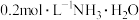 溶液,所得溶液pH、
溶液,所得溶液pH、 和
和 的物质的量分数与滴加盐酸体积的关系如图所示。下列说法不正确的是
的物质的量分数与滴加盐酸体积的关系如图所示。下列说法不正确的是
A.曲线①代表 ,曲线②代表 ,曲线②代表 |
| B.当溶液显中性时,滴入盐酸的体积小于25mL |
C. 的电离常数的数量级为 的电离常数的数量级为 |
D.a点溶液中存在 |
您最近一年使用:0次
2022-11-05更新
|
1120次组卷
|
5卷引用:河南省南阳市2022-2023学年高三上学期期中质量评估化学试题
河南省南阳市2022-2023学年高三上学期期中质量评估化学试题(已下线)模拟卷03-2023年高三化学对接新高考全真模拟试卷(云南,安徽,黑龙江,山西,吉林五省通用)(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试平行卷河南省南阳市2022-2023学年高三上学期11月期中考试化学试题宁夏六盘山高级中学2023-2024学年高三一模考试化学试题
名校
8 . 常温下, 的溶液A中含有
的溶液A中含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的四种,且溶液中各离子的浓度均为0.1
中的四种,且溶液中各离子的浓度均为0.1 。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是
。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是
 的溶液A中含有
的溶液A中含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的四种,且溶液中各离子的浓度均为0.1
中的四种,且溶液中各离子的浓度均为0.1 。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是
。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是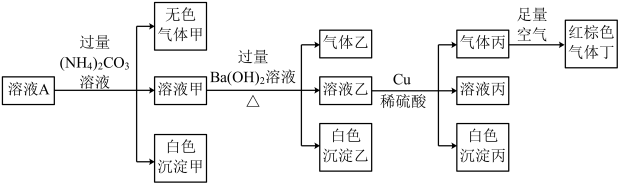
A.溶液A中一定含有 、 、 、 、 、 、 |
B.若实验消耗 14.4g,则生成气体丁的体积为3.36L 14.4g,则生成气体丁的体积为3.36L |
C.沉淀乙中一定有 ,可能有 ,可能有 |
D.溶液A中一定没有 ,但是无法确定是否含有 ,但是无法确定是否含有 |
您最近一年使用:0次
2023-02-08更新
|
241次组卷
|
17卷引用:河南省豫南豫北名校2018届高三精英联赛化学试题1
河南省豫南豫北名校2018届高三精英联赛化学试题1江西省莲塘一中、临川二中2018届高三上学期第一次联考化学试题(已下线)黄金30题系列 高三化学 小题易丢分陕西省陕师大附中2018届高三第五次月考化学试题河南省南阳市第一中学校2018届高三第七次考试理综化学试题河北省定州中学2018届高三(承智班)下学期开学考试化学试题河南省豫南豫北名校2018届高三精英联赛化学试题2西藏自治区拉萨中学2018届高三第六次月考理综化学试题湖南省新高考联盟2021届高三下学期3月提升检测化学(A)试题安徽省名校2020-2021学年高二下学期5月第二次联考化学试题陕西省西安中学2021-2022学年高三上学期期中考试化学试题福建省龙岩第一中学2021-2022学年高三上学期第三次月考化学试题(已下线)三轮冲刺卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(辽宁专用)湖南省常德市第一中学 2023届高三7月摸底考试化学试题(已下线)易错点03 离子反应-备战2023年高考化学考试易错题(已下线)学科特色6 离子推断湖南省永州市祁阳县第四中学2023-2024学年高三上学期第三次段考化学试题
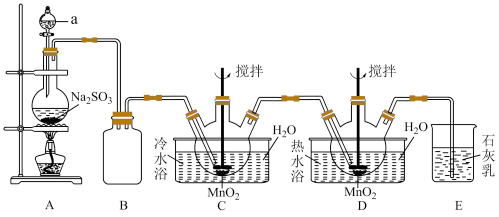
9 . 连二硫酸锰(MnS2O6)常用于灭菌以及水果、蔬菜的保鲜。硫酸锰(MnSO4)是重要的微量元素肥料之一,也用作饲料添加剂,在涂料、造纸、陶瓷、电子、纺织等领域也有广泛应用。利用MnO2悬浊液吸收SO2气体制取MnS2 O6和MnSO4的装置如图所示(部分夹持仪器、加热仪器未画出)。
②连二硫酸锰晶体的化学式为MnS2O6·4H2O。
③连二硫酸钡(BaS2O6)易溶于水,氢氧化锰[Mn(OH)2]难溶于水。
回答下列问题:
(1)仪器a的名称为___________ ,该仪器中装入的试剂最好为___________ (填标号)。
A.稀盐酸 B.70%的浓硫酸 C.98%的浓硫酸 D.稀硝酸
(2)连二硫酸锰在装置___________ (填标号)中生成,装置B的作用为___________ 。
(3)从实验后过滤所得的反应混合液(含有少量杂质MnSO4)中得到纯净的MnS2O6溶液的操作方法和除杂的反应原理为___________ 。
(4)由MnS2O6溶液得到MnS2O6·4H2O晶体的操作方法是___________ 。
(5)测定MnS2O6中锰的含量:称取wg产品充分加热,加适量水溶解,用amol·L-1KMnO4标准溶液进行滴定(Mn元素均转化为MnO2),滴定终点时消耗bmL标准溶液。___________ 。(填标号)
A.滴定管活塞涂凡士林:取下活塞,用滤纸擦干,用手指蘸取少量凡士林涂抹一薄层在活塞a、c(如图)处的四周,平行插入活塞槽中,然后朝同一个方向转动
B.滴定开始时可以将液体成线状快速流下,接近终点时减慢滴加速度,必要时采用半滴操作
C.读数时可将滴定管从滴定管架上取下,捏住管上端无刻度处,使滴定管保持垂直
D.第一次滴定终点时,若测得消耗标准溶液体积小于5.00mL,则第二次滴定时可稀释待测液后重新滴定来减小误差
②实验过程中若晶体加热不充分,测得产品中锰的质量分数将___________ (填“偏大”“偏小”或“无影响”)。
③产品中锰的质量分数是___________ (列出计算式)。
②连二硫酸锰晶体的化学式为MnS2O6·4H2O。
③连二硫酸钡(BaS2O6)易溶于水,氢氧化锰[Mn(OH)2]难溶于水。
回答下列问题:
(1)仪器a的名称为
A.稀盐酸 B.70%的浓硫酸 C.98%的浓硫酸 D.稀硝酸
(2)连二硫酸锰在装置
(3)从实验后过滤所得的反应混合液(含有少量杂质MnSO4)中得到纯净的MnS2O6溶液的操作方法和除杂的反应原理为
(4)由MnS2O6溶液得到MnS2O6·4H2O晶体的操作方法是
(5)测定MnS2O6中锰的含量:称取wg产品充分加热,加适量水溶解,用amol·L-1KMnO4标准溶液进行滴定(Mn元素均转化为MnO2),滴定终点时消耗bmL标准溶液。

A.滴定管活塞涂凡士林:取下活塞,用滤纸擦干,用手指蘸取少量凡士林涂抹一薄层在活塞a、c(如图)处的四周,平行插入活塞槽中,然后朝同一个方向转动
B.滴定开始时可以将液体成线状快速流下,接近终点时减慢滴加速度,必要时采用半滴操作
C.读数时可将滴定管从滴定管架上取下,捏住管上端无刻度处,使滴定管保持垂直
D.第一次滴定终点时,若测得消耗标准溶液体积小于5.00mL,则第二次滴定时可稀释待测液后重新滴定来减小误差
②实验过程中若晶体加热不充分,测得产品中锰的质量分数将
③产品中锰的质量分数是
您最近一年使用:0次
2023-09-14更新
|
232次组卷
|
2卷引用:山东省金科大联考2023-2024学年高三9月联考化学试题
2020·浙江·模拟预测
10 . 某固体混合物X,含有Al2(SO4)3、FeCl3、Na2CO3和CuSO4中的几种,进行如下实验:
①X与水作用有气泡冒出,得到有色沉淀Y和弱碱性溶液Z;
②沉淀Y与NaOH溶液作用,无变化。
下列说法不正确 的是
①X与水作用有气泡冒出,得到有色沉淀Y和弱碱性溶液Z;
②沉淀Y与NaOH溶液作用,无变化。
下列说法
| A.混合物X中必定含有Na2CO3,不含Al2(SO4)3 |
| B.溶液Z中溶质主要是钠盐,且必含NaHCO3 |
| C.灼烧沉淀Y,可能得到黑色物质 |
| D.往溶液Z中加入Cu粉,若不溶解,说明X中不含FeCl3 |
您最近一年使用:0次
2021-12-26更新
|
3640次组卷
|
35卷引用:2020年浙江省高考化学试卷(1月选考)
2020年浙江省高考化学试卷(1月选考)(已下线)浙江省2020年1月选考(学考)化学试题浙江省丽水市松阳县第二中学2019-2020学年高二4月线上教学检测化学试题四川省成都市树德中学2019-2020学年高二下学期期中考试化学试题(已下线)小题必刷05 离子检验与推断——2021年高考化学一轮复习小题必刷(通用版)湖北省宜昌市长阳土家族自治县第一高级中学2020-2021学年高二上学期期中考试化学试题(已下线)小题必刷32 盐类的水解影响因素及应用——2021年高考化学一轮复习小题必刷(通用版本)(已下线)解密04 离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密04 离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练浙江省杭州市长征中学2020-2021学年高二下学期第二学期阶段性练习化学试题浙江省宁波市北仑中学2020-2021学年高二下学期期中考试化学(1班)试题(已下线)课时08 离子检验与推断-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点04 离子反应-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点04 离子反应-备战2022年高考化学一轮复习考点帮(浙江专用)江苏省淮安市车桥中学2022届高三上学期入学调研(A)化学试题(已下线)第3章 水溶液中的离子反应与平衡(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)(已下线)专题3.3.2 影响盐类水解的主要因素(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)专题04.离子反应-十年(2012-2021)高考化学真题分项汇编(浙江专用)辽宁省实验中学2022届高三第一次阶段性考试化学试题(已下线)考点03 离子反应-备战2022年高考化学学霸纠错(全国通用)(已下线)解密04 离子反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)3.3.1 盐溶液的酸碱性及其原因(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)解密04 离子反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)2020年全国卷Ⅱ化学真题变式题西藏拉萨中学2022届高三第七次月考理综化学试题(已下线)考点04 离子反应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第25讲 盐类水解(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第28讲 物质的分离、提纯和检验(练)-2023年高考化学一轮复习讲练测(全国通用)浙江省余姚中学2022-2023学年高二上学期期中考试化学试题北京市清华大学附属中学2022-2023学年高二上学期12月月考化学试题(已下线)专题06 离子共存、检验和推断-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型6 离子定性、定量推断-高考必备50个题型(已下线)考点03 离子共存、离子的检验与推断(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)黑龙江省齐齐哈尔中学2022-2023学年高三上学期11月期中考试化学试题四川省合江县马街中学校2023-2024学年高二上学期1月期末化学试题



