名校
解题方法
1 . 回答下列问题:
(1)在一个小试管里放入一小粒碘晶体,加入约5 mL蒸馏水,振荡;然后在此碘水溶液中加入约1 mL四氯化碳,振荡试管;再向试管里加入1 mL浓碘化钾水溶液,振荡试管,此时现象为___________ ,原因是___________ (写出相应的离子方程式)。
(2)向盛有少量氯化钠溶液的试管中滴入少量硝酸银溶液,生成白色的氯化银沉淀,继续向试管里加入氨水,沉淀溶解了,试写出沉淀溶解的化学方程式_____
(3)向盛有氯化铁溶液的试管中滴加1滴KSCN溶液,写出相应的离子方程式_____
(4)向硫酸铜水溶液中逐滴加入足量氨水,发现先生成蓝色沉淀,然后沉淀溶解,写出沉淀溶解的离子方程式为___________ 。向硫酸铜溶液中加入过量的NaOH溶液可生成 ,不考虑空间构型,
,不考虑空间构型, 的结构可用示意图表示为
的结构可用示意图表示为_____
(1)在一个小试管里放入一小粒碘晶体,加入约5 mL蒸馏水,振荡;然后在此碘水溶液中加入约1 mL四氯化碳,振荡试管;再向试管里加入1 mL浓碘化钾水溶液,振荡试管,此时现象为
(2)向盛有少量氯化钠溶液的试管中滴入少量硝酸银溶液,生成白色的氯化银沉淀,继续向试管里加入氨水,沉淀溶解了,试写出沉淀溶解的化学方程式
(3)向盛有氯化铁溶液的试管中滴加1滴KSCN溶液,写出相应的离子方程式
(4)向硫酸铜水溶液中逐滴加入足量氨水,发现先生成蓝色沉淀,然后沉淀溶解,写出沉淀溶解的离子方程式为
 ,不考虑空间构型,
,不考虑空间构型, 的结构可用示意图表示为
的结构可用示意图表示为
您最近一年使用:0次
2 . 天然水加热时产生水垢.天然水中含 与
与 ,
, 热分解产物有
热分解产物有 、
、 。回答下列问题:
。回答下列问题:
(1)加热 的化学方程式为
的化学方程式为_______ ;持续加热, 沉淀可转换为
沉淀可转换为 ,说明
,说明_______ 更难溶。
(2)浓缩海水得粗盐水中主要含有 、
、 、
、 等离子.粗盐水精制食盐过程中,按除杂顺序写出除杂试剂的化学式为
等离子.粗盐水精制食盐过程中,按除杂顺序写出除杂试剂的化学式为_______ 、_______ 、_______ ,过滤取滤液,加过量盐酸酸化后,蒸发结晶纯化。
(3)工业上通常用 除去天然水中
除去天然水中 ,已知某天然水中
,已知某天然水中 开始沉淀的
开始沉淀的 为9.6,则溶液中
为9.6,则溶液中 的初始浓度是
的初始浓度是_______ 。
(4)工业上制备轻质氧化镁流程如下.轻质氧化镁相比重质氧化镁质量更轻,更加疏松多孔。

①水解过程加热的作用是_______ ;
②不用重质 而用轻质
而用轻质 酸溶制备
酸溶制备 的原因是
的原因是_______ 。
 与
与 ,
, 热分解产物有
热分解产物有 、
、 。回答下列问题:
。回答下列问题:(1)加热
 的化学方程式为
的化学方程式为 沉淀可转换为
沉淀可转换为 ,说明
,说明(2)浓缩海水得粗盐水中主要含有
 、
、 、
、 等离子.粗盐水精制食盐过程中,按除杂顺序写出除杂试剂的化学式为
等离子.粗盐水精制食盐过程中,按除杂顺序写出除杂试剂的化学式为(3)工业上通常用
 除去天然水中
除去天然水中 ,已知某天然水中
,已知某天然水中 开始沉淀的
开始沉淀的 为9.6,则溶液中
为9.6,则溶液中 的初始浓度是
的初始浓度是
(4)工业上制备轻质氧化镁流程如下.轻质氧化镁相比重质氧化镁质量更轻,更加疏松多孔。

①水解过程加热的作用是
②不用重质
 而用轻质
而用轻质 酸溶制备
酸溶制备 的原因是
的原因是
您最近一年使用:0次
2022-01-14更新
|
255次组卷
|
2卷引用:四川省成都市2021-2022学年高二上学期期末考试化学试题
3 . 金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol·L-1)如图所示。
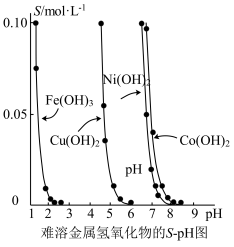
(1)pH=3时溶液中铜元素的主要存在形式是___________ 。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH___________(填序号)。
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,___________ (填“能”或“不能”)通过调节溶液pH的方法来除去,理由是___________ 。
(4)已知一些难溶电解质的溶度积常数如下表:
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的___________ (填序号)。
A.NaOH B.FeS C.Na2S
(5)向FeS的悬浊液加入Cu2+产生黑色的沉淀,反应的离子方程式为:___________ 该反应的平衡常数是:___________

(1)pH=3时溶液中铜元素的主要存在形式是
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH___________(填序号)。
| A.<1 | B.4左右 | C.>6 | D.>8 |
(4)已知一些难溶电解质的溶度积常数如下表:
| 物质 | FeS | MnS | CuS |
| Ksp | 6.5×10-18 | 2.5×10-13 | 1.3×10-35 |
| 物质 | PbS | HgS | ZnS |
| Ksp | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 |
A.NaOH B.FeS C.Na2S
(5)向FeS的悬浊液加入Cu2+产生黑色的沉淀,反应的离子方程式为:
您最近一年使用:0次
2021-08-14更新
|
1550次组卷
|
5卷引用:四川省蓬安中学校2019-2020学年高二下学期第一次阶段性考试化学试题
四川省蓬安中学校2019-2020学年高二下学期第一次阶段性考试化学试题(已下线)第3章 水溶液中的离子反应与平衡(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)(已下线)第三章第四节 难溶电解的溶解平衡(备作业)-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)(已下线)3.4.2 沉淀溶解平衡原理的应用-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)江苏省徐州市第七中学2021-2022学年高二下学期期中考试化学试题
4 . 为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
已知:25℃,Ksp(AgI,黄色)= 8.3×10‾17 ,Ksp (AgSCN,白色 )= 1.0×10‾12 。
回答下列问题:
(1)步骤3中现象a是_______ 。
(2)用沉淀溶解平衡原理解释步骤4的实验现象_______ 。
(3)向50 mL 0.005 mol/L的AgNO3溶液中加入150 mL0.005 mol/L的 KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为_______ mol/L 。
| 步骤1:向2 mL 0.005 mol/LAgNO3溶液中加入2 mL 0.005 mol/LKSCN溶液,静置。 | 出现白色沉淀。 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/LFe(NO3)3溶液。 | 溶液变为红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴3 mol/LAgNO3溶液。 | 现象a,且溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴3mol/L KI溶液。 | 出现黄色沉淀。 |
已知:25℃,Ksp(AgI,黄色)= 8.3×10‾17 ,Ksp (AgSCN,白色 )= 1.0×10‾12 。
回答下列问题:
(1)步骤3中现象a是
(2)用沉淀溶解平衡原理解释步骤4的实验现象
(3)向50 mL 0.005 mol/L的AgNO3溶液中加入150 mL0.005 mol/L的 KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为
您最近一年使用:0次
2018-01-31更新
|
152次组卷
|
2卷引用:四川省攀枝花市2017-2018学年高二上学期调研检测化学试题



