名校
解题方法
1 . 回答下列问题
(1)写出过量Mg(OH)2固体放入水中溶解形成饱和溶液时的溶解平衡表达式________________________________ ,向有Mg(OH)2沉淀的溶液中加入过量浓NH4Cl,溶液变澄清,相关反应的化学方程式为____________________________ ,已知室温时饱和的Mg(OH)2溶液的pH=10,则Mg(OH)2的溶度积为___________ 。
(2)明矾是KAl(SO4)2·12H2O,其溶液中离子浓度由大到小的顺序______________________ ;向明矾溶液中逐渐滴入Ba(OH)2 溶液至SO 离子恰好沉淀完全时,溶液的显
离子恰好沉淀完全时,溶液的显_______ 性(填酸、碱、中),离子反应的总方程式:_________________________________________________ 。
(3)为配制SbCl3溶液,取少量SbCl3固体,加2mL~3mL水溶解,此时却会产生白色沉淀Sb2O3,写出此时反应的化学方程式为:___________________________ ,故在配制SbCl3溶液时应加少量____________ 。
(1)写出过量Mg(OH)2固体放入水中溶解形成饱和溶液时的溶解平衡表达式
(2)明矾是KAl(SO4)2·12H2O,其溶液中离子浓度由大到小的顺序
 离子恰好沉淀完全时,溶液的显
离子恰好沉淀完全时,溶液的显(3)为配制SbCl3溶液,取少量SbCl3固体,加2mL~3mL水溶解,此时却会产生白色沉淀Sb2O3,写出此时反应的化学方程式为:
您最近半年使用:0次
名校
解题方法
2 . 回答下列问题:
(1)在一个小试管里放入一小粒碘晶体,加入约5 mL蒸馏水,振荡;然后在此碘水溶液中加入约1 mL四氯化碳,振荡试管;再向试管里加入1 mL浓碘化钾水溶液,振荡试管,此时现象为___________ ,原因是___________ (写出相应的离子方程式)。
(2)向盛有少量氯化钠溶液的试管中滴入少量硝酸银溶液,生成白色的氯化银沉淀,继续向试管里加入氨水,沉淀溶解了,试写出沉淀溶解的化学方程式_____
(3)向盛有氯化铁溶液的试管中滴加1滴KSCN溶液,写出相应的离子方程式_____
(4)向硫酸铜水溶液中逐滴加入足量氨水,发现先生成蓝色沉淀,然后沉淀溶解,写出沉淀溶解的离子方程式为___________ 。向硫酸铜溶液中加入过量的NaOH溶液可生成 ,不考虑空间构型,
,不考虑空间构型, 的结构可用示意图表示为
的结构可用示意图表示为_____
(1)在一个小试管里放入一小粒碘晶体,加入约5 mL蒸馏水,振荡;然后在此碘水溶液中加入约1 mL四氯化碳,振荡试管;再向试管里加入1 mL浓碘化钾水溶液,振荡试管,此时现象为
(2)向盛有少量氯化钠溶液的试管中滴入少量硝酸银溶液,生成白色的氯化银沉淀,继续向试管里加入氨水,沉淀溶解了,试写出沉淀溶解的化学方程式
(3)向盛有氯化铁溶液的试管中滴加1滴KSCN溶液,写出相应的离子方程式
(4)向硫酸铜水溶液中逐滴加入足量氨水,发现先生成蓝色沉淀,然后沉淀溶解,写出沉淀溶解的离子方程式为
 ,不考虑空间构型,
,不考虑空间构型, 的结构可用示意图表示为
的结构可用示意图表示为
您最近半年使用:0次
名校
解题方法
3 . 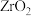 常用作陶瓷材料,可由锆英砂(主要成分为
常用作陶瓷材料,可由锆英砂(主要成分为 ,也可表示为
,也可表示为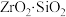 ,还含少量
,还含少量 等杂质)通过如图方法制取。
等杂质)通过如图方法制取。

已知:①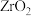 能与烧碱反应生成可溶于水的
能与烧碱反应生成可溶于水的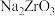 ,
,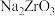 与酸反应生成
与酸反应生成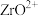 。
。
②部分金属离子在实验条件下开始沉淀和完全沉淀的 如表。
如表。
(1)熔融时 发生反应的化学方程式为
发生反应的化学方程式为_______ ,滤渣Ⅰ的化学式为_______ 。
(2)滤液Ⅰ中除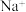 外还含金属的阳离子有
外还含金属的阳离子有_______ ,为使滤液Ⅰ的杂质离子沉淀完全,需用氨水调 ,则a的范围是
,则a的范围是_______ 。
(3)继续加氨水至 时,所发生反应的离子方程式为
时,所发生反应的离子方程式为_______ 。
(4)向过滤Ⅲ所得滤液中加入 粉末并加热,得到两种气体。该反应的离子方程式为
粉末并加热,得到两种气体。该反应的离子方程式为_______ 。
(5)为得到纯净的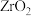 ,
,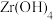 需要洗涤,检验
需要洗涤,检验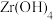 是否洗涤干净的方法是
是否洗涤干净的方法是_______ 。
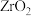 常用作陶瓷材料,可由锆英砂(主要成分为
常用作陶瓷材料,可由锆英砂(主要成分为 ,也可表示为
,也可表示为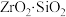 ,还含少量
,还含少量 等杂质)通过如图方法制取。
等杂质)通过如图方法制取。
已知:①
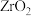 能与烧碱反应生成可溶于水的
能与烧碱反应生成可溶于水的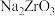 ,
,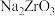 与酸反应生成
与酸反应生成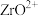 。
。②部分金属离子在实验条件下开始沉淀和完全沉淀的
 如表。
如表。| 金属离子 |  | 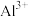 | 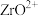 |
开始沉淀时 | 1.9 | 3.3 | 6.2 |
沉淀完全时 | 3.2 | 5.2 | 8.0 |
 发生反应的化学方程式为
发生反应的化学方程式为(2)滤液Ⅰ中除
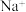 外还含金属的阳离子有
外还含金属的阳离子有 ,则a的范围是
,则a的范围是(3)继续加氨水至
 时,所发生反应的离子方程式为
时,所发生反应的离子方程式为(4)向过滤Ⅲ所得滤液中加入
 粉末并加热,得到两种气体。该反应的离子方程式为
粉末并加热,得到两种气体。该反应的离子方程式为(5)为得到纯净的
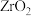 ,
,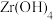 需要洗涤,检验
需要洗涤,检验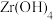 是否洗涤干净的方法是
是否洗涤干净的方法是
您最近半年使用:0次
4 . 天然水加热时产生水垢.天然水中含 与
与 ,
, 热分解产物有
热分解产物有 、
、 。回答下列问题:
。回答下列问题:
(1)加热 的化学方程式为
的化学方程式为_______ ;持续加热, 沉淀可转换为
沉淀可转换为 ,说明
,说明_______ 更难溶。
(2)浓缩海水得粗盐水中主要含有 、
、 、
、 等离子.粗盐水精制食盐过程中,按除杂顺序写出除杂试剂的化学式为
等离子.粗盐水精制食盐过程中,按除杂顺序写出除杂试剂的化学式为_______ 、_______ 、_______ ,过滤取滤液,加过量盐酸酸化后,蒸发结晶纯化。
(3)工业上通常用 除去天然水中
除去天然水中 ,已知某天然水中
,已知某天然水中 开始沉淀的
开始沉淀的 为9.6,则溶液中
为9.6,则溶液中 的初始浓度是
的初始浓度是_______ 。
(4)工业上制备轻质氧化镁流程如下.轻质氧化镁相比重质氧化镁质量更轻,更加疏松多孔。

①水解过程加热的作用是_______ ;
②不用重质 而用轻质
而用轻质 酸溶制备
酸溶制备 的原因是
的原因是_______ 。
 与
与 ,
, 热分解产物有
热分解产物有 、
、 。回答下列问题:
。回答下列问题:(1)加热
 的化学方程式为
的化学方程式为 沉淀可转换为
沉淀可转换为 ,说明
,说明(2)浓缩海水得粗盐水中主要含有
 、
、 、
、 等离子.粗盐水精制食盐过程中,按除杂顺序写出除杂试剂的化学式为
等离子.粗盐水精制食盐过程中,按除杂顺序写出除杂试剂的化学式为(3)工业上通常用
 除去天然水中
除去天然水中 ,已知某天然水中
,已知某天然水中 开始沉淀的
开始沉淀的 为9.6,则溶液中
为9.6,则溶液中 的初始浓度是
的初始浓度是
(4)工业上制备轻质氧化镁流程如下.轻质氧化镁相比重质氧化镁质量更轻,更加疏松多孔。

①水解过程加热的作用是
②不用重质
 而用轻质
而用轻质 酸溶制备
酸溶制备 的原因是
的原因是
您最近半年使用:0次
2022-01-14更新
|
255次组卷
|
2卷引用:四川省成都市2021-2022学年高二上学期期末考试化学试题
5 . 金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol·L-1)如图所示。
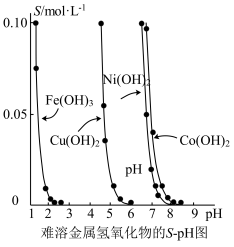
(1)pH=3时溶液中铜元素的主要存在形式是___________ 。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH___________(填序号)。
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,___________ (填“能”或“不能”)通过调节溶液pH的方法来除去,理由是___________ 。
(4)已知一些难溶电解质的溶度积常数如下表:
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的___________ (填序号)。
A.NaOH B.FeS C.Na2S
(5)向FeS的悬浊液加入Cu2+产生黑色的沉淀,反应的离子方程式为:___________ 该反应的平衡常数是:___________

(1)pH=3时溶液中铜元素的主要存在形式是
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH___________(填序号)。
| A.<1 | B.4左右 | C.>6 | D.>8 |
(4)已知一些难溶电解质的溶度积常数如下表:
| 物质 | FeS | MnS | CuS |
| Ksp | 6.5×10-18 | 2.5×10-13 | 1.3×10-35 |
| 物质 | PbS | HgS | ZnS |
| Ksp | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 |
A.NaOH B.FeS C.Na2S
(5)向FeS的悬浊液加入Cu2+产生黑色的沉淀,反应的离子方程式为:
您最近半年使用:0次
2021-08-14更新
|
1546次组卷
|
5卷引用:四川省蓬安中学校2019-2020学年高二下学期第一次阶段性考试化学试题
四川省蓬安中学校2019-2020学年高二下学期第一次阶段性考试化学试题(已下线)第3章 水溶液中的离子反应与平衡(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)(已下线)第三章第四节 难溶电解的溶解平衡(备作业)-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)(已下线)3.4.2 沉淀溶解平衡原理的应用-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)江苏省徐州市第七中学2021-2022学年高二下学期期中考试化学试题
名校
解题方法
6 . 可乐中的食品添加剂有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为H3PO4,沸点高难挥发)有一定关系。
(1)室温下,测得0.1mol/LH3PO4溶液的pH=1.5,用电离方程式解释原因:__ 。
(2)长期过量饮用可乐会破坏牙釉质,使下面的平衡向脱矿方向移动,造成龋齿。结合平衡移动原理解释原因:__ 。
Ca5(PO4)3OH(s)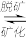 5Ca2+(aq) +3PO
5Ca2+(aq) +3PO (aq)+OH-(aq)
(aq)+OH-(aq)
(3)向磷酸溶液中滴加NaOH溶液,含磷各微粒在溶液中的物质的量分数与pH的关系如图所示。
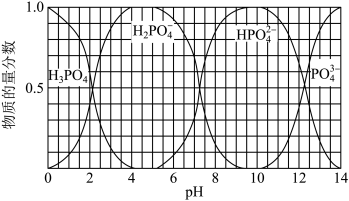
①向磷酸溶液中滴加NaOH溶液至pH=10时发生的主要反应的离子方程式是___ 。
②下列关于0.1mol/LNa2HPO4溶液的说法正确的是__ (填序号)。
a.Na2HPO4溶液显碱性,原因是HPO 的水解程度大于其电离程度
的水解程度大于其电离程度
b.c(Na+)+c(H+)=c(H2PO )+2c(HPO
)+2c(HPO )+3c(PO
)+3c(PO )+c(OH-)
)+c(OH-)
c.c(Na+)=c(H2PO )+c(HPO
)+c(HPO )+c(PO
)+c(PO )+c(H3PO4)
)+c(H3PO4)
(4)小组同学在实验室测定某可乐中磷酸的含量(不考虑白砂糖、咖啡因的影响)。
i.将一瓶可乐注入圆底烧瓶,加入活性炭,吸附色素。
ⅱ.将可乐回流加热10min,冷却至室温,过滤。
ⅲ.取50.00mL滤液,用百里香酚酞作指示剂,用0.100mol/LNaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液5.00mL。
①加热的目的是__ 。
②该可乐样品中磷酸的含量为__ g/L(H3PO4摩尔质量为98g/mol)。
(1)室温下,测得0.1mol/LH3PO4溶液的pH=1.5,用电离方程式解释原因:
(2)长期过量饮用可乐会破坏牙釉质,使下面的平衡向脱矿方向移动,造成龋齿。结合平衡移动原理解释原因:
Ca5(PO4)3OH(s)
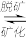 5Ca2+(aq) +3PO
5Ca2+(aq) +3PO (aq)+OH-(aq)
(aq)+OH-(aq) (3)向磷酸溶液中滴加NaOH溶液,含磷各微粒在溶液中的物质的量分数与pH的关系如图所示。

①向磷酸溶液中滴加NaOH溶液至pH=10时发生的主要反应的离子方程式是
②下列关于0.1mol/LNa2HPO4溶液的说法正确的是
a.Na2HPO4溶液显碱性,原因是HPO
 的水解程度大于其电离程度
的水解程度大于其电离程度b.c(Na+)+c(H+)=c(H2PO
 )+2c(HPO
)+2c(HPO )+3c(PO
)+3c(PO )+c(OH-)
)+c(OH-)c.c(Na+)=c(H2PO
 )+c(HPO
)+c(HPO )+c(PO
)+c(PO )+c(H3PO4)
)+c(H3PO4)(4)小组同学在实验室测定某可乐中磷酸的含量(不考虑白砂糖、咖啡因的影响)。
i.将一瓶可乐注入圆底烧瓶,加入活性炭,吸附色素。
ⅱ.将可乐回流加热10min,冷却至室温,过滤。
ⅲ.取50.00mL滤液,用百里香酚酞作指示剂,用0.100mol/LNaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液5.00mL。
①加热的目的是
②该可乐样品中磷酸的含量为
您最近半年使用:0次
2020-07-18更新
|
379次组卷
|
4卷引用:四川省绵阳市高中2022-2023学年高二下学期理科突击班5月月考化学试题
解题方法
7 . 写出下列反应的离子方程式。
(1)向Na2S2O3溶液中加入稀硫酸。________
(2)CuSO4溶液向地下深层渗透,遇到难溶的ZnS,会转变为铜蓝(CuS)。________
(3)在K2CrO4溶液中加硫酸酸化,溶液由黄色变为橙色。________
(1)向Na2S2O3溶液中加入稀硫酸。
(2)CuSO4溶液向地下深层渗透,遇到难溶的ZnS,会转变为铜蓝(CuS)。
(3)在K2CrO4溶液中加硫酸酸化,溶液由黄色变为橙色。
您最近半年使用:0次
8 . Ⅰ、重金属离子对河流及海洋造成严重污染。某化工厂废水(pH=2.0,ρ≈1g·mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
(1)你认为往废水中投入_____ (填字母序号),沉淀效果最好。
A.NaOH B.Na2S C.KI D.Ca(OH)2
(2)常温下,如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=___ 。
(3)如果用食盐处理其只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%。若环境要求排放标准为c(Ag+)低于1.0×10-8mol·L-1,问该工厂处理后的废水中c(Ag+)=__ ,是否符合排放标准__ (填“是”或“否”)。已知Ksp(AgCl)=1.8×10-10mol2·L-2。
Ⅱ、为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
已知:25℃,Ksp(AgI,黄色)=8.3×10‾17 ,Ksp(AgSCN,白色)= 1.0×10‾12 。
回答下列问题:
(4)步骤3中现象a是_______ 。
(5)向50mL0.005 mol/L的AgNO3溶液中加入150mL0.005 mol/L的KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为____ mol/L。
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
(1)你认为往废水中投入
A.NaOH B.Na2S C.KI D.Ca(OH)2
(2)常温下,如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=
(3)如果用食盐处理其只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%。若环境要求排放标准为c(Ag+)低于1.0×10-8mol·L-1,问该工厂处理后的废水中c(Ag+)=
Ⅱ、为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
| 步骤1:向2mL0.005 mol/LAgNO3溶液中加入2 mL0.005 mol/LKSCN溶液,静置。 | 出现白色沉淀。 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/LFe(NO3)3溶液。 | 溶液变为红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol/LAgNO3溶液。 | 现象a,且溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴3mol/LKI溶液。 | 出现黄色沉淀。 |
已知:25℃,Ksp(AgI,黄色)=8.3×10‾17 ,Ksp(AgSCN,白色)= 1.0×10‾12 。
回答下列问题:
(4)步骤3中现象a是
(5)向50mL0.005 mol/L的AgNO3溶液中加入150mL0.005 mol/L的KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为
您最近半年使用:0次
2019-10-11更新
|
329次组卷
|
2卷引用:四川省邻水实验学校2020-2021学年高二上学期第三阶段考试化学试题
9 . 为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
已知:25℃,Ksp(AgI,黄色)= 8.3×10‾17 ,Ksp (AgSCN,白色 )= 1.0×10‾12 。
回答下列问题:
(1)步骤3中现象a是_______ 。
(2)用沉淀溶解平衡原理解释步骤4的实验现象_______ 。
(3)向50 mL 0.005 mol/L的AgNO3溶液中加入150 mL0.005 mol/L的 KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为_______ mol/L 。
| 步骤1:向2 mL 0.005 mol/LAgNO3溶液中加入2 mL 0.005 mol/LKSCN溶液,静置。 | 出现白色沉淀。 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/LFe(NO3)3溶液。 | 溶液变为红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴3 mol/LAgNO3溶液。 | 现象a,且溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴3mol/L KI溶液。 | 出现黄色沉淀。 |
已知:25℃,Ksp(AgI,黄色)= 8.3×10‾17 ,Ksp (AgSCN,白色 )= 1.0×10‾12 。
回答下列问题:
(1)步骤3中现象a是
(2)用沉淀溶解平衡原理解释步骤4的实验现象
(3)向50 mL 0.005 mol/L的AgNO3溶液中加入150 mL0.005 mol/L的 KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为
您最近半年使用:0次
2018-01-31更新
|
152次组卷
|
2卷引用:四川省攀枝花市2017-2018学年高二上学期调研检测化学试题
10 . 写出下列反应的化学方程式。
(1)AlCl3水解溶液呈酸性________
(2)将TiCl4加入热水中生成TiO2.xH2O________
(3)向Na2S2O3溶液中加入稀硫酸__________
(4)在Mg(OH)2悬浊液中加入NH4Cl溶液,沉淀溶解___________
(1)AlCl3水解溶液呈酸性
(2)将TiCl4加入热水中生成TiO2.xH2O
(3)向Na2S2O3溶液中加入稀硫酸
(4)在Mg(OH)2悬浊液中加入NH4Cl溶液,沉淀溶解
您最近半年使用:0次



