名校
解题方法
1 . 完成下列问题
(1)已知某温度下有如下三个反应:
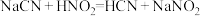


①则该温度下HF、HCN和 三种弱酸的电离常数由大到小的顺序是
三种弱酸的电离常数由大到小的顺序是___________
②已知:乙二酸( ,可简写为
,可简写为 ),俗称草酸;25℃
),俗称草酸;25℃
 ,
,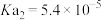 ,25℃
,25℃ ,请写出少量草酸(
,请写出少量草酸( )与NaF溶液反应的化学方程式:
)与NaF溶液反应的化学方程式:___________ 。
(2)常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中 、
、 、
、 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
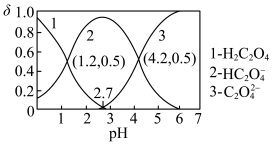
①如果所得溶液溶质为 ,则该溶液显
,则该溶液显___________ (填“酸性”、“碱性”或“中性”),其电离方程式为___________ ;
②如果所得溶液溶质为 ,则该溶液中各离子浓度由大到小顺序为
,则该溶液中各离子浓度由大到小顺序为___________ ;
③当所得溶液 时,溶液中
时,溶液中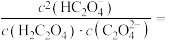
___________ ;
(3)已知25℃草酸钙的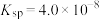 ,碳酸钙的
,碳酸钙的 。回答下列问题:25℃时向10mL碳酸钙的饱和溶液中逐滴加入
。回答下列问题:25℃时向10mL碳酸钙的饱和溶液中逐滴加入 的草酸钾溶液10mL,
的草酸钾溶液10mL,___________ 产生草酸钙沉淀(填“能”或“否”)。
(1)已知某温度下有如下三个反应:
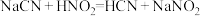


①则该温度下HF、HCN和
 三种弱酸的电离常数由大到小的顺序是
三种弱酸的电离常数由大到小的顺序是②已知:乙二酸(
 ,可简写为
,可简写为 ),俗称草酸;25℃
),俗称草酸;25℃
 ,
,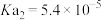 ,25℃
,25℃ ,请写出少量草酸(
,请写出少量草酸( )与NaF溶液反应的化学方程式:
)与NaF溶液反应的化学方程式:(2)常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中
 、
、 、
、 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
①如果所得溶液溶质为
 ,则该溶液显
,则该溶液显②如果所得溶液溶质为
 ,则该溶液中各离子浓度由大到小顺序为
,则该溶液中各离子浓度由大到小顺序为③当所得溶液
 时,溶液中
时,溶液中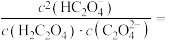
(3)已知25℃草酸钙的
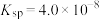 ,碳酸钙的
,碳酸钙的 。回答下列问题:25℃时向10mL碳酸钙的饱和溶液中逐滴加入
。回答下列问题:25℃时向10mL碳酸钙的饱和溶液中逐滴加入 的草酸钾溶液10mL,
的草酸钾溶液10mL,
您最近一年使用:0次
2023-11-09更新
|
409次组卷
|
2卷引用:河北省唐山市十县一中联盟2023-2024学年高二上学期期中考试化学试题
解题方法
2 . 已知常温下,AgBr的Ksp=4.9×10﹣13 mol2•L﹣2、AgI的Ksp=8.3×10﹣17mol2•L﹣2。
(1)现向含有AgI的饱和溶液中:
①加入AgNO3固体,则c(I﹣)_______ (填“变大”“变小”或“不变”,下同)。
②若改加更多的AgI固体,则c(Ag+)_______ 。
③若改加AgBr固体,则c(I﹣)_______ ,c(Ag+)_______ 。
(2)现向含有NaBr、KI均为0.002mol•L﹣1的溶液中加入等体积、浓度为4×10﹣3mol•L﹣1的AgNO3溶液,则产生的沉淀是_______ (填化学式);若向其中再加入适量的NaI固体,则可发生沉淀转化的总反应的离子方程式为_______ 。
(1)现向含有AgI的饱和溶液中:
①加入AgNO3固体,则c(I﹣)
②若改加更多的AgI固体,则c(Ag+)
③若改加AgBr固体,则c(I﹣)
(2)现向含有NaBr、KI均为0.002mol•L﹣1的溶液中加入等体积、浓度为4×10﹣3mol•L﹣1的AgNO3溶液,则产生的沉淀是
您最近一年使用:0次
3 . 氮、磷都是第ⅤA族元素,一些含氮、磷的化合物在生产生活中有重要应用。
(1)磷化铝、磷化锌、磷化钙是我国目前最常见的熏蒸杀虫剂,都能与水或酸反应产生有毒气体膦(PH3),写出磷化铝与水反应的化学方程式:_______ 。
(2)羟基磷灰石[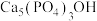 ]是一种重要的生物无机材料,也是我们牙齿表面的一层坚硬物质,可用磷酸和氢氧化钙悬浊液反应制得。已知3种钙盐的溶解度(以钙离子浓度的对数表示)随溶液pH的变化如图所示。
]是一种重要的生物无机材料,也是我们牙齿表面的一层坚硬物质,可用磷酸和氢氧化钙悬浊液反应制得。已知3种钙盐的溶解度(以钙离子浓度的对数表示)随溶液pH的变化如图所示。
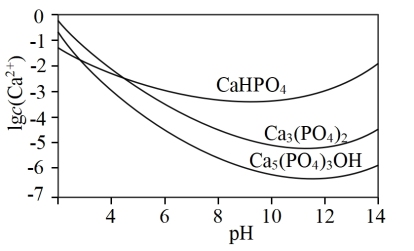
①图中所示3种钙盐,其中在人体中最稳定的存在形式是_______ (填化学式)。
②实验室制备羟基磷灰石时,应将_______ (填“磷酸”或“氢氧化钙悬浊液”,下同)滴加到_______ 中。
③进食后,口腔中残留的食物会在细菌和酶作用下产生有机酸,易造成龋齿,其原因是_______ 。
(3)氮的氧化物对大气污染比较严重,一定条件下可用NH3消除污染,则NO2与NH3的反应中,被氧化的氮原子和被还原的氮原子的物质的量之比为_______ 。
(4)标准状况下,由11.2LNH3制备得200mL硝酸溶液,向其中加入9.6g铜,充分反应后转移的电子数目为9.03×1022,则制备硝酸溶液过程中NH3的利用率为_______ ;最后得到的溶液中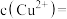
_______ (不考虑溶液体积的变化)。
(1)磷化铝、磷化锌、磷化钙是我国目前最常见的熏蒸杀虫剂,都能与水或酸反应产生有毒气体膦(PH3),写出磷化铝与水反应的化学方程式:
(2)羟基磷灰石[
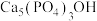 ]是一种重要的生物无机材料,也是我们牙齿表面的一层坚硬物质,可用磷酸和氢氧化钙悬浊液反应制得。已知3种钙盐的溶解度(以钙离子浓度的对数表示)随溶液pH的变化如图所示。
]是一种重要的生物无机材料,也是我们牙齿表面的一层坚硬物质,可用磷酸和氢氧化钙悬浊液反应制得。已知3种钙盐的溶解度(以钙离子浓度的对数表示)随溶液pH的变化如图所示。
①图中所示3种钙盐,其中在人体中最稳定的存在形式是
②实验室制备羟基磷灰石时,应将
③进食后,口腔中残留的食物会在细菌和酶作用下产生有机酸,易造成龋齿,其原因是
(3)氮的氧化物对大气污染比较严重,一定条件下可用NH3消除污染,则NO2与NH3的反应中,被氧化的氮原子和被还原的氮原子的物质的量之比为
(4)标准状况下,由11.2LNH3制备得200mL硝酸溶液,向其中加入9.6g铜,充分反应后转移的电子数目为9.03×1022,则制备硝酸溶液过程中NH3的利用率为
您最近一年使用:0次
4 . 金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度[S/(mol/L)]如图。
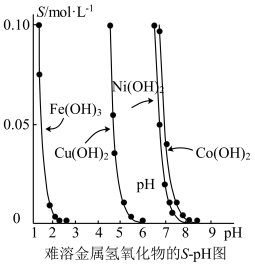
(1)pH=3时溶液中铜元素的主要存在形式是_______ 。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为_______ 。
A.<1 B.4左右 C.>6
(3)在Ni(OH)2溶液中含的少量的Co2+杂质,_______ (填“能”或“不能”)通过调节溶液pH的方法来除去,理由是_______ 。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式_______ 。
(5)已知常温下一些难溶物的溶度积常数如表:
常温下,饱和HgS溶液中c(Hg2+)=_______ mol·L-1,某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的_______ 除去它们(选填序号)。
A.NaOH B.FeS C.Na2S

(1)pH=3时溶液中铜元素的主要存在形式是
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为
A.<1 B.4左右 C.>6
(3)在Ni(OH)2溶液中含的少量的Co2+杂质,
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式
(5)已知常温下一些难溶物的溶度积常数如表:
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
常温下,饱和HgS溶液中c(Hg2+)=
A.NaOH B.FeS C.Na2S
您最近一年使用:0次
名校
解题方法
5 . I.已知:乙二酸俗称草酸(结构简式为HOOC—COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10−2,K2=5.4×10−5;碳酸(H2CO3)的电离平衡常数为K1=4.5×10−7,K2=4.7×10−11。草酸钙的Ksp=4.0×10−8,碳酸钙的Ksp=2.5×10−9.回答下列问题:
(1)相同条件下等物质的量浓度的Na2C2O4溶液的pH比Na2CO3溶液的pH___________ (填“大”、“小”或“相等”);
(2)常温下将20mL 0.4mol/L的KOH溶液与20mL 0.2mol/L的草酸溶液混合,则混合后溶液中阴离子浓度的大小顺序为___________ 。
(3)25℃时向20mL碳酸钙的饱和溶液中逐滴加入8.0×10−4mol/L的草酸钾溶液20mL,能否产生沉淀___________ (填“能”或“不能”)。
II.已知:25 ℃时,0.1 mol·L-1的HA溶液中c(H+)/c(OH-)=1010。
①HA是___________ (填“强电解质”或“弱电解质”)。
②在加水稀释HA溶液的过程中,随着水量的增加而减小的是___________ (填字母)。
A.c(HA)/c(A-) B.c(H+)/c(HA)
C.c(H+)与c(OH-)的乘积 D.c(OH-)
(1)相同条件下等物质的量浓度的Na2C2O4溶液的pH比Na2CO3溶液的pH
(2)常温下将20mL 0.4mol/L的KOH溶液与20mL 0.2mol/L的草酸溶液混合,则混合后溶液中阴离子浓度的大小顺序为
(3)25℃时向20mL碳酸钙的饱和溶液中逐滴加入8.0×10−4mol/L的草酸钾溶液20mL,能否产生沉淀
II.已知:25 ℃时,0.1 mol·L-1的HA溶液中c(H+)/c(OH-)=1010。
①HA是
②在加水稀释HA溶液的过程中,随着水量的增加而减小的是
A.c(HA)/c(A-) B.c(H+)/c(HA)
C.c(H+)与c(OH-)的乘积 D.c(OH-)
您最近一年使用:0次
解题方法
6 . (1)H2A在水中存在以下平衡:H2A⇌H++HA-,HA-⇌H++A2-.NaHA溶液显酸性,则溶液中离子浓度的大小顺序为_____ 。
(2)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)⇌Ca2+(aq)+A2-(aq),滴加少量Na2A固体,c(Ca2+)_____ (填“增大”“减小”或“不变”)。
(3)含有 的废水毒性较大,某工厂废水中含4.00×10-3 mol•L-1的
的废水毒性较大,某工厂废水中含4.00×10-3 mol•L-1的 。为使废水能达标排放,作如下处理:
。为使废水能达标排放,作如下处理:
 Cr3+、Fe3+
Cr3+、Fe3+ Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
①该废水中加入绿矾(FeSO4•7H2O)和稀硫酸时发生反应的离子方程式为:_____ 。
②已知:Ksp[Fe(OH)3]≈1.0×10-38 mol•L-1,Ksp[Cr(OH)3]≈1.0×10-31 mol•L-1,逐渐加入石灰水时,首先产生的沉淀是_____ (填沉淀的化学式)。
(2)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)⇌Ca2+(aq)+A2-(aq),滴加少量Na2A固体,c(Ca2+)
(3)含有
 的废水毒性较大,某工厂废水中含4.00×10-3 mol•L-1的
的废水毒性较大,某工厂废水中含4.00×10-3 mol•L-1的 。为使废水能达标排放,作如下处理:
。为使废水能达标排放,作如下处理:
 Cr3+、Fe3+
Cr3+、Fe3+ Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3①该废水中加入绿矾(FeSO4•7H2O)和稀硫酸时发生反应的离子方程式为:
②已知:Ksp[Fe(OH)3]≈1.0×10-38 mol•L-1,Ksp[Cr(OH)3]≈1.0×10-31 mol•L-1,逐渐加入石灰水时,首先产生的沉淀是
您最近一年使用:0次
7 . 沉淀溶解平衡在生活生产中有着重要应用.
(1)粗制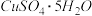 晶体中常含有杂质
晶体中常含有杂质 .
.
①在提纯时为了除去 ,常加入合适氧化剂,使
,常加入合适氧化剂,使 氧化为
氧化为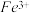 ,下列物质最好选用的是
,下列物质最好选用的是______ .
A.
 氯水
氯水 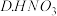
 然后再加入适当物质调整溶液至
然后再加入适当物质调整溶液至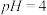 ,使
,使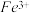 转化为
转化为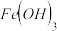 ,调整溶液pH可选用下列中的
,调整溶液pH可选用下列中的______ .
A.NaOH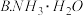


(2)在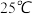 下,向浓度均为
下,向浓度均为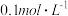 的
的 和
和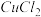 混合溶液中逐滴加入氨水,先生成
混合溶液中逐滴加入氨水,先生成______ 沉淀 填化学式
填化学式 ,生成该沉淀的离子方程式为
,生成该沉淀的离子方程式为______  已知
已知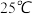 时
时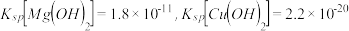 .
.
(3)向 溶液中加入
溶液中加入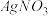 和KBr,当两种沉淀共存时,
和KBr,当两种沉淀共存时,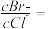
______ 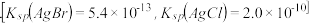
(4)向盛有1mL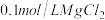 溶液的试管中滴加2滴
溶液的试管中滴加2滴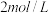 NaOH溶液,有白色沉淀生成,再滴加2滴
NaOH溶液,有白色沉淀生成,再滴加2滴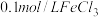 溶液,静置
溶液,静置 可以观察到的现象是
可以观察到的现象是______ ,产生该现象的原因是 用离子方程式表示
用离子方程式表示
______ 已知:Ksp[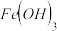 ]=4.0x10-38。
]=4.0x10-38。
(1)粗制
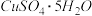 晶体中常含有杂质
晶体中常含有杂质 .
.①在提纯时为了除去
 ,常加入合适氧化剂,使
,常加入合适氧化剂,使 氧化为
氧化为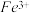 ,下列物质最好选用的是
,下列物质最好选用的是A.
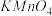
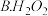
 氯水
氯水 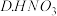
 然后再加入适当物质调整溶液至
然后再加入适当物质调整溶液至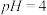 ,使
,使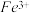 转化为
转化为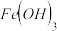 ,调整溶液pH可选用下列中的
,调整溶液pH可选用下列中的A.NaOH
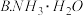


(2)在
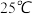 下,向浓度均为
下,向浓度均为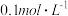 的
的 和
和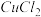 混合溶液中逐滴加入氨水,先生成
混合溶液中逐滴加入氨水,先生成 填化学式
填化学式 ,生成该沉淀的离子方程式为
,生成该沉淀的离子方程式为 已知
已知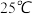 时
时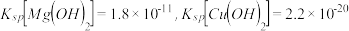 .
.(3)向
 溶液中加入
溶液中加入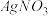 和KBr,当两种沉淀共存时,
和KBr,当两种沉淀共存时,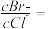
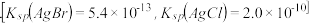
(4)向盛有1mL
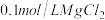 溶液的试管中滴加2滴
溶液的试管中滴加2滴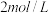 NaOH溶液,有白色沉淀生成,再滴加2滴
NaOH溶液,有白色沉淀生成,再滴加2滴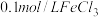 溶液,静置
溶液,静置 可以观察到的现象是
可以观察到的现象是 用离子方程式表示
用离子方程式表示
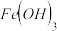 ]=4.0x10-38。
]=4.0x10-38。
您最近一年使用:0次
8 . 按要求书写方程式:
(1)H2CO3的电离方程式______________________________________________________ ;
(2)AgCl的沉淀溶解平衡方程式_______________________________________________ ;
(3)NaHCO3 溶液与 AlCl3溶液混合的离子方程式_______________________________ ;
(4)向CaSO4悬浊液中加入固体Na2CO3 ,写出对应的离子方程式_______________________ 。
(1)H2CO3的电离方程式
(2)AgCl的沉淀溶解平衡方程式
(3)NaHCO3 溶液与 AlCl3溶液混合的离子方程式
(4)向CaSO4悬浊液中加入固体Na2CO3 ,写出对应的离子方程式
您最近一年使用:0次
9 . 如图所示,横轴为溶液的pH,纵轴为Zn2+或ZnO22-物质的量浓度的对数。回答下列问题:
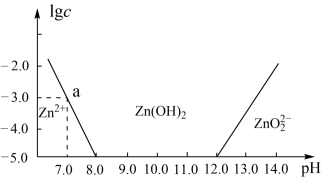
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为__________ 。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=________________ 。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液pH的范围是________ 。

(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液pH的范围是
您最近一年使用:0次
2016-12-09更新
|
309次组卷
|
2卷引用:2016-2017学年河北省邢台一中高二上月考二化学卷
10 . (1)在25℃下,向浓度均为0.1mol·L-1的MgCl2和CuCl2的混合溶液中逐滴加入氨水,先生成_________ 填化学式)沉淀,生成该沉淀的离子方程式为_________________________ 。
已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =
=_____________ 。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
 =
=
您最近一年使用:0次
2016-12-09更新
|
1033次组卷
|
4卷引用:河北省鸡泽县第一中学2017-2018学年高二上学期第一次月考化学试题
河北省鸡泽县第一中学2017-2018学年高二上学期第一次月考化学试题(已下线)2014年高二化学人教版选修四 17难溶电解质的溶解平衡练习卷人教版高二化学选修4 第三章 第四节 难溶电解质的溶解平衡练习题陕西省宝鸡市金台区2020-2021学年高二上学期期末考试化学(理)试题



