已知常温下,AgBr的Ksp=4.9×10﹣13 mol2•L﹣2、AgI的Ksp=8.3×10﹣17mol2•L﹣2。
(1)现向含有AgI的饱和溶液中:
①加入AgNO3固体,则c(I﹣)_______ (填“变大”“变小”或“不变”,下同)。
②若改加更多的AgI固体,则c(Ag+)_______ 。
③若改加AgBr固体,则c(I﹣)_______ ,c(Ag+)_______ 。
(2)现向含有NaBr、KI均为0.002mol•L﹣1的溶液中加入等体积、浓度为4×10﹣3mol•L﹣1的AgNO3溶液,则产生的沉淀是_______ (填化学式);若向其中再加入适量的NaI固体,则可发生沉淀转化的总反应的离子方程式为_______ 。
(1)现向含有AgI的饱和溶液中:
①加入AgNO3固体,则c(I﹣)
②若改加更多的AgI固体,则c(Ag+)
③若改加AgBr固体,则c(I﹣)
(2)现向含有NaBr、KI均为0.002mol•L﹣1的溶液中加入等体积、浓度为4×10﹣3mol•L﹣1的AgNO3溶液,则产生的沉淀是
更新时间:2022-09-15 23:19:09
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。已知25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
(1)将浓度均为0.1 mol·L-1的BaCl2溶液与Na2SO4溶液等体积混合,充分搅拌后过滤,滤液中c(Ba2+)=_____ mol·L-1。
(2)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸酸性很强( pH约为1), 但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是_______________________ 。(用沉淀溶解平衡原理解释)。万一误服了少量BaCO3,应尽快用大量0.5mol·L-1Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为________ mol·L-1。
(1)将浓度均为0.1 mol·L-1的BaCl2溶液与Na2SO4溶液等体积混合,充分搅拌后过滤,滤液中c(Ba2+)=
(2)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸酸性很强( pH约为1), 但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是
您最近一年使用:0次
【推荐2】金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,以达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol·L-1)如下图。
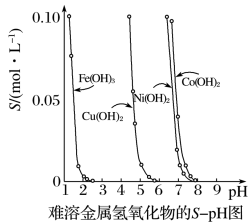
(1)pH=3时溶液中铜元素的主要存在形式是___________ 。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为___________ 。
A.<1 B.4左右 C.>6
(3)在Ni(OH)2溶液中含有少量的Co2+杂质,___________ (填“能”或“不能”)通过调节溶液pH的方法来除去,理由是___________ 。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式___________ 。
(5)已知一些难溶物的溶度积常数如下表:
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的___________ 除去它们。(选填序号)
A.NaOH B.FeS C.Na2S

(1)pH=3时溶液中铜元素的主要存在形式是
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为
A.<1 B.4左右 C.>6
(3)在Ni(OH)2溶液中含有少量的Co2+杂质,
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式
(5)已知一些难溶物的溶度积常数如下表:
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的
A.NaOH B.FeS C.Na2S
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】你还能想到哪些影响溶解平衡的因素?以CaCO3溶解平衡为例,小组讨论完成表格 CaCO3(S)⇌Ca2+(aq)+CO (aq) ΔH>0 ;
(aq) ΔH>0 ;
 (aq) ΔH>0 ;
(aq) ΔH>0 ;| 条件 | Ksp | 改变条件瞬间的浓度熵Q | Ksp与Q相对大小关系 | 移动方向 | 沉淀的物质的量变化 |
| 升温 | |||||
| 加入Na2CO3固体 | |||||
| 通入HCl气体 | |||||
| 加水稀释 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005mg/L。处理含镉废水可采用化学沉淀法。试回答下列问题:
(1)磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式为Ksp=___________ 。
(2)一定温度下,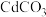 的
的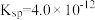 ,
, 的
的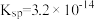 ,那么它们在水中的溶解量
,那么它们在水中的溶解量___________ 较大。
(3)向某含镉废水中加入 ,当
,当 浓度达到
浓度达到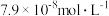 时,废水中
时,废水中 的浓度为
的浓度为___________ mol/L[已知: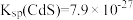 ,
,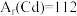 ],此时是否符合生活饮用水卫生标准?
],此时是否符合生活饮用水卫生标准?___________ (填“是”或“否”)。
Ⅱ.根据题目提供的溶度积数据进行计算并回答下列问题:
(4)已知25℃时,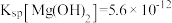 ;酸碱指示剂百里酚蓝变色的pH范围如下:
;酸碱指示剂百里酚蓝变色的pH范围如下:
25℃时,向 饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为
饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为___________ 。
(5)25℃向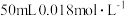 的
的 溶液中加入
溶液中加入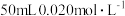 的盐酸,生成沉淀。已知该温度下,AgCl的
的盐酸,生成沉淀。已知该温度下,AgCl的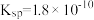 ,忽略溶液的体积变化,请计算:
,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中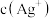 =
=___________ ,
②完全沉淀后,溶液的pH=___________ 。
③如果向完全沉淀后的溶液中继续加入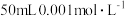 的盐酸,是否有白色沉淀生成?
的盐酸,是否有白色沉淀生成?___________ (填“是”或“否”)。
(1)磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式为Ksp=
(2)一定温度下,
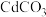 的
的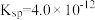 ,
, 的
的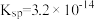 ,那么它们在水中的溶解量
,那么它们在水中的溶解量(3)向某含镉废水中加入
 ,当
,当 浓度达到
浓度达到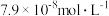 时,废水中
时,废水中 的浓度为
的浓度为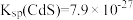 ,
,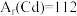 ],此时是否符合生活饮用水卫生标准?
],此时是否符合生活饮用水卫生标准?Ⅱ.根据题目提供的溶度积数据进行计算并回答下列问题:
(4)已知25℃时,
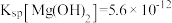 ;酸碱指示剂百里酚蓝变色的pH范围如下:
;酸碱指示剂百里酚蓝变色的pH范围如下: |  | 8.0~96 | 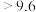 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
 饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为
饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为(5)25℃向
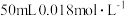 的
的 溶液中加入
溶液中加入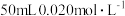 的盐酸,生成沉淀。已知该温度下,AgCl的
的盐酸,生成沉淀。已知该温度下,AgCl的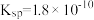 ,忽略溶液的体积变化,请计算:
,忽略溶液的体积变化,请计算:①完全沉淀后,溶液中
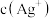 =
=②完全沉淀后,溶液的pH=
③如果向完全沉淀后的溶液中继续加入
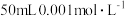 的盐酸,是否有白色沉淀生成?
的盐酸,是否有白色沉淀生成?
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如图简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
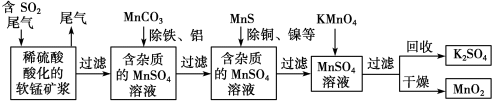
用MnCO3能除去溶液中的Al3+和Fe3+,其原理是_____ 。

用MnCO3能除去溶液中的Al3+和Fe3+,其原理是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】已知25℃时:H2CO3:Ka1=4.5×10-7、Ka2=4.7×10-11;HClO:Ka=4.0×10-8、lg2=0.3;Ksp(BaSO4)=1.0×10-10、Ksp(BaCO3)=2.6×10-9。
(1)0.4 mol/LHClO溶液的pH=_______ 。
(2)0.4 mol/LNaClO溶液的pH=_______ 。向该溶液中通入少量CO2,发生反应的离子方程式为_______ 。
(3)1.0 L水中投入0.1 mol BaSO4,得到BaSO4的悬浊液,向该悬浊液中投入Na2CO3固体使BaSO4全部转化为BaCO3,理论上需Na2CO3_______ mol(忽略过程中溶液体积的变化)。
(1)0.4 mol/LHClO溶液的pH=
(2)0.4 mol/LNaClO溶液的pH=
(3)1.0 L水中投入0.1 mol BaSO4,得到BaSO4的悬浊液,向该悬浊液中投入Na2CO3固体使BaSO4全部转化为BaCO3,理论上需Na2CO3
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】某工艺流程中加入 的目的是生成
的目的是生成 沉淀除去
沉淀除去 。若溶液酸度过高,
。若溶液酸度过高, 沉淀不完全,原因是
沉淀不完全,原因是_______ 。
 的目的是生成
的目的是生成 沉淀除去
沉淀除去 。若溶液酸度过高,
。若溶液酸度过高, 沉淀不完全,原因是
沉淀不完全,原因是
您最近一年使用:0次
【推荐2】下列说法正确的是________ 。
①难溶电解质的溶度积Ksp越小,则它的溶解度越小
②任何难溶物在水中都存在沉淀溶解平衡,溶解度大小都可以用Ksp表示
③AgCl悬浊液中存在平衡:AgCl(s) Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
④沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
⑤AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
⑥在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
⑦向2.0 mL浓度均为0.1 mol/L的KCl、KI混合溶液中滴加1~2滴0.01 mol/L AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp小
⑧饱和石灰水中加入生石灰,若温度不变,则溶液中Ca2+的物质的量不变
⑨向饱和AgCl水溶液中加入盐酸,Ksp值变大
⑩AgCl的Ksp=1.80×10-10,将0.002mol·L-1的NaCl和0.002mol·L-1的AgNO3溶液等体积混合,有AgCl沉淀生成
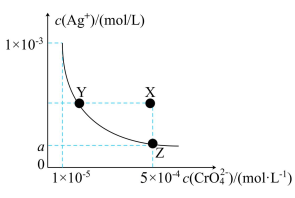
⑪在T℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示,T℃时,在Y点和Z点,Ag2CrO4的Ksp相等
⑫25 ℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9,向BaSO4的悬浊液中加入Na2CO3的浓溶液,BaSO4不可能转化为BaCO3
①难溶电解质的溶度积Ksp越小,则它的溶解度越小
②任何难溶物在水中都存在沉淀溶解平衡,溶解度大小都可以用Ksp表示
③AgCl悬浊液中存在平衡:AgCl(s)
 Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小④沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
⑤AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
⑥在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
⑦向2.0 mL浓度均为0.1 mol/L的KCl、KI混合溶液中滴加1~2滴0.01 mol/L AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp小
⑧饱和石灰水中加入生石灰,若温度不变,则溶液中Ca2+的物质的量不变
⑨向饱和AgCl水溶液中加入盐酸,Ksp值变大
⑩AgCl的Ksp=1.80×10-10,将0.002mol·L-1的NaCl和0.002mol·L-1的AgNO3溶液等体积混合,有AgCl沉淀生成
⑪在T℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示,T℃时,在Y点和Z点,Ag2CrO4的Ksp相等

⑫25 ℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9,向BaSO4的悬浊液中加入Na2CO3的浓溶液,BaSO4不可能转化为BaCO3
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】钼酸钠晶体(Na2MoO4·2H2O)是一种金属腐蚀抑制剂。如图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图。
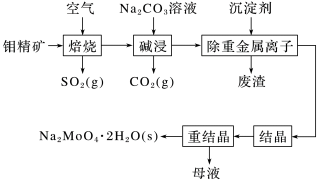
“结晶”前需向滤液中加入Ba(OH)2固体以除去 。若滤液中c(MoO
。若滤液中c(MoO )=0.40mol·L-1,c(
)=0.40mol·L-1,c( )=0.10mol/L,当BaMoO4开始沉淀时,
)=0.10mol/L,当BaMoO4开始沉淀时, 的去除率是
的去除率是___________ %[已知:Ksp(BaCO3)=1.0×10-9,Ksp(BaMoO4)=4.0×10-8,溶液体积变化忽略不计]。

“结晶”前需向滤液中加入Ba(OH)2固体以除去
 。若滤液中c(MoO
。若滤液中c(MoO )=0.40mol·L-1,c(
)=0.40mol·L-1,c( )=0.10mol/L,当BaMoO4开始沉淀时,
)=0.10mol/L,当BaMoO4开始沉淀时, 的去除率是
的去除率是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】化学在生产生活中有着广泛的应用,请回答下列问题:
(1)家里常用的物品有①厕所清洁剂 ②厨房清洁剂 ③食醋 ④肥皂 ⑤苏打水,其中呈碱性的有________ (填序号)。
(2)浓度均为0.1mol/L的5种溶液:①氨水 ② ③
③ ④
④ ⑤
⑤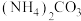 ,其中
,其中 由大到小的顺序为
由大到小的顺序为_________ (用序号表示)。
(3)水垢中含有 ,难用酸除去,可先用
,难用酸除去,可先用 溶液浸泡处理后转化为疏松、易溶于酸的
溶液浸泡处理后转化为疏松、易溶于酸的 ,再用酸处理。用
,再用酸处理。用 溶液浸泡处理的反应为
溶液浸泡处理的反应为__________ (用离子方程式表示)。
(4)牙齿表面有一层坚硬的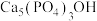 (羟基磷灰石)物质保护着。它在唾液中存在下列平衡:
(羟基磷灰石)物质保护着。它在唾液中存在下列平衡: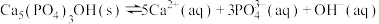 。当人进食后,口腔中的细菌在分解食物的过程中会产生有机酸,这时牙齿就会受到腐蚀,其原因是
。当人进食后,口腔中的细菌在分解食物的过程中会产生有机酸,这时牙齿就会受到腐蚀,其原因是_________________ 。
(1)家里常用的物品有①厕所清洁剂 ②厨房清洁剂 ③食醋 ④肥皂 ⑤苏打水,其中呈碱性的有
(2)浓度均为0.1mol/L的5种溶液:①氨水 ②
 ③
③ ④
④ ⑤
⑤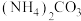 ,其中
,其中 由大到小的顺序为
由大到小的顺序为(3)水垢中含有
 ,难用酸除去,可先用
,难用酸除去,可先用 溶液浸泡处理后转化为疏松、易溶于酸的
溶液浸泡处理后转化为疏松、易溶于酸的 ,再用酸处理。用
,再用酸处理。用 溶液浸泡处理的反应为
溶液浸泡处理的反应为(4)牙齿表面有一层坚硬的
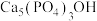 (羟基磷灰石)物质保护着。它在唾液中存在下列平衡:
(羟基磷灰石)物质保护着。它在唾液中存在下列平衡: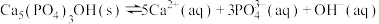 。当人进食后,口腔中的细菌在分解食物的过程中会产生有机酸,这时牙齿就会受到腐蚀,其原因是
。当人进食后,口腔中的细菌在分解食物的过程中会产生有机酸,这时牙齿就会受到腐蚀,其原因是
您最近一年使用:0次

 溶液中溶解
溶液中溶解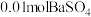 ,则
,则 溶液的最初浓度不得低于
溶液的最初浓度不得低于 (忽略溶液体积变化)[已知:常温下
(忽略溶液体积变化)[已知:常温下 、
、 ]。
]。


