名校
1 . 利用如图所示装置,可以模拟铁的电化学腐蚀,下列说法不正确的是( )
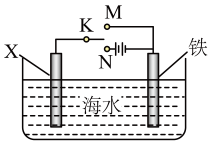

| A.若X为碳棒,为减慢铁的腐蚀,开关K应置于N处 |
| B.若X为锌棒,K置于M或N处,均能减慢铁的腐蚀 |
| C.若X为碳棒,将开关K置于M处时铁棒上发生的反应为Fe-2e-=Fe2+ |
| D.若X为锌棒,将开关K置于N处时铁棒上发生的反应为Fe-2e-=Fe2+ |
您最近一年使用:0次
2019-09-02更新
|
274次组卷
|
3卷引用:甘肃省天水市一中2020届高三上学期第四次考试化学试题
12-13高三上·北京西城·期末
名校
2 . 下图所示的实验,能达到实验目的的是( )
A.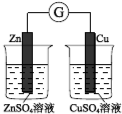 验证化学能转化为电能 验证化学能转化为电能 |
B.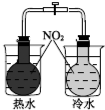 证明温度对平衡移动的影响 证明温度对平衡移动的影响 |
C.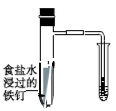 验证铁发生析氢腐蚀 验证铁发生析氢腐蚀 |
D. 验证AgCl溶解度大于Ag2S 验证AgCl溶解度大于Ag2S |
您最近一年使用:0次
2019-01-30更新
|
1052次组卷
|
6卷引用:甘肃省平凉市泾川市2019届高三模拟测试化学试题
甘肃省平凉市泾川市2019届高三模拟测试化学试题(已下线)2012届北京市西城区高三上学期期末考试化学试卷(已下线)2012届上海市十校高三第二次联考化学试卷(已下线)2014届湖南省十三校高三3月第一次联考化学试卷(已下线)2013届北京四中高三上学期开学检测化学试卷2016届海南省农垦中学高三考前押题理综化学试卷
11-12高三·甘肃天水·阶段练习
名校
解题方法
3 . 下列有关金属的腐蚀与防护的说法中,不正确的是
| A.在铁管外壁上镀锌可防止其被腐蚀 | B.金属被腐蚀的本质是金属发生了氧化反应 |
| C.温度越高,金属腐蚀速率越快 | D.将钢闸门与直流电源的正极相连可防止其被腐蚀 |
您最近一年使用:0次
2019-01-06更新
|
631次组卷
|
5卷引用:2013届甘肃省甘谷一中高三第四次检测化学试卷
(已下线)2013届甘肃省甘谷一中高三第四次检测化学试卷(已下线)2013-2014福建省安溪八中高二下学期期末考试化学试卷浙江省宁波市咸祥中学2018-2019学年高二上学期期中考试化学试题海南省儋州一中2018-2019学年高二上学期第二次月考化学试题福建省南安第一中学2019-2020学年高二上学期第二次月考化学(学考)试题
名校
解题方法
4 . 铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中不正确的
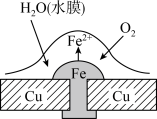

| A.此过程中铜并不被腐蚀 |
| B.此过程中正极电极反应式为:2H++2e- = H2↑ |
| C.此过程中电子从Fe移向Cu |
| D.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
您最近一年使用:0次
2018-07-20更新
|
695次组卷
|
9卷引用:甘肃省临夏中学2018-2019学年高二下学期期中考试化学试题
甘肃省临夏中学2018-2019学年高二下学期期中考试化学试题【全国百强校】黑龙江省哈尔滨师范大学附属中学2017-2018学年高二下学期期末考试化学试题(已下线)《2018-2019学年同步单元双基双测AB卷》第四单元 电化学基础单元测试A卷鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第4节 金属的腐蚀与防护高中必刷题高二选择性必修1第四章 化学反应与电能 第三节 金属的腐蚀与防护陕西省渭南市临渭区尚德中学2020-2021学年高二上学期第一次月考化学试题海南省万宁市北京师范大学万宁附属中学2020-2021学年高二上学期第一次月考化学试题选择性必修1专题1第三单元 金属的腐蚀与防护1.3金属的腐蚀和防护 课中
5 . 根据有关知识回答下列问题。
(Ⅰ)研究CO2的利用具有现实意义,比如将CO2与焦炭作用生成CO,CO可用于炼铁、设计燃料电池等。
(1)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH 1 =+489 kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH 2 = +172 kJ/mol
写出Fe2O3和CO为原料冶炼铁的热化学方程式___________________________ 。
(2)利用CO燃烧反应可设计成CO/O2燃料电池(以H2SO4溶液为电解质溶液),写出该电池的正极反应式_____________________________________ 。
(Ⅱ)初中我们学过铜不能与稀硫酸反应。某学生利用上述CO/O2燃料电池设计了如图所示装置(框内部分未画出),实现了铜与稀硫酸的反应:Cu+H2SO4=H2↑+CuSO4(未注明反应条件)。回答下列问题。

(3)A是石墨棒,B是一种金属,该金属是________ (填名称)。
(4)B应接电源的________ 极(填“通入CO”或“通入O2”)。
(5)写出该装置中发生还原反应的电极反应式___________________________________ 。
(6)若C溶液为100mL饱和食盐水,A和B电极均为石墨棒,该学生连通电路,写出烧杯中反应的离子方程式_________________ ,当放出标况下112mL氢气时,该溶液的pH=_____________ (室温下)。
(Ⅲ)将(Ⅱ)中装置改造成下图装置,可以模拟铁的电化学防护。
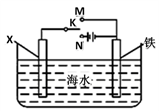
(7)若X为铜,为减缓铁的腐蚀,开关K应置于______ 处。
(8)若X为锌棒,开关K置于M处,该电化学防护法称为________________ 。
(Ⅰ)研究CO2的利用具有现实意义,比如将CO2与焦炭作用生成CO,CO可用于炼铁、设计燃料电池等。
(1)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH 1 =+489 kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH 2 = +172 kJ/mol
写出Fe2O3和CO为原料冶炼铁的热化学方程式
(2)利用CO燃烧反应可设计成CO/O2燃料电池(以H2SO4溶液为电解质溶液),写出该电池的正极反应式
(Ⅱ)初中我们学过铜不能与稀硫酸反应。某学生利用上述CO/O2燃料电池设计了如图所示装置(框内部分未画出),实现了铜与稀硫酸的反应:Cu+H2SO4=H2↑+CuSO4(未注明反应条件)。回答下列问题。

(3)A是石墨棒,B是一种金属,该金属是
(4)B应接电源的
(5)写出该装置中发生还原反应的电极反应式
(6)若C溶液为100mL饱和食盐水,A和B电极均为石墨棒,该学生连通电路,写出烧杯中反应的离子方程式
(Ⅲ)将(Ⅱ)中装置改造成下图装置,可以模拟铁的电化学防护。

(7)若X为铜,为减缓铁的腐蚀,开关K应置于
(8)若X为锌棒,开关K置于M处,该电化学防护法称为
您最近一年使用:0次
2018-03-13更新
|
251次组卷
|
2卷引用:甘肃省武威市民勤县第四中学2020-2021学年高二下学期第一次月考化学(实验班)试题
6 . 下列有关金属电化学腐蚀的说法正确的是
| A.铜既可以发生析氢腐蚀也可以发生吸氧腐蚀 | B.铁只能发生析氢腐蚀 |
| C.铜只能发生吸氧腐蚀 | D.析氢腐蚀比吸氧腐蚀普遍 |
您最近一年使用:0次
2016-12-09更新
|
177次组卷
|
3卷引用:2017届甘肃省天水一中高三上学期第一次月考化学卷
2017届甘肃省天水一中高三上学期第一次月考化学卷(已下线)1.3.1 金属的电化学腐蚀(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)作业(八) 金属的腐蚀与防护
名校
解题方法
7 . 下列关于金属腐蚀的叙述正确的是
| A.金属腐蚀的实质是金属的原子失去电子变成金属离子 |
| B.金属的化学腐蚀必需在酸性条件下进行 |
| C.金属腐蚀的快慢与温度高低无关 |
| D.钢铁在弱酸性或中性环境腐蚀时,正极上发生的反应是2H++2e-=H2↑ |
您最近一年使用:0次
2016-12-09更新
|
110次组卷
|
2卷引用:甘肃省永昌县第一高级中学2020-2021学年高二上学期期中考试化学(文)试题
真题
解题方法
8 . 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(1)原子序数为29的铜元素位于元素周期表中第_____ 周期。
(2)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为____ 。
(3)研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是_____ 。
(4)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为___________ 。
(5)下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。

①腐蚀过程中,负极是______ (填图中字母“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈u2(OH)3Cl,其离子方程式为____________ ;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为____ L(标准状况)。
(1)原子序数为29的铜元素位于元素周期表中第
(2)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为
(3)研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是
| A.降低了反应的活化能 | B.增大了反应的速率 |
| C.降低了反应的焓变 | D.增大了反应的平衡常数 |
(4)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为
(5)下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。

①腐蚀过程中,负极是
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈u2(OH)3Cl,其离子方程式为
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为
您最近一年使用:0次
2016-12-09更新
|
2068次组卷
|
3卷引用:甘肃省兰州市第五十八中学2018-2019学年高二(理科)第一学期期末考试化学试题
13-14高二·全国·课时练习
名校
解题方法
9 . 下列有关金属腐蚀与防护的说法正确的是
| A.钢铁发生电化学腐蚀时,负极反应为Fe-3e-=Fe3+ |
| B.镀锡铁制品和镀锌铁制品的镀层破损时,镀锡铁制品中铁的腐蚀速率更快 |
| C.在轮船船体四周镶嵌锌块保护船体不受腐蚀的方法叫阳极电化学保护法 |
| D.不锈钢有较强的抗腐蚀能力是因为在钢铁表面镀上了铬 |
您最近一年使用:0次
2016-12-09更新
|
1300次组卷
|
3卷引用:2015-2016学年甘肃省天水一中高二上期中(文)化学试卷
2013·上海浦东新·三模
名校
10 . 铁在下列四种情况中腐蚀速率判断正确的是( )


| A.a>b>c>d | B.b>a>d>c |
| C.d>c>b>a | D.b>d>a>c |
您最近一年使用:0次
2016-12-09更新
|
745次组卷
|
6卷引用:甘肃省天水市甘谷第一中学2019-2020学年高二下学期开学考试化学试题



