名校
解题方法
1 . 某小组同学利用原电池装置探究物质的性质。资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用表中装置进行实验并记录。
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其负极反应式是___ 。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是___ ;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___ 。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是___ 。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究___ 对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是___ 。
(1)同学们利用表中装置进行实验并记录。
| 装置 | 编号 | 电极A | 溶液B | 操作及现象 |
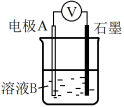 | Ⅰ | Fe | pH=2 H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
| Ⅱ | Cu | pH=2 H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。
| 编号 | 溶液B | 操作及现象 |
| Ⅲ | 经煮沸的pH=2的H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
| Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
| Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究
您最近一年使用:0次
解题方法
2 . 某化学兴趣小组设计了如下实验,探究铁的电化学腐蚀及防护原理。
(1)甲同学利用下图装置,进行铁的电化学腐蚀原理探究。
查阅资料:1.Fe2+遇K3[Fe(CN)6]溶液生成蓝色沉淀。
2.K3[Fe(CN)6]具有氧化性。
①用电极反应式解释实验ⅱ中的现象:_______ 。
②乙同学认为仅通过ⅲ中现象不能证明铁发生了电化学腐蚀,理由是_______ 。
③为验证猜想,乙同学设计了ⅳ、ⅴ、ⅵ三组对比实验,并记录如下:
a.以上实验表明:在Cl−存在条件下,K3[Fe(CN)6]溶液可以与铁片发生反应。
b.为探究Cl−的存在对反应的影响:乙同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验ⅵ,发现铁片表面产生蓝色沉淀。此补充实验表明 Cl−的作用是_______ 。
④结合上述两位同学的实验探究,请你改进甲同学步骤ⅲ的操作:_______ ,以证明铁发生了电化学腐蚀。
(2)丙同学向如图所示装置的容器a、b中分别加入30 mL3.5%的NaCl溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。
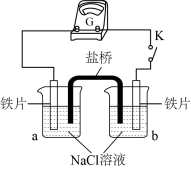
实验检测表明:容器a中的溶液产生了Fe2+,而容器b中的溶液不存在Fe2+。则:容器b中铁片做_______ 极(填:“正”或“负”)。加热后,电流计指针发生偏转的原因可能是_______ 。
(3)金属阳极钝化是一种电化学防护方法。将Fe作阳极置于H2SO4溶液中,一定条件下, Fe钝化形成致密Fe3O4氧化膜,则阳极的电极反应式为_______ 。
(1)甲同学利用下图装置,进行铁的电化学腐蚀原理探究。
| 装置 | 实验步骤及操作 | 现象 |
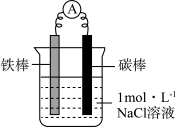 | ⅰ.连好装置,观察 | 电流表指针偏转 |
| ⅱ.一段时间后,向烧杯中滴加酚酞 | 碳棒附近溶液变红 | |
| ⅲ.一段时间后,向烧杯中滴加铁氰化钾 (K3[Fe(CN)6])溶液 | 铁片表面产生蓝色沉淀 |
2.K3[Fe(CN)6]具有氧化性。
①用电极反应式解释实验ⅱ中的现象:
②乙同学认为仅通过ⅲ中现象不能证明铁发生了电化学腐蚀,理由是
③为验证猜想,乙同学设计了ⅳ、ⅴ、ⅵ三组对比实验,并记录如下:
| 实验 | 滴管 | 试管 | 现象 |
 | 0.5 mol·L−1 K3[Fe(CN)6] 溶液 | ⅳ.蒸馏水 | 无明显变化 |
| ⅴ. 1.0 mol·L−1 NaCl 溶液 | 铁片表面产生大量蓝色沉淀 | ||
| ⅵ.0.5 mol·L−1 Na2SO4溶液 | 无明显变化 |
b.为探究Cl−的存在对反应的影响:乙同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验ⅵ,发现铁片表面产生蓝色沉淀。此补充实验表明 Cl−的作用是
④结合上述两位同学的实验探究,请你改进甲同学步骤ⅲ的操作:
(2)丙同学向如图所示装置的容器a、b中分别加入30 mL3.5%的NaCl溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。

实验检测表明:容器a中的溶液产生了Fe2+,而容器b中的溶液不存在Fe2+。则:容器b中铁片做
(3)金属阳极钝化是一种电化学防护方法。将Fe作阳极置于H2SO4溶液中,一定条件下, Fe钝化形成致密Fe3O4氧化膜,则阳极的电极反应式为
您最近一年使用:0次
2022-09-06更新
|
159次组卷
|
2卷引用:福建省宁德市部分达标中学2021-2022学年高二上学期期中联合考试化学试题
名校
3 . 某小组同学利用原电池装置探究物质的性质。资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是_____________ 。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是_______ ;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___________ 。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是_____________ 。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究_____________________ 对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是_____________ 。
(1)同学们利用下表中装置进行实验并记录。
| 装置 | 编号 | 电极A | 溶液B | 操作及现象 |
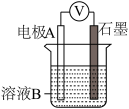 | Ⅰ | Fe | pH=2的H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
| Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。
| 编号 | 溶液B | 操作及现象 |
| Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
| Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
| Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究
您最近一年使用:0次
2019-11-21更新
|
1242次组卷
|
11卷引用:福建省厦门第一中学2020-2021学年高二10月月考化学试题
福建省厦门第一中学2020-2021学年高二10月月考化学试题福建省莆田第六中学2022-2023学年高二上学期第二次月考(B卷)化学试题江苏省苏州市张家港高级中学2019-2020学年高二上学期期中考试化学试题安徽省太和第一中学2019-2020学年高一下学期期末考试化学试题河北省承德市隆化存瑞中学2019-2020学年高一下学期期末测试化学试题(已下线)专题4.4 金属的电化学腐蚀与防护-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)4.4 金属的电化学腐蚀与防护(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)第4章 化学反应与电能(章末检测)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第4章 电化学基础(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)(已下线)【教材实验热点】09 化学能与电能河北省石家庄市第四十二中学2022-2023高二上学期10月月考化学试题
4 . 某研究性学习小组设计了如图装置探究钢铁的腐蚀与防护。
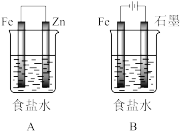
(1)装置A的保护方法称为___________ ;装置B中总反应的离子方程为___________ 。
(2)为验证装置A的保护方法,实验小组进行了如下实验(烧杯内均为经过酸化的3% 溶液)。
溶液)。
查阅资料:
①铁氰化钾 俗称赤血盐钾,可溶于水,其水溶液中含有铁氰根配离子
俗称赤血盐钾,可溶于水,其水溶液中含有铁氰根配离子 。
。
②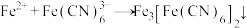 (蓝色沉淀)
(蓝色沉淀)
实验a: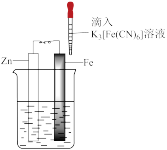
 Fe表面生成蓝色沉淀
Fe表面生成蓝色沉淀
实验b:

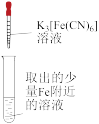
 试管无明显变化
试管无明显变化
实验a中,蓝色沉淀出现,证明溶液中存在___________ (填微粒化学符号)。
实验小组对该微粒来源进行了探究。
假设一: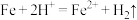
假设二:___________ (用文字表述即可)
对比a和b两组实验,可推断假设一不成立。
将Zn换成Cu,___________ (填“能”或“不能”)直接以实验a判断 比
比 活泼。
活泼。
为了进一步验证装置A的保护方法,实验小组进行了实验c。
实验c: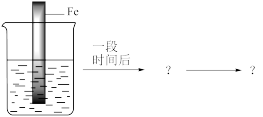
请参照实验a、实验b以文图形式完善实验c__________ 。

(1)装置A的保护方法称为
(2)为验证装置A的保护方法,实验小组进行了如下实验(烧杯内均为经过酸化的3%
 溶液)。
溶液)。查阅资料:
①铁氰化钾
 俗称赤血盐钾,可溶于水,其水溶液中含有铁氰根配离子
俗称赤血盐钾,可溶于水,其水溶液中含有铁氰根配离子 。
。②
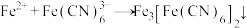 (蓝色沉淀)
(蓝色沉淀)实验a:

 Fe表面生成蓝色沉淀
Fe表面生成蓝色沉淀实验b:


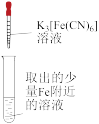
 试管无明显变化
试管无明显变化实验a中,蓝色沉淀出现,证明溶液中存在
实验小组对该微粒来源进行了探究。
假设一:
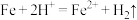
假设二:
对比a和b两组实验,可推断假设一不成立。
将Zn换成Cu,
 比
比 活泼。
活泼。为了进一步验证装置A的保护方法,实验小组进行了实验c。
实验c:
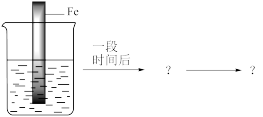
请参照实验a、实验b以文图形式完善实验c
您最近一年使用:0次
5 . 生活中常常会涉及到一些化学知识。下列叙述中正确的是
| A.纯铁比生铁易生锈 |
| B.硅胶是食品包装袋中常用的干燥剂 |
| C.“84”消毒液与医用酒精都是因氧化性而使蛋白质变性 |
| D.酸雨是指pH<7的降水,主要是由于空气中SO2含量偏高引起 |
您最近一年使用:0次
6 . 按要求回答问题
(1)一种电解法制备高纯铬和硫酸的简单装置如图所示,请回答下列问题。
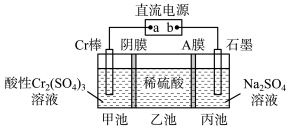
a为直流电源的_______ (填“正”或“负”)极;阳极反应式为_______ 工作时乙池中溶液的
_______ (填“增大”、“减小”或“不变”);若有 离子通过A膜,理论上阳极生成
离子通过A膜,理论上阳极生成_______  气体。
气体。
(2)为了验证 与
与 氧化性强弱,图中装置能达到实验目的是
氧化性强弱,图中装置能达到实验目的是_______ (填序号)。

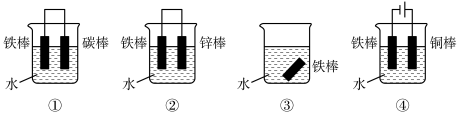
(3)图中各个装置中铁棒被腐蚀由易到难的顺序是_______ 。
(4)甲醇( )燃料电池,两电极均为铂网,电解质溶液为
)燃料电池,两电极均为铂网,电解质溶液为 ,写出该原电池负极的电极反应式为
,写出该原电池负极的电极反应式为_______ 。
(1)一种电解法制备高纯铬和硫酸的简单装置如图所示,请回答下列问题。

a为直流电源的

 离子通过A膜,理论上阳极生成
离子通过A膜,理论上阳极生成 气体。
气体。(2)为了验证
 与
与 氧化性强弱,图中装置能达到实验目的是
氧化性强弱,图中装置能达到实验目的是
(3)图中各个装置中铁棒被腐蚀由易到难的顺序是

(4)甲醇(
 )燃料电池,两电极均为铂网,电解质溶液为
)燃料电池,两电极均为铂网,电解质溶液为 ,写出该原电池负极的电极反应式为
,写出该原电池负极的电极反应式为
您最近一年使用:0次
2022-03-20更新
|
150次组卷
|
3卷引用:福建省福州华侨中学2021-2022学年高二上学期期中考试化学试题
名校
7 . 电化学在实际生活生产中十分常见,如金属的腐蚀及防护,利用电化学合成物质、处理废水等等。
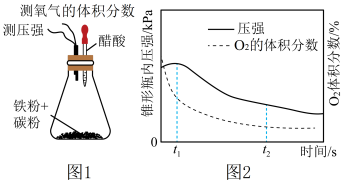
(1)按图1进行实验,测得锥形瓶内气压和空气中氧气的体积分数随时间变化如图2所示, 之间主要发生
之间主要发生___________ (填“吸氧”或“析氢”)腐蚀,其正极反应式为___________ 。
(2)金属阳极钝化是一种电化学防护方法。将 作阳极置于一定浓度的
作阳极置于一定浓度的 溶液中,一定条件下,
溶液中,一定条件下, 钝化形成致密
钝化形成致密 氧化膜,试写出该阳极的电极反应
氧化膜,试写出该阳极的电极反应___________ 。
(3)氯碱工业能耗大,通过如图改进的设计可大幅度降低能耗。
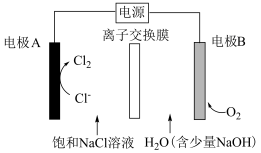
①离子交换膜应选择___________ 离子交换膜(填“阴”或“阳”)
②反应的总化学方程式为___________ 。
③当电路中通过 电子时,右侧溶液质量
电子时,右侧溶液质量______ (填“增加”或“减少”)_____  。
。
(1)按图1进行实验,测得锥形瓶内气压和空气中氧气的体积分数随时间变化如图2所示,
 之间主要发生
之间主要发生
(2)金属阳极钝化是一种电化学防护方法。将
 作阳极置于一定浓度的
作阳极置于一定浓度的 溶液中,一定条件下,
溶液中,一定条件下, 钝化形成致密
钝化形成致密 氧化膜,试写出该阳极的电极反应
氧化膜,试写出该阳极的电极反应(3)氯碱工业能耗大,通过如图改进的设计可大幅度降低能耗。

①离子交换膜应选择
②反应的总化学方程式为
③当电路中通过
 电子时,右侧溶液质量
电子时,右侧溶液质量 。
。
您最近一年使用:0次
名校
解题方法
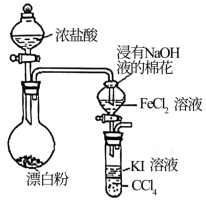
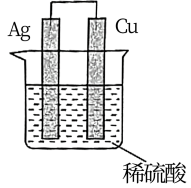
8 . 下列装置或措施能达到目的的是
A | B |
|
|
验证氧化性:Cl2>Fe3+>I2 | 实现Cu+H2SO4=CuSO4+H2↑ |
C | D |
|
|
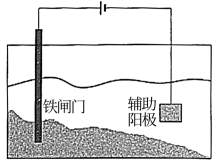
| 测定反应速率 | 保护铁闸门不被腐蚀 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-01-25更新
|
895次组卷
|
5卷引用:福建泉州实验中学2021-2022学年高三上学期12月月考化学试题
名校
解题方法
9 . 如图所示,水槽中的试管内有一枚铁钉,放置一星期观察现象。
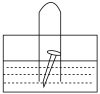
(1)铁钉逐渐生锈,铁钉的腐蚀属于___________ 腐蚀(填“化学”或“电化学”)。
(2)若试管内液面上升,则原溶液呈___________ ,发生___________ 腐蚀(填“析氢”或“吸氧”),生成具有还原性的___________ (填化学式),在空气中的水和氧气的共同作用下生成氢氧化铁,反应方程式为 ___________ 。进一步转化为铁锈,铁锈的主要成分为___________ (填化学式)。
(3)若试管内液面下降,则原溶液呈___________ ,发生___________ 腐蚀(填“析氢”或“吸氧”),电极反应式:负极为___________ 。
(4)若水槽中液体甲为蒸馏水,液体乙为海水,则铁钉在___________ (填“甲”或“乙”)溶液中腐蚀的速率快。
(5)请根据电化学腐蚀的原理,设计出各种防护方法:设计了阻止铁钉成为原电池的负极反应物的防护方法,称为___________ (填名称);设计了避免铁钉发生氧化反应而溶解的防护方法,称为___________ (填名称),还可以使铁钉表面___________ 而使内部金属得到保护,如合成氨厂用来防止反应塔腐蚀。

(1)铁钉逐渐生锈,铁钉的腐蚀属于
(2)若试管内液面上升,则原溶液呈
(3)若试管内液面下降,则原溶液呈
(4)若水槽中液体甲为蒸馏水,液体乙为海水,则铁钉在
(5)请根据电化学腐蚀的原理,设计出各种防护方法:设计了阻止铁钉成为原电池的负极反应物的防护方法,称为
您最近一年使用:0次
2021-10-13更新
|
92次组卷
|
3卷引用:福建省三明第一中学2021-2022学年高二上学期第一次月考化学试题
名校
10 . 下列实验装置或操作设计正确,且能达到目的的是
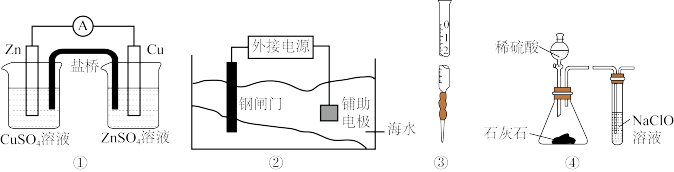

| A.实验①,设计铜锌双液原电池 |
| B.实验②,将钢闸门与外接电源的负极相连,可防止钢闸门腐蚀 |
| C.实验③,准确量取一定体积KMnO4标准溶液 |
| D.实验④,可用于证明酸性:H2SO4>H2CO3>HClO |
您最近一年使用:0次