名校
解题方法
1 . 下列四个装置中都用到了金属铜,下列有关说法正确的是
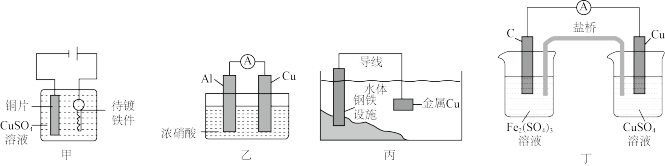

| A.用图甲装置可在铁件上镀铜 |
B.用图乙装置可证明活泼性: |
| C.用图丙装置可实现牺牲Cu电极保护钢铁设施 |
D.用图丁装置可实现化学能向电能的转化,且C极的电极反应式是 |
您最近一年使用:0次
2022-09-02更新
|
497次组卷
|
6卷引用:福建省莆田华侨中学2022-2023学年高二上学期期中考试化学试题
福建省莆田华侨中学2022-2023学年高二上学期期中考试化学试题福建省泉州科技中学2023-2024学年高二上学期第一次限时训练化学试题安徽省亳州市2021-2022学年高二上学期期末考试化学试题(已下线)4.3 金属的腐蚀与防护-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)广东省兴宁市沐彬中学2022-2023学年高二上学期期中考试化学试题广东省汕尾市2022-2023学年高二上学期期末考试化学试题
名校
解题方法
2 . 某小相同学为探究电极对金属腐蚀与防护的影响,设计如下实验:将饱和食盐水与琼脂(凝固剂,不参与反应)的混合液置于两个培养皿中,向其中滴入少量酚酞溶液和 溶液,混合均匀,分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如表。已知:
溶液,混合均匀,分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如表。已知: 遇到
遇到 能产生蓝色沉淀,对有关实验现象及分析不正确的是
能产生蓝色沉淀,对有关实验现象及分析不正确的是
 溶液,混合均匀,分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如表。已知:
溶液,混合均匀,分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如表。已知: 遇到
遇到 能产生蓝色沉淀,对有关实验现象及分析不正确的是
能产生蓝色沉淀,对有关实验现象及分析不正确的是变红变蓝 | 变红 |
| ⅰ.包裹铜片的铁钉 | ⅱ.包裹锌片的铁钉 |
| A.两个培养皿中金属均发生吸氧腐蚀,且铁钉腐蚀速度ⅰ快 |
| B.该实验证明,若给金属表面镀活泼性比被保护金属强的金属,则破损后依旧可以防护 |
| C.培养皿ⅱ中对铁钉的防护是牺牲阳极的阴极保护法 |
| D.随着反应的进行,培养皿ⅰ和ⅱ中均出现红褐色浑浊 |
您最近一年使用:0次
2023-11-16更新
|
396次组卷
|
2卷引用:福建省龙岩第一中学2023-2024学年高二上学期第三次月考化学试题
名校
解题方法
3 . 下列实验方案能达到实验目的的是
| 实验方案 | 实验目的 | |
| A | 白铁皮(镀锌铁)出现刮痕后浸泡在食盐水中,一段时间后浸泡液中滴入几滴 | 探究上述过程铁是否发生腐蚀 |
| B | 将 (强氧化剂)固体溶于水后,加入浓盐酸 (强氧化剂)固体溶于水后,加入浓盐酸 | 证明 溶液存在平衡: 溶液存在平衡: + + ⇌ ⇌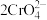 + + |
| C | 用两支试管各取 的 的 溶液,分别加入10滴 溶液,分别加入10滴 和 和 的草酸(H2C2O4)溶液,记录溶液褪色所需的时间 的草酸(H2C2O4)溶液,记录溶液褪色所需的时间 | 探究反应物浓度对反应速率的影响 |
| D | 分别在20℃、30℃下,向 溶液中依次加入 溶液中依次加入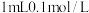 硫酸和2滴淀粉溶液 硫酸和2滴淀粉溶液 | 探究温度对4I-+O2+4H+=2I2+2H2O反应速率的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 电能是现代社会应用最广泛的能源之一、某原电池装置如图所示,A为电流表。
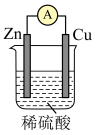
(1)Zn电极为原电池的___________ 极(填“正”或“负”),电极反应式是___________ 。
(2)Cu电极上发生的反应属于___________ (填“氧化”或“还原)反应,当铜表面析出4.48L氢气(标准状况)时,导线中通过了___________ mol电子。
(3)能证明化学能转化为电能的实验现象是:铜片上有气泡产生、___________ 。
(4)下列反应通过原电池装置,可实现化学能直接转化为电能的是___________。
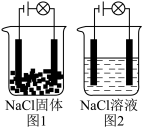
(5)如图所示是电解池装置中图1灯泡不亮,图2灯泡发亮,由此能得出的结论是___________。
(6)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上。金属防腐的方法很多,常用方法有___________。

(1)Zn电极为原电池的
(2)Cu电极上发生的反应属于
(3)能证明化学能转化为电能的实验现象是:铜片上有气泡产生、
(4)下列反应通过原电池装置,可实现化学能直接转化为电能的是___________。
A. | B. |
C.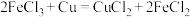 | D. |

| A.图1灯泡不亮的原因是NaCl没有发生电离 | B.图2灯泡亮说明NaCl溶液是电解质,能导电 |
| C.NaCl要发生电离必须有水存在 | D.电解质在电流的作用下才能发生电离 |
| A.喷涂油漆 | B.电镀金属 | C.电化学保护法 | D.制成不锈钢 |
您最近一年使用:0次
2023-10-11更新
|
182次组卷
|
2卷引用:福建省福州黎明中学2023-2024学年高二上学期11月期中考试化学试题
5 . 某研究性学习小组设计了如图装置探究钢铁的腐蚀与防护。
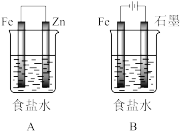
(1)装置A的保护方法称为___________ ;装置B中总反应的离子方程为___________ 。
(2)为验证装置A的保护方法,实验小组进行了如下实验(烧杯内均为经过酸化的3% 溶液)。
溶液)。
查阅资料:
①铁氰化钾 俗称赤血盐钾,可溶于水,其水溶液中含有铁氰根配离子
俗称赤血盐钾,可溶于水,其水溶液中含有铁氰根配离子 。
。
②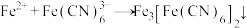 (蓝色沉淀)
(蓝色沉淀)
实验a: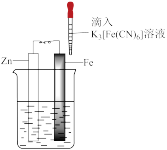
 Fe表面生成蓝色沉淀
Fe表面生成蓝色沉淀
实验b:

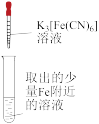
 试管无明显变化
试管无明显变化
实验a中,蓝色沉淀出现,证明溶液中存在___________ (填微粒化学符号)。
实验小组对该微粒来源进行了探究。
假设一: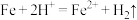
假设二:___________ (用文字表述即可)
对比a和b两组实验,可推断假设一不成立。
将Zn换成Cu,___________ (填“能”或“不能”)直接以实验a判断 比
比 活泼。
活泼。
为了进一步验证装置A的保护方法,实验小组进行了实验c。
实验c: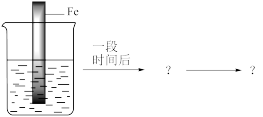
请参照实验a、实验b以文图形式完善实验c__________ 。

(1)装置A的保护方法称为
(2)为验证装置A的保护方法,实验小组进行了如下实验(烧杯内均为经过酸化的3%
 溶液)。
溶液)。查阅资料:
①铁氰化钾
 俗称赤血盐钾,可溶于水,其水溶液中含有铁氰根配离子
俗称赤血盐钾,可溶于水,其水溶液中含有铁氰根配离子 。
。②
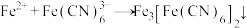 (蓝色沉淀)
(蓝色沉淀)实验a:

 Fe表面生成蓝色沉淀
Fe表面生成蓝色沉淀实验b:


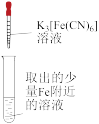
 试管无明显变化
试管无明显变化实验a中,蓝色沉淀出现,证明溶液中存在
实验小组对该微粒来源进行了探究。
假设一:
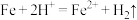
假设二:
对比a和b两组实验,可推断假设一不成立。
将Zn换成Cu,
 比
比 活泼。
活泼。为了进一步验证装置A的保护方法,实验小组进行了实验c。
实验c:
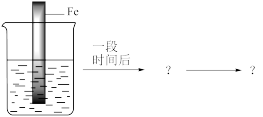
请参照实验a、实验b以文图形式完善实验c
您最近一年使用:0次
名校
解题方法
6 . 下列电化学装置能达到目的的是
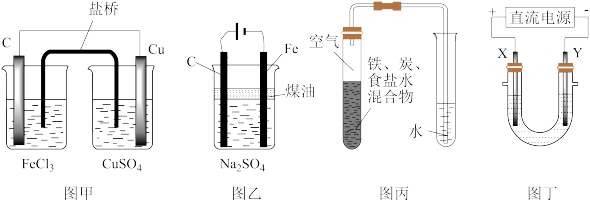

| A.图甲:实现原电池反应Cu+2Fe3+=Cu2++2Fe2+ | B.图乙:制取少量Fe(OH)2 |
| C.图丙:证明铁发生了析氢腐蚀 | D.图丁:电镀工业中,X是待镀金属 |
您最近一年使用:0次
2022-11-05更新
|
238次组卷
|
3卷引用:福建省莆田第二十五中学2023-2024学年高二上学期期中考试化学试题
7 . 下列装置能达到实验目的的是
| 选项 | A | B | C | D |
| 装置 | 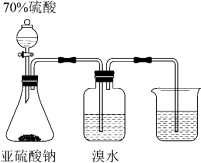 |  |  |  |
| 目的 | 验证 的漂白性 的漂白性 | 证明氨气的还原性 | 验证醋酸、碳酸、硅酸酸性的相对强弱 | 模拟钢铁的吸氧腐蚀 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-02-11更新
|
124次组卷
|
2卷引用:福建省名校联盟全国优质校2022届高三下学期2月大联考化学试题
解题方法
8 . 某化学兴趣小组设计了如下实验,探究铁的电化学腐蚀及防护原理。
(1)甲同学利用下图装置,进行铁的电化学腐蚀原理探究。
查阅资料:1.Fe2+遇K3[Fe(CN)6]溶液生成蓝色沉淀。
2.K3[Fe(CN)6]具有氧化性。
①用电极反应式解释实验ⅱ中的现象:_______ 。
②乙同学认为仅通过ⅲ中现象不能证明铁发生了电化学腐蚀,理由是_______ 。
③为验证猜想,乙同学设计了ⅳ、ⅴ、ⅵ三组对比实验,并记录如下:
a.以上实验表明:在Cl−存在条件下,K3[Fe(CN)6]溶液可以与铁片发生反应。
b.为探究Cl−的存在对反应的影响:乙同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验ⅵ,发现铁片表面产生蓝色沉淀。此补充实验表明 Cl−的作用是_______ 。
④结合上述两位同学的实验探究,请你改进甲同学步骤ⅲ的操作:_______ ,以证明铁发生了电化学腐蚀。
(2)丙同学向如图所示装置的容器a、b中分别加入30 mL3.5%的NaCl溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。
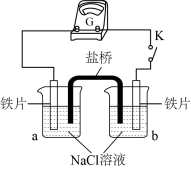
实验检测表明:容器a中的溶液产生了Fe2+,而容器b中的溶液不存在Fe2+。则:容器b中铁片做_______ 极(填:“正”或“负”)。加热后,电流计指针发生偏转的原因可能是_______ 。
(3)金属阳极钝化是一种电化学防护方法。将Fe作阳极置于H2SO4溶液中,一定条件下, Fe钝化形成致密Fe3O4氧化膜,则阳极的电极反应式为_______ 。
(1)甲同学利用下图装置,进行铁的电化学腐蚀原理探究。
| 装置 | 实验步骤及操作 | 现象 |
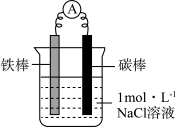 | ⅰ.连好装置,观察 | 电流表指针偏转 |
| ⅱ.一段时间后,向烧杯中滴加酚酞 | 碳棒附近溶液变红 | |
| ⅲ.一段时间后,向烧杯中滴加铁氰化钾 (K3[Fe(CN)6])溶液 | 铁片表面产生蓝色沉淀 |
2.K3[Fe(CN)6]具有氧化性。
①用电极反应式解释实验ⅱ中的现象:
②乙同学认为仅通过ⅲ中现象不能证明铁发生了电化学腐蚀,理由是
③为验证猜想,乙同学设计了ⅳ、ⅴ、ⅵ三组对比实验,并记录如下:
| 实验 | 滴管 | 试管 | 现象 |
 | 0.5 mol·L−1 K3[Fe(CN)6] 溶液 | ⅳ.蒸馏水 | 无明显变化 |
| ⅴ. 1.0 mol·L−1 NaCl 溶液 | 铁片表面产生大量蓝色沉淀 | ||
| ⅵ.0.5 mol·L−1 Na2SO4溶液 | 无明显变化 |
b.为探究Cl−的存在对反应的影响:乙同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验ⅵ,发现铁片表面产生蓝色沉淀。此补充实验表明 Cl−的作用是
④结合上述两位同学的实验探究,请你改进甲同学步骤ⅲ的操作:
(2)丙同学向如图所示装置的容器a、b中分别加入30 mL3.5%的NaCl溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。

实验检测表明:容器a中的溶液产生了Fe2+,而容器b中的溶液不存在Fe2+。则:容器b中铁片做
(3)金属阳极钝化是一种电化学防护方法。将Fe作阳极置于H2SO4溶液中,一定条件下, Fe钝化形成致密Fe3O4氧化膜,则阳极的电极反应式为
您最近一年使用:0次
2022-09-06更新
|
159次组卷
|
2卷引用:福建省宁德市部分达标中学2021-2022学年高二上学期期中联合考试化学试题
名校
9 . 下列实验装置或操作设计正确,且能达到目的的是
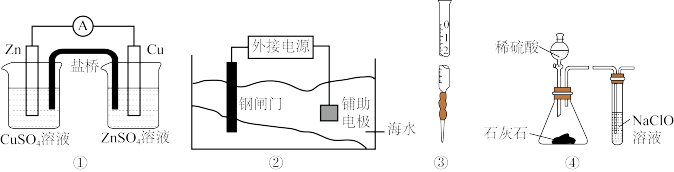

| A.实验①,设计铜锌双液原电池 |
| B.实验②,将钢闸门与外接电源的负极相连,可防止钢闸门腐蚀 |
| C.实验③,准确量取一定体积KMnO4标准溶液 |
| D.实验④,可用于证明酸性:H2SO4>H2CO3>HClO |
您最近一年使用:0次
名校
10 . 下列各项操作或现象能达到预期实验目的的是
| 选项 | 操作或现象 | 实验目的 |
| A | 将铁钉放入试管中,用盐酸浸没 | 验证铁的吸氧腐蚀 |
| B | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | 证明Br—还原性强于Cl— |
| C | 将氯化亚铁固体溶于适量蒸馏水中 | 配制FeCl2溶液 |
| D | 将混有氯化氢杂质的氯气通过装有饱和NaHCO3溶液的洗气瓶 | 除去氯气中的HCl气体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2016-01-14更新
|
199次组卷
|
5卷引用:福建省惠安惠南中学2019届高三上学期期中考试化学试题



