名校
1 . 完成下列小题
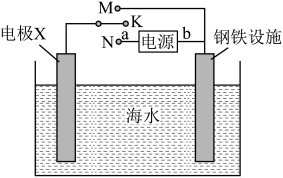
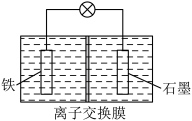
(1)电渗析法淡化海水(在直流电源作用下通过离子交换膜对海水进行处理)利用如图所示装置可以减缓海水中钢铁设施的腐蚀。若开关K置于M处,则电极X可选用的物质是_____ (选填“石墨块”、“锌块”或“铜块”;若开关K置于N处,则a极为电源的_____ (选填“正极”或“负极”),该金属防护方法被称为_____ (选填“牺牲阳极”或“外加电流”)的阴极保护法。 在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是_____ 。
①增加C的量②保持体积不变,充入N2使体系压强增大③将容器的体积缩小一半④保持压强不变,充入N2使容器体积变大
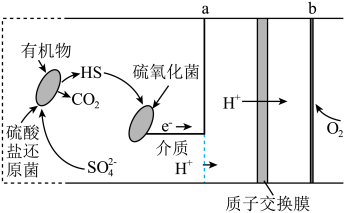
(3)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示。_____ 。
(4)采用石墨电极电解Na2CrO4溶液制备Na2Cr2O7,其原理如图所示。_____ (填氧化或者还原)产物,其化学式为_____ 。
②电解过程中,能透过离子交换膜的离子是_____ (填化学式),移动方向为_____ 。(填“从左向右”,或“从右向左”。)
(5)利用氧化还原滴定法测定Na2Cr2O7·2H2O产品的纯度。
称取含Na2Cr2O7·2H2O产品1.4000 g配成250 mL溶液,量取25.00 mL于碘量瓶中,加入10 mL2 mol/LH2SO4和足量碘化钾溶液(铬的还原产物为Cr3+),放于暗处5 min,加入淀粉溶液作指示剂,用[0.1000 mol/L Na2S2O3]标准溶液滴定 ,判断达到滴定终点的现象是
,判断达到滴定终点的现象是_____ 。若实验中平均消耗Na2S2O3标准溶液24.00 mL,计算重铬酸钠晶体的纯度为_____ 。(设整个过程中其他杂质不参与反应,结果保留4位有效数字)
(1)电渗析法淡化海水(在直流电源作用下通过离子交换膜对海水进行处理)利用如图所示装置可以减缓海水中钢铁设施的腐蚀。若开关K置于M处,则电极X可选用的物质是
 在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是①增加C的量②保持体积不变,充入N2使体系压强增大③将容器的体积缩小一半④保持压强不变,充入N2使容器体积变大
(3)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示。
(4)采用石墨电极电解Na2CrO4溶液制备Na2Cr2O7,其原理如图所示。
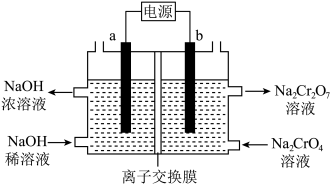
②电解过程中,能透过离子交换膜的离子是
(5)利用氧化还原滴定法测定Na2Cr2O7·2H2O产品的纯度。
称取含Na2Cr2O7·2H2O产品1.4000 g配成250 mL溶液,量取25.00 mL于碘量瓶中,加入10 mL2 mol/LH2SO4和足量碘化钾溶液(铬的还原产物为Cr3+),放于暗处5 min,加入淀粉溶液作指示剂,用[0.1000 mol/L Na2S2O3]标准溶液滴定
 ,判断达到滴定终点的现象是
,判断达到滴定终点的现象是
您最近一年使用:0次
名校
解题方法
2 . 下列有关金属腐蚀的说法不正确的是
| A.镀层破损的白铁皮(镀锌)比马口铁(镀锡)更易被腐蚀 |
| B.电解精炼粗铜时,阳极减少的质量与阴极增加的质量不一样 |
| C.用氯化铁溶液腐蚀铜板制作印刷电路板 |
| D.铝片经过浓硫酸处理后表面生成致密的氧化膜可保护铝 |
您最近一年使用:0次
解题方法
3 . 对金属腐蚀的研究意义重大,以铁为例进行研究。
(1)已知反应: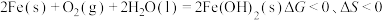 ,则其
,则其
_______ 0。
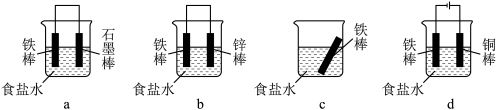
(2)下列哪些装置可防止铁棒被腐蚀_______ (填标号,下同)。 条件下三颈烧瓶中压强随时间变化关系如图3。
条件下三颈烧瓶中压强随时间变化关系如图3。_______ 。
a.反应相同时间,溶解氧随着溶液酸性减弱而增大
b.酸性条件下可发生吸氧腐蚀
c.整个过程中,负极电极反应式为: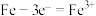
(4)①甲同学对图3中压强变化的原因进行了分析:导致压强增大的原因是 ,导致压强减小的原因是发生
,导致压强减小的原因是发生_______ (写电极方程式)。
②乙同学认为压强变化的原因也可能是发生了化学腐蚀:铁和盐酸反应产生氢气,导致压强增大;_______ ,导致压强减小。
③同学对图1装置进行改进,装置示意图如下(部分设备略去),以证明该条件下可发生电化学腐蚀,请完成装置设计。 溶液中,石墨电极插入
溶液中,石墨电极插入_______ 溶液中,压强传感器置于_______ 电极上方。
④400秒之后铁主要发生吸氧腐蚀的原因是_______ 。
(1)已知反应:
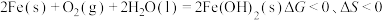 ,则其
,则其
(2)下列哪些装置可防止铁棒被腐蚀
 条件下三颈烧瓶中压强随时间变化关系如图3。
条件下三颈烧瓶中压强随时间变化关系如图3。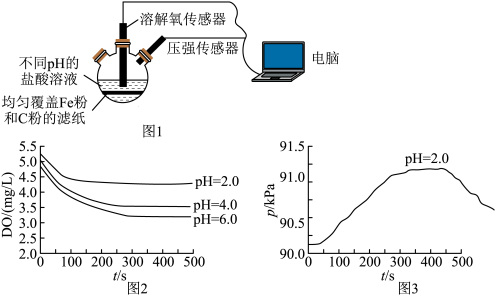
a.反应相同时间,溶解氧随着溶液酸性减弱而增大
b.酸性条件下可发生吸氧腐蚀
c.整个过程中,负极电极反应式为:
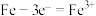
(4)①甲同学对图3中压强变化的原因进行了分析:导致压强增大的原因是
 ,导致压强减小的原因是发生
,导致压强减小的原因是发生②乙同学认为压强变化的原因也可能是发生了化学腐蚀:铁和盐酸反应产生氢气,导致压强增大;
③同学对图1装置进行改进,装置示意图如下(部分设备略去),以证明该条件下可发生电化学腐蚀,请完成装置设计。
 溶液中,石墨电极插入
溶液中,石墨电极插入④400秒之后铁主要发生吸氧腐蚀的原因是
您最近一年使用:0次
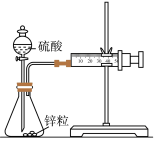
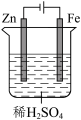
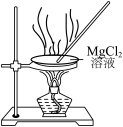
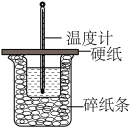
4 . 下列实验装置可以达到实验目的或描述正确的是
|
|
| A.测定锌与稀硫酸反应速率(计时器未画出) | B.使Fe表面腐蚀电流降至零或接近于零 |
|
|
| C.制备无水氯化镁 | D.测定中和反应的反应热 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
5 . 在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现。铁片腐蚀过程中发生反应的化学方程式为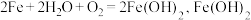 进一步被氧气氧化为
进一步被氧气氧化为 ,再在一定条件下脱水生成铁锈,其原理如图所示,回答下列问题:
,再在一定条件下脱水生成铁锈,其原理如图所示,回答下列问题: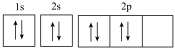 的表示法,下列说法正确的是
的表示法,下列说法正确的是___________ (填标号)。
A.违背了泡利原理 B.违背了能量最低原理 C.违背了洪特规则
(2)该铁片的腐蚀主要属于___________ (填“电化学”或“化学”)腐蚀。
(3)Fe(OH)3失去部分水生成___________ (填化学式),其为铁锈的主要成分,检验该铁锈中含有Fe3+的操作及现象为___________ 。
(4)食盐水的作用是___________ 。
(5)C电极上的电极反应式为___________ ;该电极上,每消耗0.2molO2,转移的电子的物质的量为___________ mol。
(6)生活中,常用化学方法在钢铁部件表面进行发蓝处理,处理后的钢铁表面生成了一层致密的___________ (填化学式)薄膜。
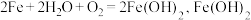 进一步被氧气氧化为
进一步被氧气氧化为 ,再在一定条件下脱水生成铁锈,其原理如图所示,回答下列问题:
,再在一定条件下脱水生成铁锈,其原理如图所示,回答下列问题:
 的表示法,下列说法正确的是
的表示法,下列说法正确的是A.违背了泡利原理 B.违背了能量最低原理 C.违背了洪特规则
(2)该铁片的腐蚀主要属于
(3)Fe(OH)3失去部分水生成
(4)食盐水的作用是
(5)C电极上的电极反应式为
(6)生活中,常用化学方法在钢铁部件表面进行发蓝处理,处理后的钢铁表面生成了一层致密的
您最近一年使用:0次
6 . 下列实验操作或实验方案,不能达到目的的是
| 选项 | 实验操作或实验方案 | 目的 |
| A | 将镀层有破损的镀锌铁片放入酸化的3%NaCl溶液中,一段时间后,加入K3[Fe(CN)6]溶液 | 检验牺牲阳极的阴极保护法对钢铁防腐的效果 |
| B | 把铁钉与电源负极相连,铜片与电源正极相连,两极平行插入CuSO4溶液中 | 在铁钉上镀铜 |
| C | 用Na2S2O3溶液分别与0.05mol·L-1、0.1mol·L-1的H2SO4溶液反应,记录出现浑浊的时间 | 探究浓度对反应速率的影响 |
| D | 向AgNO3与AgCl的混合浊液中加入少量KBr溶液,沉淀颜色变为浅黄色 | 证明Ksp(AgCl) > Ksp(AgBr) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7 . 我国有着丰富的海风资源,在海水中建立风电设备,防腐蚀是一个突出问题。下列说法正确的是
| A.可将钢铁构件与电源负极连接减缓腐蚀发生 |
| B.海水中发生化学腐蚀的速率大于电化学腐蚀速率 |
| C.钢铁发生吸氧腐蚀时负极发生的反应为Fe − 3e- = Fe3+ |
| D.钢铁构件表面的镀铜破损后依然会保护内部钢铁不被腐蚀 |
您最近一年使用:0次
8 . 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一、
(1)如图装置中,U形管内为红墨水,两试管内分别盛有氯化铵溶液(显酸性)和食盐水,各加入生铁块,放置一段时间均被腐蚀。_______ (填“a”或“b”)试管内盛有食盐水。
②a试管生铁中碳上发生的电极反应式为_______ 。
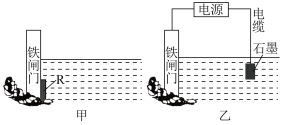
(2)如图甲、乙都是金属防护的例子。_______ (填字母),
A.铜 B.钠 C.锌 D.石墨
②图乙方案也可以降低铁闸门腐蚀的速率,此方法叫_______ 。
(3)实验室需用Fe、C棒设计一套装置来电解饱和NaCl溶液并检验两极生成的气体产物,则Fe棒应接直流电源的_______ (填“正极”或“负极”);电解开始后,阴极产物为_______ (填化学式)。
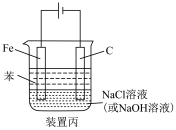
(4)装置丙可以用来制备氢氧化亚铁并且可以较长时间不被氧化,写出制备氢氧化亚铁的总反应式_______ 。
(1)如图装置中,U形管内为红墨水,两试管内分别盛有氯化铵溶液(显酸性)和食盐水,各加入生铁块,放置一段时间均被腐蚀。
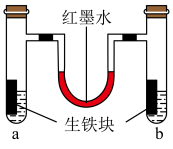
②a试管生铁中碳上发生的电极反应式为
(2)如图甲、乙都是金属防护的例子。
A.铜 B.钠 C.锌 D.石墨
②图乙方案也可以降低铁闸门腐蚀的速率,此方法叫
(3)实验室需用Fe、C棒设计一套装置来电解饱和NaCl溶液并检验两极生成的气体产物,则Fe棒应接直流电源的
(4)装置丙可以用来制备氢氧化亚铁并且可以较长时间不被氧化,写出制备氢氧化亚铁的总反应式
您最近一年使用:0次
9 . 下列图示装置不能达到相应目的的是
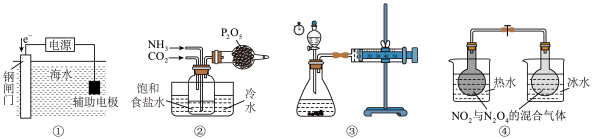
| A.用装置①保护钢闸门不被海水腐蚀 |
B.用装置②先通 再通足量 再通足量 ,制取 ,制取 晶体 晶体 |
| C.用装置③测碳酸钙与稀盐酸反应的化学反应速率 |
D.用装置④验证 是放热反应 是放热反应 |
您最近一年使用:0次
10 . 有关金属的腐蚀与防护,下列说法正确的是
| A.铁与电源正极连接可实现电化学保护 |
| B.当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀 |
| C.在钢铁表面进行发蓝处理,生成四氧化三铁薄膜保护金属 |
| D.阳极氧化处理铝制品生成致密的保护膜属于电化学保护法 |
您最近一年使用:0次