名校
1 . 铜是生物必需的微量元素,也是人类最早使用的金属之一、铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)写出铜与稀硝酸反应的化学方程式___________ 。
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用,写出溶出铜的离子方程式___________ 。
(3)工业上以黄铜矿为原料,采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2,该反应的氧化剂是
6Cu+SO2,该反应的氧化剂是___________ ;当生成19.2gCu时,反应中转移的电子为___________ mol。
(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜诱的主要成分为Cu2(OH)2CO3(碱式碳酸铜),试写出上述过程中负极的电极反应式___________ 。
(5)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取ag试样配成100mL溶液,每次取25.00mL,滴加KI溶液后有白色碘化物沉淀生成,写出该反应的离子方程式___________ 。继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫代硫酸钠标准溶液滴定,发生反应的化学方程式为:I2+2Na2S2O3=2NaI+Na2S4O6,平均消耗cmol/L的Na2S2O3溶液VmL。则试样中CuSO4·5H 2O的质量分数为___________ 。
(1)写出铜与稀硝酸反应的化学方程式
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用,写出溶出铜的离子方程式
(3)工业上以黄铜矿为原料,采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S
 6Cu+SO2,该反应的氧化剂是
6Cu+SO2,该反应的氧化剂是(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜诱的主要成分为Cu2(OH)2CO3(碱式碳酸铜),试写出上述过程中负极的电极反应式
(5)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取ag试样配成100mL溶液,每次取25.00mL,滴加KI溶液后有白色碘化物沉淀生成,写出该反应的离子方程式
您最近半年使用:0次
2 . 下列方案设计、现象和结论正确的是
| 方案设计 | 现象和结论 | |
| A | 将裹有锌皮的铁钉放入滴加了酚酞和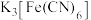 的热琼脂溶液中 的热琼脂溶液中 | 观察到锌皮附近的琼脂变红色,则锌皮发生了电化学腐蚀,锌做负极 |
| B | 向 溶液中加入醋酸,将产生的气体通入苯酚钠水溶液中 溶液中加入醋酸,将产生的气体通入苯酚钠水溶液中 | 观察到苯酚钠溶液变浑浊,说明碳酸的酸性比苯酚强 |
| C | 向放有少量脱脂棉的试管中加入几滴 和几滴浓硫酸,充分搅拌后,加入新制 和几滴浓硫酸,充分搅拌后,加入新制 悬浊液,加热 悬浊液,加热 | 未观察到砖红色沉淀生成,说明纤维素没有发生水解 |
| D | 在大试管中加入 苯酚、过量的质量分数为 苯酚、过量的质量分数为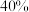 的甲醛溶液,置于水浴中加热片刻,加入 的甲醛溶液,置于水浴中加热片刻,加入 浓氨水,继续在水浴中加热 浓氨水,继续在水浴中加热 | 观察到固体生成,固体为网状结构的酚醛树脂 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
3 . 金属腐蚀在生活中随处可见,常见的有化学腐蚀和电化学腐蚀.
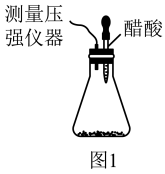
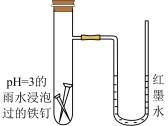
I.某研究小组为探究弱酸性条件下铁发生电化学腐蚀的类型及腐蚀速率,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞,如图1所示。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计(完成表中空格):
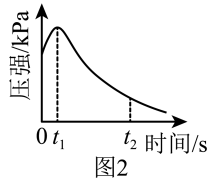
(2)编号①实验测得容器中压强随时间变化如图2。 时,容器中压强明显小于起始压强,其原因是铁发生了
时,容器中压强明显小于起始压强,其原因是铁发生了________________ (填“吸氧”或“析氢”)腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动的方向________ ;此时,炭粉表面发生了________ (填“氧化”或“还原”)反应,其电极反应式是_______ 。
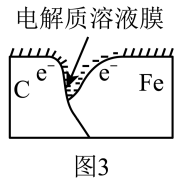
(3)图中U形管左端红墨水柱先下降,一段时间后又上升,请解释开始下降的原因是_______ 。
(4)图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
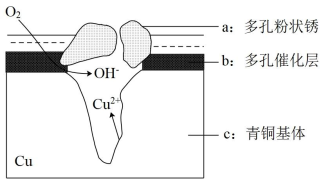
①腐蚀过程中,负极是______ (填“a”“b”或“c”)。
②环境中的 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈
扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈 ,其离子方程式为
,其离子方程式为____________ 。
I.某研究小组为探究弱酸性条件下铁发生电化学腐蚀的类型及腐蚀速率,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞,如图1所示。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计(完成表中空格):
| 编号 | 实验目的 | 炭粉质量/g | 铁粉质量/g | 醋酸质量分数/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 醋酸浓度的影响 | 0.5 | 36.0 | |
| ③ | 0.2 | 2.0 | 90.0 |

(2)编号①实验测得容器中压强随时间变化如图2。
 时,容器中压强明显小于起始压强,其原因是铁发生了
时,容器中压强明显小于起始压强,其原因是铁发生了

(3)图中U形管左端红墨水柱先下降,一段时间后又上升,请解释开始下降的原因是

(4)图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。

①腐蚀过程中,负极是
②环境中的
 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈
扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈 ,其离子方程式为
,其离子方程式为
您最近半年使用:0次
2022-05-29更新
|
569次组卷
|
5卷引用:山西省吕梁市临县第一中学2021-2022学年高二下学期5月月考化学试题
山西省吕梁市临县第一中学2021-2022学年高二下学期5月月考化学试题(已下线)考点20 金属的腐蚀与防护-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)4.3 金属的腐蚀与防护-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)(已下线)北京市海淀区2023届高三上学期期末考试变式汇编(15-19)(已下线)考点20 金属的腐蚀与防护(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
4 . 下列说法正确且均与化学反应速率有关的是
①将糕点存放在冰箱里,或在其包装袋中放入生石灰作为脱氧剂,可以延长保质期;
②使用粗锌小颗粒和稀硫酸反应制氢气
③炼铁高炉尾气中,总是存在一定含量CO
④工业上选择400-500°C合成氨
⑤向橡胶中加入硫粉,提高了其强度和韧性和化学稳定性
⑥面粉厂要注意防火,面粉在封闭厂房中扬起悬浮达到一定浓度时,易发生爆炸危险
⑦向门窗合页里注油或在铁制品表面刷油漆来减缓腐蚀速率
⑧汽车的三元催化器中利用铂,铑催化一氧化碳和氮氧化物转化成二氧化碳和氮气
①将糕点存放在冰箱里,或在其包装袋中放入生石灰作为脱氧剂,可以延长保质期;
②使用粗锌小颗粒和稀硫酸反应制氢气
③炼铁高炉尾气中,总是存在一定含量CO
④工业上选择400-500°C合成氨
⑤向橡胶中加入硫粉,提高了其强度和韧性和化学稳定性
⑥面粉厂要注意防火,面粉在封闭厂房中扬起悬浮达到一定浓度时,易发生爆炸危险
⑦向门窗合页里注油或在铁制品表面刷油漆来减缓腐蚀速率
⑧汽车的三元催化器中利用铂,铑催化一氧化碳和氮氧化物转化成二氧化碳和氮气
| A.②④⑥⑧ | B.①④⑥⑦ | C.③④⑤ | D.②⑥⑦ |
您最近半年使用:0次
21-22高三上·浙江·阶段练习
名校
解题方法
5 . 设 为阿伏加德罗常数的值,下列说法
为阿伏加德罗常数的值,下列说法不正确 的是
 为阿伏加德罗常数的值,下列说法
为阿伏加德罗常数的值,下列说法A.常温常压下,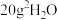 含有电子数为 含有电子数为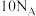 |
B.环状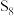 ( (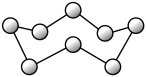 )分子中含有的 )分子中含有的 数为 数为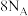 |
C. 质量分数为46%的酒精溶液含有氧原子数为 质量分数为46%的酒精溶液含有氧原子数为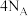 |
D.钢铁电化学腐蚀生成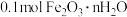 ,则负极反应失电子数为 ,则负极反应失电子数为 |
您最近半年使用:0次
2021-10-15更新
|
168次组卷
|
3卷引用:解密02 物质的量(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
(已下线)解密02 物质的量(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)浙江省十校联盟2022届高三10月联考化学试题新疆维吾尔自治区乌鲁木齐市第十二中学2023-2024学年高三上学期8月月考化学试题
6 . 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,液滴外沿为棕色铁锈环(b),如图所示,下列说法不正确 的是
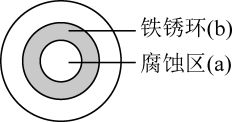

A.铁片腐蚀过程发生的总化学方程式为: 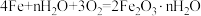 |
B.液滴之下氧气含量少,铁片作负极,发生的还原反应为: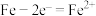 |
C.液滴边缘是正极区,发生的电极反应为: |
| D.铁片腐蚀最严重区域不是生锈最多的区域 |
您最近半年使用:0次
2022-12-11更新
|
250次组卷
|
2卷引用:福建省泉州第五中学2022-2023学年高二上学期期中考化学试题
名校
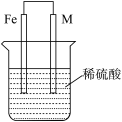
解题方法
7 . 一些制氢方案会产生有毒气体CO,可通过CO传感器监测其含量,工作原理为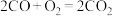 ,示意图如下:
,示意图如下:

提示:图装置,利用有元素化合价变化的反应产生电流。
失电子,元素化合价升高;电子不能通过溶液;电子流出极为负极。
请回答下列问题:
(1)通入CO的一极为______ (填“正”或“负”)极,溶液中 移向
移向______ (填“A”或“B”)极。
(2)利用上述装置的相关原理可防止铁的腐蚀,图中M的电极材料可选择______(填选项)。
(3)汽车尾气中的主要污染物为CO和NO,二者可在尾气管中的三元催化器内发生反应,转化为无污染的气体。请写出对应的化学方程式____________________________________ 。
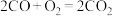 ,示意图如下:
,示意图如下:
提示:图装置,利用有元素化合价变化的反应产生电流。
失电子,元素化合价升高;电子不能通过溶液;电子流出极为负极。
请回答下列问题:
(1)通入CO的一极为
 移向
移向(2)利用上述装置的相关原理可防止铁的腐蚀,图中M的电极材料可选择______(填选项)。

| A.Zn | B.Cu | C.Ag | D.Au |
您最近半年使用:0次
8 . 电化学在科技、生产、社会和生活的各个发面都发挥着重要的作用。
(1)图中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择_______ (填字母)。这种防止金属材料腐蚀的方法叫做_______ 。

a.金块 b .锌板 c.铜板 d.钠块
(2)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺,节能超过30%,在此工艺中,物料传输和转化关系如图。(电极均为石墨电极)

①写出A装置中发生反应的离子反应方程式:_______ 。
②写出燃料电池B中的负极的电极反应:_______ ;分析比较图示中a%与b%的大小:a% _______ b%(填“>”“<”或“=”);燃料电池B中的离子交换膜为_______ 离子交换膜。
(3)通过NO传感器可监测汽车尾气中NO的含量,工作原理如图所示:
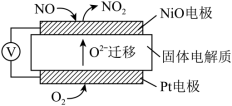
NiO电极上的电极反应式为_______ 。
(1)图中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择

a.金块 b .锌板 c.铜板 d.钠块
(2)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺,节能超过30%,在此工艺中,物料传输和转化关系如图。(电极均为石墨电极)

①写出A装置中发生反应的离子反应方程式:
②写出燃料电池B中的负极的电极反应:
(3)通过NO传感器可监测汽车尾气中NO的含量,工作原理如图所示:

NiO电极上的电极反应式为
您最近半年使用:0次
名校
9 . 电化学在科技、生产、社会和生活的各个发面都发挥着重要的作用。
(1)图中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择____ (填字母)。

a.金块 b.锌板 c.铜板 d.钠块
(2)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺,节能超过30%,在此工艺中,物料传输和转化关系如图。(电极均为石墨电极)
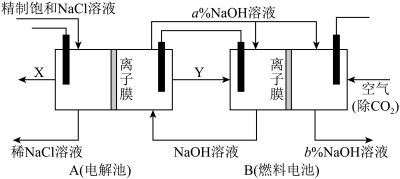
写出A装置中发生反应的离子反应方程式:____ ,分析比较图示中a%与b%的大小:a%____ b%(填“>”“<”或“=”)。
(3)写出燃料电池B中的负极的电极反应:____ 。
通过NO传感器可监测汽车尾气中NO的含量,工作原理如图所示:
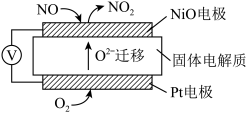
(4)Pt电极上的电极反应式为____ 。
(1)图中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择

a.金块 b.锌板 c.铜板 d.钠块
(2)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺,节能超过30%,在此工艺中,物料传输和转化关系如图。(电极均为石墨电极)

写出A装置中发生反应的离子反应方程式:
(3)写出燃料电池B中的负极的电极反应:
通过NO传感器可监测汽车尾气中NO的含量,工作原理如图所示:

(4)Pt电极上的电极反应式为
您最近半年使用:0次
名校
解题方法
10 . 电化学在科技、生产、社会和生活的各个发面都发挥着重要的作用。
(1)图中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择_______ (填字母)。这种防止金属材料腐蚀的方法叫做_______。
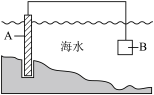
a.金块 b.锌板 c.铜板 d.钠块
氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺,节能超过30%,在此工艺中,物料传输和转化关系如图。(电极均为石墨电极)
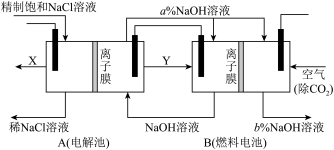
(2)写出A装置中发生反应的离子反应方程式:_______,分析比较图示中a%与b%的大小:a%_______b%(填“>”“<”或“=”)。
(3)写出燃料电池B中的负极的电极反应:_______。
通过NO传感器可监测汽车尾气中NO的含量,工作原理如图所示:
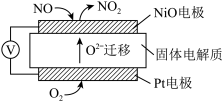
(4)NiO电极上发生的是反应_______(填“氧化”或“还原”)。Pt电极上的电极反应式为_______。
(1)图中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择_______ (填字母)。这种防止金属材料腐蚀的方法叫做_______。

a.金块 b.锌板 c.铜板 d.钠块
氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺,节能超过30%,在此工艺中,物料传输和转化关系如图。(电极均为石墨电极)

(2)写出A装置中发生反应的离子反应方程式:_______,分析比较图示中a%与b%的大小:a%_______b%(填“>”“<”或“=”)。
(3)写出燃料电池B中的负极的电极反应:_______。
通过NO传感器可监测汽车尾气中NO的含量,工作原理如图所示:

(4)NiO电极上发生的是反应_______(填“氧化”或“还原”)。Pt电极上的电极反应式为_______。
您最近半年使用:0次
2022-10-11更新
|
300次组卷
|
2卷引用:山东省枣庄市第三中学2022-2023学年高二上学期10月阶段检测化学试题



