1 . 将 还原转化为有用的化学产品是目前研究的热点之一、回答下列问题:
还原转化为有用的化学产品是目前研究的热点之一、回答下列问题:
Ⅰ.用铜铝催化剂可将 加氢合成甲醇,已知过程中发生的反应如下:
加氢合成甲醇,已知过程中发生的反应如下:
ⅰ.


ⅱ.


ⅲ.


(1)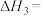
_____ (用含 、
、 的代数式表示),
的代数式表示),
_____ (用含 、
、 的代数式表示)。
的代数式表示)。
(2)查阅资料可知, ,则
,则_____ (填“低温"“商温”或“任意温度”)条件下有利于反应ⅲ自发进行。
Ⅱ. 和
和 以1:3的物质的量之比通入某密闭容器中,仅发生反应
以1:3的物质的量之比通入某密闭容器中,仅发生反应 ,
, 的平衡转化率与温度、气体的总压强的关系如图所示:
的平衡转化率与温度、气体的总压强的关系如图所示: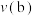
______ (填“>”“<”或“=”)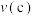 。
。
(4)平衡常数: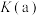
____ (填“>”“<”或“=”)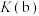 。
。
(5)压强:
______ (填“>”“<”或“=”) 。
。
(6)b点时,该反应的平衡常数
______ (分压=总压×物质的量分数,用含x、 的代数式表示)。
的代数式表示)。
Ⅲ.常温下,CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示: 和
和 的体积比为
的体积比为______ 。
 还原转化为有用的化学产品是目前研究的热点之一、回答下列问题:
还原转化为有用的化学产品是目前研究的热点之一、回答下列问题:Ⅰ.用铜铝催化剂可将
 加氢合成甲醇,已知过程中发生的反应如下:
加氢合成甲醇,已知过程中发生的反应如下:ⅰ.



ⅱ.



ⅲ.



(1)
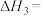
 、
、 的代数式表示),
的代数式表示),
 、
、 的代数式表示)。
的代数式表示)。(2)查阅资料可知,
 ,则
,则Ⅱ.
 和
和 以1:3的物质的量之比通入某密闭容器中,仅发生反应
以1:3的物质的量之比通入某密闭容器中,仅发生反应 ,
, 的平衡转化率与温度、气体的总压强的关系如图所示:
的平衡转化率与温度、气体的总压强的关系如图所示:
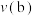
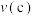 。
。(4)平衡常数:
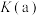
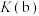 。
。(5)压强:

 。
。(6)b点时,该反应的平衡常数

 的代数式表示)。
的代数式表示)。Ⅲ.常温下,CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
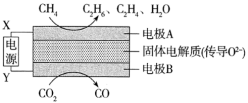
 和
和 的体积比为
的体积比为
您最近一年使用:0次
2 . 库仑测硫仪可以测定待测气体中 的含量,其工作原理如图所示。检测前,溶液中
的含量,其工作原理如图所示。检测前,溶液中 为一定值,电解池不工作。通入待检气体
为一定值,电解池不工作。通入待检气体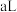 后,电解池开始工作,一段时间后停止。下列说法错误的是
后,电解池开始工作,一段时间后停止。下列说法错误的是
 的含量,其工作原理如图所示。检测前,溶液中
的含量,其工作原理如图所示。检测前,溶液中 为一定值,电解池不工作。通入待检气体
为一定值,电解池不工作。通入待检气体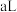 后,电解池开始工作,一段时间后停止。下列说法错误的是
后,电解池开始工作,一段时间后停止。下列说法错误的是
A.电解池开始工作时,阳极电极反应式: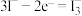 |
B.电解一段时间后停止,是因为 已经全部转化为 已经全部转化为 |
C.通入待测气体后发生反应: |
D.测得电解过程转移电子 ,则待测气体中 ,则待测气体中 的含量为 的含量为 |
您最近一年使用:0次
2024-01-25更新
|
363次组卷
|
2卷引用:2024届内蒙古通辽市高三下学期第一次模拟考试理科综合试题-高中化学
解题方法
3 . 电化学固氮技术由于可在温和条件下进行,为肥料低成本生产提供了新策略,装置如图所示。下列说法错误的是


A.电极A为阳极,电极反应式为 |
B.在介质中,利用 的定向移动形成电流 的定向移动形成电流 |
C.标准状况下,放出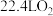 ,转移的电子数为 ,转移的电子数为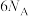 |
D.通电一段时间后,电极A生成的 和电极B消耗的 和电极B消耗的 的物质的量之比为3:2 的物质的量之比为3:2 |
您最近一年使用:0次
4 . 处理电镀污水时会产生大量的电镀污泥,下面是处理某种电镀污泥回收铜、镍元素的一种工业流程:
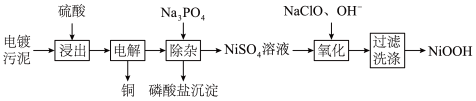
已知:硫酸浸出后得到的浸出液中含有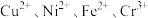 ;
;
回答下列问题:
(1)“浸出”工序中,为提高浸出率可以采取的措施__________ (写出两条)。
(2)在“电解”时,若维持电流强度为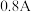 ,电流效率为90%,电解
,电流效率为90%,电解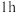 ,理论上可获得铜的质量
,理论上可获得铜的质量____ g(结果保留小数点后两位)。(已知:电流效率是指电解时电极上实际沉积与理论沉积物质的量之比,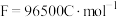 )
)
(3)为提高“除杂”工序的效果,“电解”工序中需控制电解电压稍大一些,其目的是___________ ;磷酸盐沉淀是FePO4、______ (填化学式)。
(4)硫酸镍溶液在强碱性环境下用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。“氧化”工序中反应的离子方程式__________ 。
(5)“过滤、洗涤”工序中,检验沉淀洗涤干净的操作方法________ 。

已知:硫酸浸出后得到的浸出液中含有
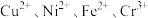 ;
;回答下列问题:
(1)“浸出”工序中,为提高浸出率可以采取的措施
(2)在“电解”时,若维持电流强度为
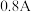 ,电流效率为90%,电解
,电流效率为90%,电解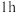 ,理论上可获得铜的质量
,理论上可获得铜的质量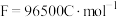 )
)(3)为提高“除杂”工序的效果,“电解”工序中需控制电解电压稍大一些,其目的是
(4)硫酸镍溶液在强碱性环境下用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。“氧化”工序中反应的离子方程式
(5)“过滤、洗涤”工序中,检验沉淀洗涤干净的操作方法
您最近一年使用:0次
5 . 二氧化氯(C1O2)是国内公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被认为是“第四代消毒剂”。电解法是目前最为热门的生产ClO2的方法之一。直接电解氯酸钠(NaClO3)溶液自动催化循环制备高纯ClO2的实验装置示意图如图所示。

已知:①不考虑H+放电;
②亚氯酸盐具有强氧化性。
回答下列问题:
(1)NaClO3中氯元素的化合价为_______ 价,NaClO3在水中的电离方程式为_________ 。
(2)电解氯酸钠溶液时,H+穿过质子交换膜移向___________ (填“N”或“M”)电极。
(3)已知铅酸蓄电池的工作原理为 ;
;
①电解氯酸钠溶液时,M电极上发生___________ (填“氧化”或“还原”)反应。
②电解氯酸钠溶液时,若以铅酸蓄电池作为电源,则R应与___________ (填“Pb”或“PbO2”)电极相连,N电极上的电极反应式为___________ 。
③电解氯酸钠溶液时,若以铅酸蓄电池作为电源,每消耗4.14gPb,此时生成气体B的体积为___________ mL(换算为标准状况下)。
(4)用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是___________(填标号)。

已知:①不考虑H+放电;
②亚氯酸盐具有强氧化性。
回答下列问题:
(1)NaClO3中氯元素的化合价为
(2)电解氯酸钠溶液时,H+穿过质子交换膜移向
(3)已知铅酸蓄电池的工作原理为
 ;
;①电解氯酸钠溶液时,M电极上发生
②电解氯酸钠溶液时,若以铅酸蓄电池作为电源,则R应与
③电解氯酸钠溶液时,若以铅酸蓄电池作为电源,每消耗4.14gPb,此时生成气体B的体积为
(4)用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是___________(填标号)。
| A.明矾 | B.氯化钾 | C.盐酸 | D.硫酸亚铁 |
您最近一年使用:0次
解题方法
6 . 研究金属腐蚀和防腐的原理很有现实意义,回答下列问题:
(1)某化学实验兴趣小组同学利用如图所示装置进行实验:
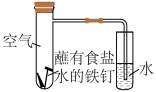
①该实验为___________ (填“析氢”或“吸氧”)腐蚀。
②实验进行一段时间后,在右侧小试管中,可观察到的现象为___________ 。
③在左侧大试管中,正极上发生反应的电极反应式为___________ 。
(2)实际生产中,可在铁的表面镀铜防止铁被腐蚀(如图所示):
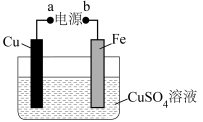
①a为电源的___________ (填“正极”或“负极”),判断的理由为___________ 。
②电镀时,Fe电极上发生反应的电极反应式为___________ 。
③电镀过程中,电解质溶液的pH将___________ (填“增大”、“减小”或“不变”)。
④电镀时,当电路中转移0.2mol电子时,此时两电极的质量差为_______ g(假设起始两电极的质量相等)。
(1)某化学实验兴趣小组同学利用如图所示装置进行实验:

①该实验为
②实验进行一段时间后,在右侧小试管中,可观察到的现象为
③在左侧大试管中,正极上发生反应的电极反应式为
(2)实际生产中,可在铁的表面镀铜防止铁被腐蚀(如图所示):

①a为电源的
②电镀时,Fe电极上发生反应的电极反应式为
③电镀过程中,电解质溶液的pH将
④电镀时,当电路中转移0.2mol电子时,此时两电极的质量差为
您最近一年使用:0次
2023-12-04更新
|
362次组卷
|
6卷引用:内蒙古部分名校2023-2024学年高二上学期期中联合考试化学试题
解题方法
7 . 草酸锌可应用于有机合成、电子工业等。工业上制取ZnC2O4的原理如图所示(电解液不参加反应,假设起始时两电极的质量相同),下列说法正确的是
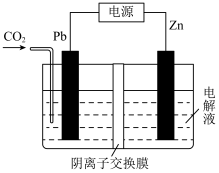
| A.电池工作时,Zn电极上发生还原反应 |
| B.每消耗5.6LCO2,同时转移的电子数为0.25NA |
| C.电池工作时,电路中电子的流动方向为Pb→电解液→Zn→电源→Pb |
| D.每消耗6.5gZn,两电极的质量相差6.5g |
您最近一年使用:0次
2023-12-04更新
|
305次组卷
|
3卷引用:内蒙古部分名校2023-2024学年高二上学期期中联合考试化学试题
名校
8 . 原油中的硫化氢可采用电化学法处理,并制取氢气,其原理如图所示。
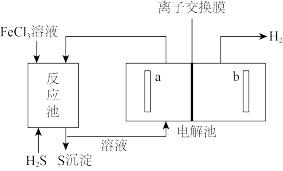
下列说法错误的是

下列说法错误的是
| A.电解池中电极a为阳极 |
| B.从反应池进入电解池的溶液溶质为FeCl2和HCl |
| C.H+通过离子交换膜到电解池右极室 |
| D.生成5.6LH2(标准状况),理论上在反应池中生成0.5molS沉淀 |
您最近一年使用:0次
2022-08-26更新
|
269次组卷
|
6卷引用:内蒙古自治区阿拉善盟第一中学2023届高三上学期8月月考化学试题
名校
9 . 盐酸羟胺(NH2OH•HCl)用途广泛,可利用如图装置来制备。以盐酸为离子导体,向两电极分别通入NO和H2。下列说法正确的是
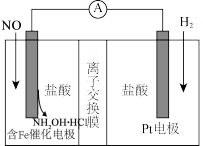

| A.Pt电极为原电池的正极 |
| B.Cl-通过离子交换膜到右极室 |
| C.一段时间后,含Fe的催化电极所在极室的pH增大 |
| D.每生成1mol盐酸羟胺电路中转移4mole- |
您最近一年使用:0次
2022-08-26更新
|
512次组卷
|
11卷引用:内蒙古自治区阿拉善盟第一中学2023届高三上学期8月月考化学试题
内蒙古自治区阿拉善盟第一中学2023届高三上学期8月月考化学试题河南省百所名校2023届高三上学期开学摸底联考化学试题广东省2023届高三8月开学摸底大联考化学试题河北省秦皇岛市部分学校2022-2023学年高三上学期开学考试化学试题山东省部分学校2023届高三上学期开学摸底联考(山东卷)化学试题山东师范大学附属中学2022-2023 学年高三上学期10月学情诊断考试化学试题山东师范大学附属中学2022-2023学年高三上学期第一次月考化学试题辽宁省2022-2023学年高三上学期开学摸底联考化学试题陕西省咸阳高新一中2023届高三上学期第一次质量检测化学试题山东省部分学校2023-2024学年高三上学期12月联考化学试卷陕西省名校协作体2023-2024学年高三上学期12月月考化学试题
名校
10 . 2022年3月,生态环境部提出了“深入打好污染防治攻坚战,严守生态环境风险‘底线’”。某研究部门利用垃圾渗透液实现发电、环保二位一体,其装置示意图如下。下列说法错误的是
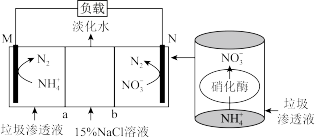

| A.Na+由中间室向M极室移动,Cl-向N极室移动 |
| B.a和b分别为阴离子交换膜和阳离子交换膜 |
C.M为负极,电极反应式是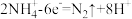 |
D.电路中通过7.5mol电子时,理论上处理掉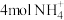 |
您最近一年使用:0次
2022-06-29更新
|
235次组卷
|
3卷引用:内蒙古包钢第一中学2022-2023学年高三上学期11月月考化学试题



