名校
解题方法
1 . 贮备电池主要用于应急救援和武器系统。Mg-AgCl电池是一种可被海水激活的贮备电池,电池总反应为Mg+2AgCl=MgCl2+2Ag。下列叙述正确的是
| A.放电时电子由Mg经海水移动到AgCl |
| B.若将镁换成锌,该装置将不能构成海水原电池 |
| C.负极会发生副反应:Mg+2H2O=Mg(OH)2+H2↑ |
| D.正极反应为Ag++e-=Ag |
您最近一年使用:0次
2023-11-12更新
|
460次组卷
|
3卷引用:四川省成都市第七中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
2 . 在如图装置中,观察到图1装置铜电极上产生大量无色气泡,而图2装置中铜电极上无气泡产生,铬电极上产生大量有色气泡。下列叙述不正确的是
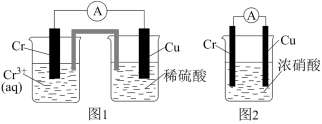
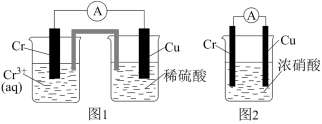
A.图1装置中 Cu 电极上电极反应式是 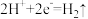 |
B.图2装置中 Cu 电极上发生的电极反应为 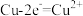 |
C.图2装置中 Cr电极上电极反应式为  |
| D.两个装置中,电子均由 Cr电极经导线流向 Cu 电极 |
您最近一年使用:0次
2023-10-24更新
|
492次组卷
|
10卷引用:四川省眉山市仁寿县铧强中学 眉山天府新区实验中学2023-2024学年高二上学期11月期中联考化学试题
四川省眉山市仁寿县铧强中学 眉山天府新区实验中学2023-2024学年高二上学期11月期中联考化学试题河南省顶尖名校联盟2021-2022学年高二上学期12月联考化学试题辽宁省沈阳市五校协作体2021-2022学年高二上学期期末联考化学试题黑龙江省佳木斯市第十二中学(佳木斯市建三江第一中学)2021-2022学年高一下学期期中考试化学试题天津市第二中学2022-2023学年高二上学期12月学情调查化学试题湖北省部分省级示范高中(四校联考)2022-2023学年高二上学期期末测试化学试题河北省石家庄市第一中学东校区2023-2024学年高二上学期第一次月考化学试题河北省石家庄第一中学2023-2024学年高二上学期10月月考化学试题广东省普宁二中实验学校2023-2024学年高二上学期第三次月考化学试题新疆石河子第一中学2023-2024学年高二上学期12月月考化学试题
3 . 某教授团队研究了以氢气电极为负极、醌类有机电极为正极的水系有机氢气质子电池,使电池实现了超高倍率和超长循环性能,并获得了优异的低温性能。下列有关说法中错误的是
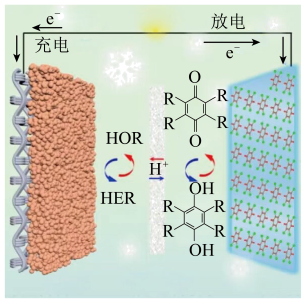

| A.充电时,醌类有机电极与外接电源的正极相连 |
B.放电时,外电路通过1 电子时,负极消耗的 电子时,负极消耗的 的体积为22.4L 的体积为22.4L |
C.放电时,正极的电极反应为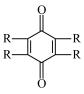 +2H++2e-= +2H++2e-=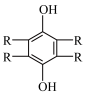 |
D.充电时,溶液中的 由醌类有机电极向氢气电极移动 由醌类有机电极向氢气电极移动 |
您最近一年使用:0次
2023-10-22更新
|
280次组卷
|
2卷引用:四川省部分名校2023-2024学年高三上学期10月联考理科综合化学试题
4 . I.某兴趣小组为探究原电池工作原理,利用金属Zn与稀H2SO4反应,通过如图所示装置A、B进行实验,实验过程中装置A内溶液的温度升高,装置B的电流计指针发生偏转。
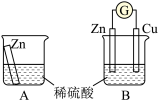
根据所学知识,完成下列各题:
(1)装置B为原电池,则Cu作_______ (填“正”或“负”)极,Zn电极上的电极反应式为_______ 。
(2)一般把金属导线称为“电子导体”,把电解质溶液称为“离子导体”。装置B中电池工作时“电子导体”中电子的流动方向可描述为_______ ;“离子导体”中H+离子的移动方向可描述为_______ 。
(3)从反应速率的角度上看,可以观察到A中反应比B中_______ (填“快”或“慢”)
(4)装置B中稀H2SO4用足量CuSO4溶液代替,起始时Zn电极和Cu电极的质量相等,当导线中有0.2mol电子转移时,Zn电极和Cu电极的质量差为_______ 。
II.某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据填空:
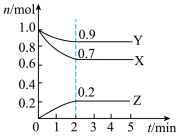
(5)该反应的化学方程式为_______ ;
(6)反应开始至2min末,以气体X表示的平均反应速率为_______ ;
(7)恒温恒容条件下,能说明该反应达到化学平衡状态的标志是_______ 。
①混合气体的压强不再变化 ②混合气体的密度不再变化 ③X的百分含量不再变化 ④混合气体的平均相对分子质量不再变化 ⑤v(X):v(Y)=3:1

根据所学知识,完成下列各题:
(1)装置B为原电池,则Cu作
(2)一般把金属导线称为“电子导体”,把电解质溶液称为“离子导体”。装置B中电池工作时“电子导体”中电子的流动方向可描述为
(3)从反应速率的角度上看,可以观察到A中反应比B中
(4)装置B中稀H2SO4用足量CuSO4溶液代替,起始时Zn电极和Cu电极的质量相等,当导线中有0.2mol电子转移时,Zn电极和Cu电极的质量差为
II.某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据填空:

(5)该反应的化学方程式为
(6)反应开始至2min末,以气体X表示的平均反应速率为
(7)恒温恒容条件下,能说明该反应达到化学平衡状态的标志是
①混合气体的压强不再变化 ②混合气体的密度不再变化 ③X的百分含量不再变化 ④混合气体的平均相对分子质量不再变化 ⑤v(X):v(Y)=3:1
| A.①②⑤ | B.①③④ | C.②③④ | D.③④⑤ |
您最近一年使用:0次
名校
解题方法
5 . 通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是
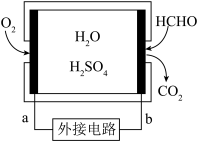
| A.a为电池的正极,发生还原反应 |
| B.b极的电极反应为HCHO+H2O-4e−=CO2+4H+ |
| C.传感器工作过程中,电解质溶液中H+向a极移动 |
| D.外电路中的电流方向为由b到a |
您最近一年使用:0次
2023-09-16更新
|
593次组卷
|
6卷引用:四川省泸县第一中学2023-2024学年高二上学期10月月考化学试题
四川省泸县第一中学2023-2024学年高二上学期10月月考化学试题新疆维吾尔自治区喀什第二中学2022-2023学年高二上学期1月期末考试化学试题内蒙古自治区优质高中联考2023-2024学年高二上学期11月期中化学试题(已下线)专题09 原电池-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)河南省唐河县鸿唐高级中学2023-2024学年高二上学期10月月考化学试题福建省莆田三中2023-2024学年高二上学期第一次月考化学试题
名校
解题方法
6 . SO2可形成酸雨,是大气污染物。利用如图装置既可以吸收工厂排放的SO2又可以制得硫酸溶液。下列说法正确的是
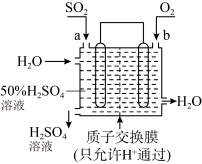

| A.电子的流动方向:a极→电解质溶液→b极 |
| B.b极的电极反应式为O2+4e-+2H2O=4OH- |
| C.当电路中有2mol电子通过时,有4molH+透过质子交换膜进入右侧 |
| D.该电池的总反应式为:2SO2+O2+2H2O=2H2SO4 |
您最近一年使用:0次
名校
7 . 化学电源在日常生活和高科技领域中都有着广泛应用。下列说法错误的是
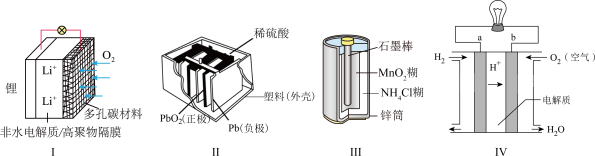

A.电池Ⅰ中锂电池放电时,电解质中 向多孔碳材料极迁移 向多孔碳材料极迁移 |
| B.电池Ⅱ是二次电池,充电时是将化学能转化为电能 |
C.电池Ⅲ中锌筒发生氧化反应, 作电解质 作电解质 |
D.电池Ⅳ中正极的电极反应式: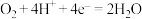 |
您最近一年使用:0次
名校
解题方法
8 . 天津大学在光催化钠离子二次电池的应用研究取得重大进展。该电池工作原理如图所示,光催化电极能在太阳光照下实现对设备进行充电。下列说法错误的是
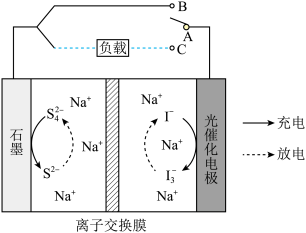

| A.放电时,电子从石墨电极流出通过导线流向光催化电极 |
| B.离子交换膜为阳离子交换膜 |
C.充电时,石墨电极的电极反应式为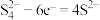 |
D.放电时,当外电路转移 电子时,离子交换膜左室电解质溶液质量减少 电子时,离子交换膜左室电解质溶液质量减少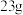 |
您最近一年使用:0次
名校
解题方法
9 . 电化学技术在处理污染气体领域的应用广泛。
(1)利用反应 构成电池的方法,既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。
构成电池的方法,既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。
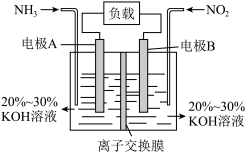
①A电极的电极反应式为_______________________ 。
②下列关于该电池的说法正确的是___________ 。
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一段时间,溶液的 不变
不变
D.当有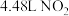 被处理时,转移电子物质的量为
被处理时,转移电子物质的量为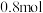
(2)以含 废气为原料,用电化学方法制取硫酸。装置如图。
废气为原料,用电化学方法制取硫酸。装置如图。
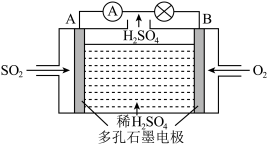
写出负极电极反应式______________________________ 。
(3)一种乙醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。请写出负极的电极反式_________________________________________ ;每消耗4.6g乙醇转移的电子数为_________ 。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池总反应的离子方程式是___________________________ 。
(1)利用反应
 构成电池的方法,既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。
构成电池的方法,既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。
①A电极的电极反应式为
②下列关于该电池的说法正确的是
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一段时间,溶液的
 不变
不变D.当有
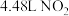 被处理时,转移电子物质的量为
被处理时,转移电子物质的量为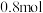
(2)以含
 废气为原料,用电化学方法制取硫酸。装置如图。
废气为原料,用电化学方法制取硫酸。装置如图。
写出负极电极反应式
(3)一种乙醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。请写出负极的电极反式
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池总反应的离子方程式是
您最近一年使用:0次
2023-09-02更新
|
366次组卷
|
2卷引用:四川省凉山州宁南中学2023-2024学年高二上学期开学考试化学试题
2010·全国·一模
名校
解题方法
10 . 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为Zn(s)+2MnO2(s)+2H2O(l)=Zn(OH)2(s)+2MnOOH(s),下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为2MnO2(s)+2H2O(l)+2e-=2MnOOH(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
您最近一年使用:0次
2023-08-27更新
|
794次组卷
|
98卷引用:2009—2010学年成都市玉林中学高二(下期)摸底测试化学
(已下线)2009—2010学年成都市玉林中学高二(下期)摸底测试化学2014-2015四川省雅安中学高二上学期期末模拟化学试卷2015-2016学年四川阆中中学校高二上第二次段考化学试卷四川省成都市七中实验学校2018-2019学年高二5月月考化学试题四川省西充中学 2021-2022 学年高二上学期期中考试化学试题四川省南充市2021-2022学年高二下学期期末考试化学试题(已下线)高考第一轮复习化学反应与能量变化单元测试(已下线)2010年广东省广州市番禹区高二下学期期中考试化学试题(已下线)2010年春季武汉睿升学校高一期中考试化学卷(已下线)09~10年大连23中高一下学期期末考试化学卷(已下线)2010—2011年江苏盐城中学高二上学期期末考试化学卷(选修)(已下线)2010-2011学年江西省安福中学高一下学期期中考试化学试卷(已下线)2010-2011学年江西省上饶市第五中学高一下学期期中考试化学试卷(已下线)2010-2011学年江西省泰和中学高一下学期期末化学模拟试卷(已下线)2011-2012学年甘肃省天水市一中高二上学期期末考试化学试卷(已下线)2011-2012学年甘肃省金昌市第一中学高一期中考试(理)化学试卷 (已下线)2011-2012学年河北省衡水中学高一下学期期末考试化学试卷(已下线)2012年人教版高中化学必修二2.2 化学能与电能练习卷(已下线)2012-2013学年陕西省三原县北城中学高二第四次月考化学试卷(已下线)2012-2013学年吉林省白山市第一中学高一下学期期末考试化学试卷(已下线)2013届北京市大兴区高三上学期期末考试化学试卷(已下线)2013-2014湖北省黄石市三中高一下学期期中考试化学试卷(已下线)2014-2015河北省石家庄第二实验中学高二上学期期中化学(理)试卷2014-2015辽宁省实验中学分校高一下学期期中考试化学试卷2014-2015广西桂林市第十八中学高一下学期期中考试化学试卷2014-2015学年北京市房山区周口店中学高一下期中考试化学试卷2014-2015学年浙江省杭州第二中学高一下期中考试化学试卷2015-2016湖南浏阳市第一中学高二上入学考试化学试卷2015-2016学年河北成安一中、永年二中高二上期中联考化学试卷2015-2016学年福建省龙海市程溪中学高二上学期期中测试化学试卷2016届辽宁省大连八中高三上学期期中测试化学试卷2015-2016学年黑龙江省海林林业局一中高二上期末考试化学试卷2015-2016学年河南省周口市商水一中高一下学期期中考试化学试卷2015-2016学年内蒙古平煤高中高一实验班下期中化学卷2015-2016学年辽宁省大连二十中高一6月月考化学试卷2015-2016学年河北省石家庄市辛集中学高一下第一次段考化学试卷2015-2016学年河北省永年二中高一下学期期末化学试卷2015-2016学年辽宁省庄河高中高一下期末化学试卷2015-2016学年甘肃省甘谷一中高二上期末化学试卷(已下线)同步君 选修4 第4章 第2节 化学电源2016-2017学年山东省济南市长清一中高二上第一次质检化学卷2016-2017学年西藏拉萨中学高二上月考三化学卷2016-2017学年河南师范大学附属中学高一3月月考化学试卷2016-2017学年广西桂林第18中学高一下学期期中模拟化学试卷2016-2017学年浙江省温州市“十五校联合体”高一下学期期中联考化学试卷湖南省邵阳市第二中学2016-2017学年高一下学期第三次月考化学试题广西河池市高级中学2016-2017学年高一下学期第二次月考化学试题云南省峨山彝族自治县第一中学2017-2018学年高二上学期期末市统测模拟考化学试题高中化学人教版 选修四 第四章 电化学基础 第二节 化学电源 化学电源广西陆川县中学2017-2018学年高二12月月考化学试题湖南省浏阳市第一中学2016-2017学年高二上学期入学考试化学试题广东省深圳高中联考联盟2017-2018学年高二上学期期末考试化学试题福建省厦门市湖滨中学2017-2018学年高二下学期第一次月考化学试题安徽省定远重点中学2017-2018学年高一下学期教学段考化学试题吉林省辽源市田家炳高级中学2018-2019学年高二9月月考化学试题陕西省黄陵中学2018-2019学年高二(重点班)上学期期中考试化学试题黑龙江省哈尔滨市呼兰区第一中学2019届高三上学期第三次(12月)月考化学试题陕西省黄陵中学2018-2019学年高二上学期期末考试化学试题江西省分宜中学2018-2019学年高二下学期第一次月考化学试题【校级联考】黑龙江省龙东南七校2018-2019学年高二上学期期末联考化学试题【全国百强校】新疆维吾尔自治区乌鲁木齐八一中学2018-2019学年高一下学期期中考试化学试题广西蒙山县第一中学2017-2018学年高二上学期期末考试化学试题黑龙江省牡丹江市第一高级中学2018-2019学年高一下学期期末考试化学试题陕西省黄陵中学高新部2018-2019学年高一下学期期末考试化学试题广西桂林市第十八中学2019-2020学年高一下学期开学考试化学试题江西省南昌市第二中学2019-2020学年高一下学期第一次月考化学试题(已下线)1.2.2 化学电源 练习《新教材同步备课》(鲁科版选择性必修1)河南省鹤壁市外国语中学2019-2020学年高一下学期段考化学试题云南省玉溪市新平彝族傣自治县第一中学2020-2021学年高三上学期开学考试化学试题福建省福清西山学校高中部2020-2021学年高二9月月考化学试题(已下线)江苏省江阴市第一中学2018-2019高一下学期期中考试化学试卷安徽省涡阳县育萃中学2020-2021学年高二上学期第一次月考化学试题鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 第2节 化学能转化为电能——电池 课时2 化学电源人教版(2019)高二化学选择性必修1第四章 化学反应与电能 第一节 原电池 课时2 化学电源(已下线)专题4.2 化学电源-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)福建省莆田第十五中学2018-2019学年高二上学期期中考试化学试题黑龙江省伊春市伊美区第二中学2018-2019学年高二上学期期末考试化学试题天津市第八中学2020-2021学年高二上学期第三次统练化学试题(已下线)练习8 原电池 化学电源-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)(已下线)第四章 电化学基础(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版选修4)(已下线)4.2 化学电源(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)吉林省白城市第一中学2020-2021学年高二下学期3月月考化学试题(已下线)【镇江新东方】高一下第一次月考一中镇中联考(已下线)1.2.2 化学电源(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)(已下线)第4章 化学反应与电能(章末检测)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第4章 电化学基础(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)江苏省淮安市2021-2022学年高二上学期期末调研测试化学试题福建省福州市协作体四校2021-2022学年高二上学期期中联考化学试题第一节 原电池 第2课时 化学电源河北省石家庄市第四十二中学2022-2023高二上学期10月月考化学试题宁夏吴忠中学2022-2023学年高二上学期期中考试化学试题作业(五) 化学电源内蒙古呼伦贝尔市满洲里市第一中学2022-2023学年高二下学期期中考试化学试题第四章 化学反应与电能 第一节 原电池 第2课时 化学电源江苏省射阳中学2022-2023学年高一下学期3月月考化学试题(已下线)BBWYhjhx1110.pdf山西省朔州市怀仁县阳高一中2023-2024学年高二上学期11月化学试卷宁夏石嘴山市第三中学2023-2024学年高一下学期3月月考化学试题



