1 . 依据氧化还原反应Cu+2Ag+=Cu2++2Ag设计的原电池如图所示。
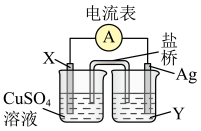
请回答下列问题:
(1)电极X的材料是___________ ,电解质溶液Y是___________ 。
(2)银电极的电极反应式是___________ ;X电极的电极反应式是___________ 。
(3)外电路中的电子是从___________ 极流向___________ 极。
(4)该原电池的正极是___________ ,还可以选用___________ 等材料。
(5)如果将装置图中的两个烧杯换成一个烧杯,是否还需要硫酸铜溶液?___________ 。

请回答下列问题:
(1)电极X的材料是
(2)银电极的电极反应式是
(3)外电路中的电子是从
(4)该原电池的正极是
(5)如果将装置图中的两个烧杯换成一个烧杯,是否还需要硫酸铜溶液?
您最近一年使用:0次
2024-01-04更新
|
286次组卷
|
3卷引用:陕西省西安市2023-2024学年高二上学期期末化学测试卷B
陕西省西安市2023-2024学年高二上学期期末化学测试卷B(已下线)专题07 原电池-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)新疆乌鲁木齐市高级中学2023-2024学年高二上学期1月期末化学试题
名校
2 . 废水处理是重要课题,某实验小组利用如图 所示微生物电池将污水中的乙二胺[H2N(CH2)2NH2]转化为无毒无害的物质并产生电能(M、N 均为石墨电极)。下列说法错误的是
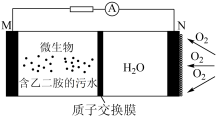

| A.该电池不适宜在高温环境下工作 |
B.M极的电极反应式为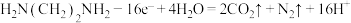 |
| C.每消耗标准状况下22.4L O2时,理论上能处理含 15g 乙二胺的废水 |
| D.电池工作过程中,正极区的 pH降低 |
您最近一年使用:0次
2023-10-02更新
|
143次组卷
|
2卷引用: 2024届陕西省西安中学高三上学期12月练考理科综合试题(实验班)
2010·全国·一模
名校
解题方法
3 . 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为Zn(s)+2MnO2(s)+2H2O(l)=Zn(OH)2(s)+2MnOOH(s),下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为2MnO2(s)+2H2O(l)+2e-=2MnOOH(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
您最近一年使用:0次
2023-08-27更新
|
759次组卷
|
98卷引用:2012-2013学年陕西省三原县北城中学高二第四次月考化学试卷
(已下线)2012-2013学年陕西省三原县北城中学高二第四次月考化学试卷陕西省黄陵中学2018-2019学年高二(重点班)上学期期中考试化学试题陕西省黄陵中学2018-2019学年高二上学期期末考试化学试题陕西省黄陵中学高新部2018-2019学年高一下学期期末考试化学试题(已下线)高考第一轮复习化学反应与能量变化单元测试(已下线)2010年广东省广州市番禹区高二下学期期中考试化学试题(已下线)2010年春季武汉睿升学校高一期中考试化学卷(已下线)2009—2010学年成都市玉林中学高二(下期)摸底测试化学(已下线)09~10年大连23中高一下学期期末考试化学卷(已下线)2010—2011年江苏盐城中学高二上学期期末考试化学卷(选修)(已下线)2010-2011学年江西省安福中学高一下学期期中考试化学试卷(已下线)2010-2011学年江西省上饶市第五中学高一下学期期中考试化学试卷(已下线)2010-2011学年江西省泰和中学高一下学期期末化学模拟试卷(已下线)2011-2012学年甘肃省天水市一中高二上学期期末考试化学试卷(已下线)2011-2012学年甘肃省金昌市第一中学高一期中考试(理)化学试卷 (已下线)2011-2012学年河北省衡水中学高一下学期期末考试化学试卷(已下线)2012年人教版高中化学必修二2.2 化学能与电能练习卷(已下线)2012-2013学年吉林省白山市第一中学高一下学期期末考试化学试卷(已下线)2013届北京市大兴区高三上学期期末考试化学试卷(已下线)2013-2014湖北省黄石市三中高一下学期期中考试化学试卷(已下线)2014-2015河北省石家庄第二实验中学高二上学期期中化学(理)试卷2014-2015四川省雅安中学高二上学期期末模拟化学试卷2014-2015辽宁省实验中学分校高一下学期期中考试化学试卷2014-2015广西桂林市第十八中学高一下学期期中考试化学试卷2014-2015学年北京市房山区周口店中学高一下期中考试化学试卷2014-2015学年浙江省杭州第二中学高一下期中考试化学试卷2015-2016湖南浏阳市第一中学高二上入学考试化学试卷2015-2016学年河北成安一中、永年二中高二上期中联考化学试卷2015-2016学年福建省龙海市程溪中学高二上学期期中测试化学试卷2016届辽宁省大连八中高三上学期期中测试化学试卷2015-2016学年四川阆中中学校高二上第二次段考化学试卷2015-2016学年黑龙江省海林林业局一中高二上期末考试化学试卷2015-2016学年河南省周口市商水一中高一下学期期中考试化学试卷2015-2016学年内蒙古平煤高中高一实验班下期中化学卷2015-2016学年辽宁省大连二十中高一6月月考化学试卷2015-2016学年河北省石家庄市辛集中学高一下第一次段考化学试卷2015-2016学年河北省永年二中高一下学期期末化学试卷2015-2016学年辽宁省庄河高中高一下期末化学试卷2015-2016学年甘肃省甘谷一中高二上期末化学试卷(已下线)同步君 选修4 第4章 第2节 化学电源2016-2017学年山东省济南市长清一中高二上第一次质检化学卷2016-2017学年西藏拉萨中学高二上月考三化学卷2016-2017学年河南师范大学附属中学高一3月月考化学试卷2016-2017学年广西桂林第18中学高一下学期期中模拟化学试卷2016-2017学年浙江省温州市“十五校联合体”高一下学期期中联考化学试卷湖南省邵阳市第二中学2016-2017学年高一下学期第三次月考化学试题广西河池市高级中学2016-2017学年高一下学期第二次月考化学试题云南省峨山彝族自治县第一中学2017-2018学年高二上学期期末市统测模拟考化学试题高中化学人教版 选修四 第四章 电化学基础 第二节 化学电源 化学电源广西陆川县中学2017-2018学年高二12月月考化学试题湖南省浏阳市第一中学2016-2017学年高二上学期入学考试化学试题广东省深圳高中联考联盟2017-2018学年高二上学期期末考试化学试题福建省厦门市湖滨中学2017-2018学年高二下学期第一次月考化学试题安徽省定远重点中学2017-2018学年高一下学期教学段考化学试题吉林省辽源市田家炳高级中学2018-2019学年高二9月月考化学试题黑龙江省哈尔滨市呼兰区第一中学2019届高三上学期第三次(12月)月考化学试题江西省分宜中学2018-2019学年高二下学期第一次月考化学试题【校级联考】黑龙江省龙东南七校2018-2019学年高二上学期期末联考化学试题【全国百强校】新疆维吾尔自治区乌鲁木齐八一中学2018-2019学年高一下学期期中考试化学试题四川省成都市七中实验学校2018-2019学年高二5月月考化学试题广西蒙山县第一中学2017-2018学年高二上学期期末考试化学试题黑龙江省牡丹江市第一高级中学2018-2019学年高一下学期期末考试化学试题广西桂林市第十八中学2019-2020学年高一下学期开学考试化学试题江西省南昌市第二中学2019-2020学年高一下学期第一次月考化学试题(已下线)1.2.2 化学电源 练习《新教材同步备课》(鲁科版选择性必修1)河南省鹤壁市外国语中学2019-2020学年高一下学期段考化学试题云南省玉溪市新平彝族傣自治县第一中学2020-2021学年高三上学期开学考试化学试题福建省福清西山学校高中部2020-2021学年高二9月月考化学试题(已下线)江苏省江阴市第一中学2018-2019高一下学期期中考试化学试卷安徽省涡阳县育萃中学2020-2021学年高二上学期第一次月考化学试题鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 第2节 化学能转化为电能——电池 课时2 化学电源人教版(2019)高二化学选择性必修1第四章 化学反应与电能 第一节 原电池 课时2 化学电源(已下线)专题4.2 化学电源-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)福建省莆田第十五中学2018-2019学年高二上学期期中考试化学试题黑龙江省伊春市伊美区第二中学2018-2019学年高二上学期期末考试化学试题天津市第八中学2020-2021学年高二上学期第三次统练化学试题(已下线)练习8 原电池 化学电源-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)(已下线)第四章 电化学基础(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版选修4)(已下线)4.2 化学电源(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)吉林省白城市第一中学2020-2021学年高二下学期3月月考化学试题(已下线)【镇江新东方】高一下第一次月考一中镇中联考(已下线)1.2.2 化学电源(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)(已下线)第4章 化学反应与电能(章末检测)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第4章 电化学基础(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)四川省西充中学 2021-2022 学年高二上学期期中考试化学试题江苏省淮安市2021-2022学年高二上学期期末调研测试化学试题福建省福州市协作体四校2021-2022学年高二上学期期中联考化学试题四川省南充市2021-2022学年高二下学期期末考试化学试题第一节 原电池 第2课时 化学电源河北省石家庄市第四十二中学2022-2023高二上学期10月月考化学试题宁夏吴忠中学2022-2023学年高二上学期期中考试化学试题作业(五) 化学电源内蒙古呼伦贝尔市满洲里市第一中学2022-2023学年高二下学期期中考试化学试题第四章 化学反应与电能 第一节 原电池 第2课时 化学电源江苏省射阳中学2022-2023学年高一下学期3月月考化学试题(已下线)BBWYhjhx1110.pdf山西省朔州市怀仁县阳高一中2023-2024学年高二上学期11月化学试卷宁夏石嘴山市第三中学2023-2024学年高一下学期3月月考化学试题
解题方法
4 . I.把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应: ,经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L·min),计算:
,经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L·min),计算:
(1)B的转化率___________ 。
(2)恒温达平衡时容器内的压强与开始时压强比___________ 。
Ⅱ.化学电池在通讯,交通及日常生活中有着广泛的应用。
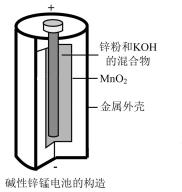
(3)碱性锌锰干电池(如图所示)是应用最普遍的电池之一,电池总反应为 ,碱性锌锰干电池的负极材料是
,碱性锌锰干电池的负极材料是___________ (填名称),负极上发生的电极反应为___________ 。若反应消耗13g负极材料,则电池中转移电子的物质的量为___________ mol。
(4)铅蓄电池是典型的可充电电池,它的正、负极格板都是惰性材料,电池总反应式为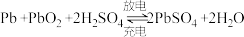 。下列说法正确的是___________(填标号)。
。下列说法正确的是___________(填标号)。
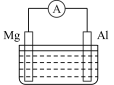
(5)镁铝电池的构造如图所示,当电解质溶液为NaOH溶液时,可知电池的负极材料为_______ (填“Mg”或“Al”),正极上的电极反应式为___________ 。
 ,经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L·min),计算:
,经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L·min),计算:(1)B的转化率
(2)恒温达平衡时容器内的压强与开始时压强比
Ⅱ.化学电池在通讯,交通及日常生活中有着广泛的应用。
(3)碱性锌锰干电池(如图所示)是应用最普遍的电池之一,电池总反应为
 ,碱性锌锰干电池的负极材料是
,碱性锌锰干电池的负极材料是
(4)铅蓄电池是典型的可充电电池,它的正、负极格板都是惰性材料,电池总反应式为
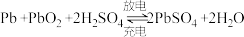 。下列说法正确的是___________(填标号)。
。下列说法正确的是___________(填标号)。| A.电解液中H2SO4的浓度始终保持不变 |
B.放电时正极上的电极反应式为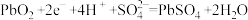 |
| C.放电时,当外电路通过1mol电子时,理论上负极质量增加48g |
D.放电时,溶液中的 向正极移动 向正极移动 |

您最近一年使用:0次
名校
5 . 铁镍蓄电池又称爱迪生电池,放电时的总反应为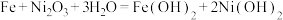 。下列有关该电池的说法不正确的是
。下列有关该电池的说法不正确的是
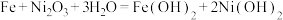 。下列有关该电池的说法不正确的是
。下列有关该电池的说法不正确的是A.电池的电解液为碱性溶液,正极为 、负极为Fe 、负极为Fe |
B.电池放电时,负极反应为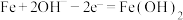 |
C.电池放电时,电子经电解质溶液流入 一极 一极 |
D.电池放电时, 在正极上被还原 在正极上被还原 |
您最近一年使用:0次
2023-05-25更新
|
235次组卷
|
2卷引用:陕西省商洛市洛南中学2022-2023学年高一下学期4月期中考试化学试题
解题方法
6 . 锌锰干电池是应用最普遍的电池之一、其基本反应为:
X极:Zn-2e−=Zn2+ Y极:2MnO2+2NH +2e−=Mn2O3+2NH3+H2O
+2e−=Mn2O3+2NH3+H2O
(1)X是电池的_______ (填“正”或“负”,下同)极,Zn2+向_______ 极移动。
(2)该电池总反应的离子方程式为:_______ 。该反应中MnO2是_______ (填“还原剂”或“氧化剂”)。
(3)若反应消耗16.25g Zn,则电池中转移电子的物质的量为_______ 。
X极:Zn-2e−=Zn2+ Y极:2MnO2+2NH
 +2e−=Mn2O3+2NH3+H2O
+2e−=Mn2O3+2NH3+H2O(1)X是电池的
(2)该电池总反应的离子方程式为:
(3)若反应消耗16.25g Zn,则电池中转移电子的物质的量为
您最近一年使用:0次
名校
7 . 某化学兴趣小组为了探索Zn电极在原电池中的作用,设计并进行了以下一系列实验。
已知:Zn与Al的化学性质基本相似, 。
。
回答下列问题:
(1)实验1:电极材料为Mg和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向Zn。
①正极的电极反应式为___________ 。
②每转移0.1 mol电子,此时负极材料减少的质量为___________ g。
(2)实验2:电极材料为Cu和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向Cu。
由实验1和实验2可知,Mg、Zn、Cu三种金属活动性由强到弱的顺序为___________ 。
(3)实验3:电极材料为石墨和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向石墨。
①电池工作一段时间后,电解质溶液的pH将___________ (填“变大”、“变小”或“不变”)。
②石墨电极上发生___________ (填“氧化”或“还原”)反应。
(4)实验4:电极材料为Mg和Zn,电解质溶液为氢氧化钠溶液,该电池工作时,电流表指针偏向Mg。
①负极的电极反应式为___________ 。
②外电路中电子的流动方向为___________ 。
(5)根据实验1、实验2、实验3、实验4,可总结出影响Zn电极在原电池中得到或失去电子的因素为___________ 。
已知:Zn与Al的化学性质基本相似,
 。
。回答下列问题:
(1)实验1:电极材料为Mg和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向Zn。
①正极的电极反应式为
②每转移0.1 mol电子,此时负极材料减少的质量为
(2)实验2:电极材料为Cu和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向Cu。
由实验1和实验2可知,Mg、Zn、Cu三种金属活动性由强到弱的顺序为
(3)实验3:电极材料为石墨和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向石墨。
①电池工作一段时间后,电解质溶液的pH将
②石墨电极上发生
(4)实验4:电极材料为Mg和Zn,电解质溶液为氢氧化钠溶液,该电池工作时,电流表指针偏向Mg。
①负极的电极反应式为
②外电路中电子的流动方向为
(5)根据实验1、实验2、实验3、实验4,可总结出影响Zn电极在原电池中得到或失去电子的因素为
您最近一年使用:0次
2023-04-18更新
|
353次组卷
|
7卷引用:陕西省西安市第八十三中学2022-2023学年高一下学期中考试化学试题
名校
8 . 某电池的总反应式为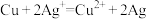 ,该原电池的正确组合是
,该原电池的正确组合是
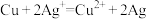 ,该原电池的正确组合是
,该原电池的正确组合是| 选项 | A | B | C | D |
| 正极材料 | Cu | Ag | Ag | Cu |
| 负极材料 | Ag | Cu | Cu | Ag |
| 电解质溶液 |  |  |  |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-03-12更新
|
1549次组卷
|
6卷引用:陕西省汉中市2020-2021学年高一下学期期中联考化学试卷
解题方法
9 . 碱性电池具有容量大.放电电流大的特点,因而得到广泛应用。碱性锌锰电池以氢氧化钾溶液为电解液,电池反应方程式为:
Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s),下列说法中错误的是
Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s),下列说法中错误的是
| A.电池工作时,电子由正极通过外电路流向负极 |
| B.电池正极的电极反应式为2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq) |
| C.电池工作时,锌失去电子 |
| D.外电路中每通过0.2 mol电子,锌的质量减少6.5 g |
您最近一年使用:0次
名校
解题方法
10 . 如图中四种电池装置是依据原电池原理设计的,下列有关叙述正确的是


| A.①中铁电极做负极 |
| B.②中电子由a电极经溶液流向b电极 |
| C.③中外电路中电流由A电极流向B电极 |
| D.④中锂电池工作时,会有Li+从LixC6中脱落下来 |
您最近一年使用:0次
2022-11-22更新
|
699次组卷
|
5卷引用:陕西省咸阳市高新一中2022—2023学年高三上学期第四次质量检测化学试题
陕西省咸阳市高新一中2022—2023学年高三上学期第四次质量检测化学试题宁夏银川市第二中学2022-2023学年高三上学期统练三化学试题(已下线)专题05 化学能与电能的转化(练)-2023年高考化学二轮复习讲练测(新高考专用)湖南省长沙市第一中学2022-2023学年高二下学期第一次月考化学试题辽宁省葫芦岛市第一高级中学2023-2024学年高二下学期期初开学考试提升卷化学试题



