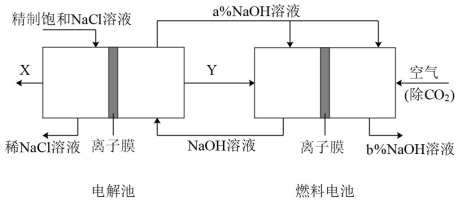
I.把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应: ,经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L·min),计算:
,经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L·min),计算:
(1)B的转化率___________ 。
(2)恒温达平衡时容器内的压强与开始时压强比___________ 。
Ⅱ.化学电池在通讯,交通及日常生活中有着广泛的应用。
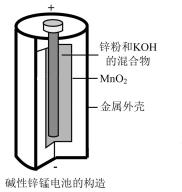
(3)碱性锌锰干电池(如图所示)是应用最普遍的电池之一,电池总反应为 ,碱性锌锰干电池的负极材料是
,碱性锌锰干电池的负极材料是___________ (填名称),负极上发生的电极反应为___________ 。若反应消耗13g负极材料,则电池中转移电子的物质的量为___________ mol。
(4)铅蓄电池是典型的可充电电池,它的正、负极格板都是惰性材料,电池总反应式为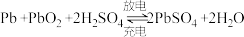 。下列说法正确的是___________(填标号)。
。下列说法正确的是___________(填标号)。
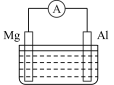
(5)镁铝电池的构造如图所示,当电解质溶液为NaOH溶液时,可知电池的负极材料为_______ (填“Mg”或“Al”),正极上的电极反应式为___________ 。
 ,经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L·min),计算:
,经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L·min),计算:(1)B的转化率
(2)恒温达平衡时容器内的压强与开始时压强比
Ⅱ.化学电池在通讯,交通及日常生活中有着广泛的应用。
(3)碱性锌锰干电池(如图所示)是应用最普遍的电池之一,电池总反应为
 ,碱性锌锰干电池的负极材料是
,碱性锌锰干电池的负极材料是
(4)铅蓄电池是典型的可充电电池,它的正、负极格板都是惰性材料,电池总反应式为
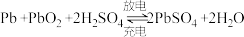 。下列说法正确的是___________(填标号)。
。下列说法正确的是___________(填标号)。| A.电解液中H2SO4的浓度始终保持不变 |
B.放电时正极上的电极反应式为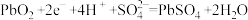 |
| C.放电时,当外电路通过1mol电子时,理论上负极质量增加48g |
D.放电时,溶液中的 向正极移动 向正极移动 |

22-23高一下·陕西安康·期末 查看更多[2]
更新时间:2023-07-13 15:07:35
|
相似题推荐
填空题
|
较易
(0.85)
名校
【推荐1】某温度下,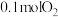 与0.2mol
与0.2mol 在
在 的密闭容器中发生反应:
的密闭容器中发生反应: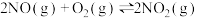 ,其中
,其中 的物质的量随时间变化如下表:
的物质的量随时间变化如下表:
(1)上述反应_______ (填“是”或“不是”)可逆反应,5min时NO的转化率为_______ 。
(2)写出一种加快该反应速率的方法:_______ 。
(3)达到平衡状态时,容器中 的体积分数为
的体积分数为_______ ,2min时氧气的平均反应速率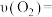
_______ mol∙L−1∙min−1。
(4)下列选项中,能说明该反应已经达到化学平衡状态的有_______ (填字母)。
A.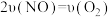 B.
B. 的物质的量不再变化
的物质的量不再变化
C.容器内的颜色不再改变 D.
E.容器内压强不再变化 F.混合气体的密度不再变化
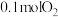 与0.2mol
与0.2mol 在
在 的密闭容器中发生反应:
的密闭容器中发生反应: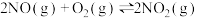 ,其中
,其中 的物质的量随时间变化如下表:
的物质的量随时间变化如下表:| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
 | 0.2 | 0.15 | 0.11 | 0.09 | 0.08 | 0.08 |
(2)写出一种加快该反应速率的方法:
(3)达到平衡状态时,容器中
 的体积分数为
的体积分数为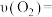
(4)下列选项中,能说明该反应已经达到化学平衡状态的有
A.
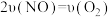 B.
B. 的物质的量不再变化
的物质的量不再变化C.容器内的颜色不再改变 D.

E.容器内压强不再变化 F.混合气体的密度不再变化
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】在2 L密闭容器内,800℃时反应2NO(g)+O2(g)⇌2NO2(g)体系中,n(NO)随时间的变化如表:
(1)800℃,反应进行到2s时,NO的转化率是_______ ,反应达到最大限度时,NO的物质的量浓度为_______ mol/L。
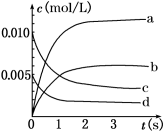
(2)如图中表示NO2变化的曲线是_______ (填字母序号a、b、c、d)。用O2表示从0~2 s内该反应的平均速率v=_______ mol/(L·s)。
(3)能使该反应的反应速率增大的操作是_______。
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)800℃,反应进行到2s时,NO的转化率是
(2)如图中表示NO2变化的曲线是

(3)能使该反应的反应速率增大的操作是_______。
| A.及时分离出NO2气体 | B.适当升高温度 |
| C.增大O2的浓度 | D.选择高效催化剂 |
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】(1)在右图的银锌原电池中,银为_____ 极,电极上发生的是___ 反应(“氧化”或“还原”),电极反应式是__________ 。锌片上观察到的现象为_________ ,电极反应式为__________ 。
(2)若反应过程中有0.2mol电子发生转移,则生成的铜为____ g 。

(2)若反应过程中有0.2mol电子发生转移,则生成的铜为

您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】在铜、锌、稀硫酸构成的原电池中(如图所示)。

(1)负极是__ (填“铜”或“锌”),__ 电子(填“失去”或“得到”),发生__ 反应(填“氧化”或“还原”),电极反应方程式___ ;正极是__ (填“铜”或“锌”)__ 电子(填“失去”或“得到”),发生__ 反应(填“氧化”或“还原”),电极反应方程式__ 。
(2)电流由___ 流向___ (填“铜”或“锌),铜片上观察到的现象是___ 。

(1)负极是
(2)电流由
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】实验小组的同学们将三种金属按照下表的装置进行实验。回答问题:
(1)装置甲中铁极的电极反应式是____________ ,溶液中H+向_____ 极移动(填“正”或“负”)。
(2)装置乙中铜极发生____________ (填“氧化”或“还原”)反应。
(3)装置丙中M极为______ (填“正极”或“负极”),一段时间后溶液的酸性_____________ (填“增强”“减弱”或“不变”)。
(4)Fe、Cu、M中金属活动性最强的是_____________ 。
| 序号 | 甲 | 乙 | 丙 |
| 装置 |  | 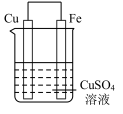 | 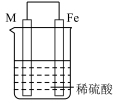 |
| 现象 | 溶液变为浅绿色,Cu极产生大量气泡 | Cu极的质量增加 | M极的质量减少 |
(1)装置甲中铁极的电极反应式是
(2)装置乙中铜极发生
(3)装置丙中M极为
(4)Fe、Cu、M中金属活动性最强的是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】如图为原电池装置示意图,

(1)若A为Zn片,B为石墨棒,电解质溶液为稀硫酸,则A电极名称为_________ ,写出正极的电极反应式______________ ;
(2)若A为铜片,B为银片,电解质为AgNO3溶液,则银片为______________ 极(填正或负),写出电极反应式:负极______________ ,正极______________
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃烧电池,该燃料电池的总反应为______________ 。

(1)若A为Zn片,B为石墨棒,电解质溶液为稀硫酸,则A电极名称为
(2)若A为铜片,B为银片,电解质为AgNO3溶液,则银片为
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃烧电池,该燃料电池的总反应为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】燃料电池是利用燃料与氧气反应从而将化学能转化为电能的装置。
(1)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
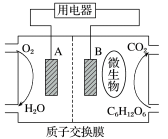
①A为生物燃料电池的______ (填“正”或“负”)极。
②正极反应式为______ 。
③放电过程中,H+向______ 极区迁移(填“A”或“B”)。
④在电池反应中,每消耗1mol氧气,理论上生成标准状况下二氧化碳的体积是______ ,通过外电路的电子是_____ mol。
(2)一氧化碳无色无味有毒,世界各国每年均有不少人因一氧化碳中毒而失去生命。一种一氧化碳分析仪的工作原理如图所示,该装置中电解质为氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由移动。传感器中通过的电流越大,尾气中一氧化碳的含量越高。

①工作时,O2-电极______ 移动(填“a”或“b”)。
②电子在外电路中通过传感器的流动方向是______ (填“由a向b”或“由b向a”)。
(1)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。

①A为生物燃料电池的
②正极反应式为
③放电过程中,H+向
④在电池反应中,每消耗1mol氧气,理论上生成标准状况下二氧化碳的体积是
(2)一氧化碳无色无味有毒,世界各国每年均有不少人因一氧化碳中毒而失去生命。一种一氧化碳分析仪的工作原理如图所示,该装置中电解质为氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由移动。传感器中通过的电流越大,尾气中一氧化碳的含量越高。

①工作时,O2-电极
②电子在外电路中通过传感器的流动方向是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟。下图是钒电池基本工作原理示意图,两电极均为惰性电极,为保证电池稳定运行,“隔膜”选用质子交换膜,请回答下列问题:

钒电池是以溶解于一定浓度硫酸溶液中的不同种类的钒离子(V2+、V3+、VO2+、 )为正极和负极电极反应的活性物质,电池总反应为VO2++V3+ +H2O
)为正极和负极电极反应的活性物质,电池总反应为VO2++V3+ +H2O V2++
V2++ +2H+,放电时,H+由B区通过隔膜移动到A区。
+2H+,放电时,H+由B区通过隔膜移动到A区。
(1)放电时,A为电池的__________ 区(“正极”或“负极”),B区电解液含有的钒离子为__________________ 。
(2)充电时,a为外界电源的_____ 极,A区溶液pH______ (填“增大”、“减小”或“不变”),B区发生的电极反应式为_______________________________________ 。
(3)常温下,NaCl的溶解度为35.9g,利用钒电池电解1L饱和食盐水,当溶液pH变为13时,假设气体全部逸出并且不考虑溶液的体积变化,食盐水质量减少_________ g(精确到0.01),此时钒电池正极与负极区电解液质量将相差______ g(假设原正极与负极区电解液质量相同)。

钒电池是以溶解于一定浓度硫酸溶液中的不同种类的钒离子(V2+、V3+、VO2+、
 )为正极和负极电极反应的活性物质,电池总反应为VO2++V3+ +H2O
)为正极和负极电极反应的活性物质,电池总反应为VO2++V3+ +H2O V2++
V2++ +2H+,放电时,H+由B区通过隔膜移动到A区。
+2H+,放电时,H+由B区通过隔膜移动到A区。(1)放电时,A为电池的
(2)充电时,a为外界电源的
(3)常温下,NaCl的溶解度为35.9g,利用钒电池电解1L饱和食盐水,当溶液pH变为13时,假设气体全部逸出并且不考虑溶液的体积变化,食盐水质量减少
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式为:Zn-2e-+2OH- ZnO+H2O、Ag2O+2e-+H2O
ZnO+H2O、Ag2O+2e-+H2O 2Ag+2OH-,总反应式为Ag2O+Zn
2Ag+2OH-,总反应式为Ag2O+Zn ZnO+2Ag
ZnO+2Ag
根据上述反应式,回答下列问题:
(1)Zn是_______ 极,发生______ 反应,Ag2O发生______ 反应(填“氧化”或“还原”)。
(2)电子流向_______ ,当电路中通过1 mole-时,负极消耗物质的质量是_______ g。(已知:Zn的原子量为65)
(3)在使用过程中,电解质溶液中KOH的物质的量_____ (填“增大”“减小”或“不变”)。
 ZnO+H2O、Ag2O+2e-+H2O
ZnO+H2O、Ag2O+2e-+H2O 2Ag+2OH-,总反应式为Ag2O+Zn
2Ag+2OH-,总反应式为Ag2O+Zn ZnO+2Ag
ZnO+2Ag根据上述反应式,回答下列问题:
(1)Zn是
(2)电子流向
(3)在使用过程中,电解质溶液中KOH的物质的量
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】人们应用原电池原理制作了多种电池,以满足不同的需要。以下各种电池广泛使用于日常生活。生产和科学技术等方面,请根据题中提供的信息填空:
(1)铁、铜、铝是生活中使用广泛的金属, 溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为
溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为_______ ,若将此反应设计成原电池,则负极所用电极材料为_______ ,正极反应式为_______ 。
(2)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为_______ 。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成原电池的负极反应式:_______ 。
(3)某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl,当电路中转移amole-时,交换膜左侧溶液中约减少_______ mol离子。交换膜右侧溶液中c(HCl)_______ (填“>”“<”或“=”)1mol·L-1(忽略溶液体积变化)。

(1)铁、铜、铝是生活中使用广泛的金属,
 溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为
溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为(2)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成原电池的负极反应式:
(3)某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl,当电路中转移amole-时,交换膜左侧溶液中约减少

您最近一年使用:0次

 。
。