名校
1 . 某学习小组用如下图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。___________ 。
(2)在B烧杯中
①Zn电极为原电池的_______ 极(填“正”或“负”),该电极反应式为_______ 。发生的电极反应类型是________ 反应(填氧化或还原)。
②Cu电极上的现象是________ ,该电极反应式为_______ 发生的电极反应类型是_______ 反应(填氧化或还原)。
(3)从能量转化的角度来看,A、B中反应物的总能量___________ (填“大于”、“小于”或“等于”)生成物总能量,A中是将化学能转变为___________ ,B中主要是将化学能转变为___________ 。
(4)该小组同学反思原电池的原理,其中观点不正确的是___________ (填字母序号)。
A.电极一定不能参加反应
B.在原电池装置的内电路中阴离子向正极移动
C.原电池反应的过程中一定有电子转移
D.氧化反应和还原反应可以拆开在两极发生
E.化学能与其他形式的能相互转化的途径是化学反应
F.原电池中电子通过导线由正极极流向负极
(5)在上面的原电池装置中,如果Zn电极溶解了0.65 g,则在Cu电极上产生 的体积约为
的体积约为___________ L(标准状况下)

(2)在B烧杯中
①Zn电极为原电池的
②Cu电极上的现象是
(3)从能量转化的角度来看,A、B中反应物的总能量
(4)该小组同学反思原电池的原理,其中观点不正确的是
A.电极一定不能参加反应
B.在原电池装置的内电路中阴离子向正极移动
C.原电池反应的过程中一定有电子转移
D.氧化反应和还原反应可以拆开在两极发生
E.化学能与其他形式的能相互转化的途径是化学反应
F.原电池中电子通过导线由正极极流向负极
(5)在上面的原电池装置中,如果Zn电极溶解了0.65 g,则在Cu电极上产生
 的体积约为
的体积约为
您最近一年使用:0次
名校
解题方法
2 . I.能源是现代文明的原动力,化学电池在生产生活中有着广泛的应用。
(1)根据构成原电池的本质判断,下列反应可以设计成原电池的是_____ (填序号)。
Ⅱ.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
(2)放电时负极反应为_____ 。
(3)放电时正极附近溶液的碱性_____ (填“增强”或“减弱”或“不变”)。
(4)放电时每转移_____ mol电子,正极有1molK2FeO4被还原。
Ⅲ.回答下列问题:
(5)科学家研发出一种有利于“碳中和”的新电池系统,通过二氧化碳溶于水触发电化学反应,其工作原理如图所示(钠超离子导体只允许Na+通过)。系统工作时,下列有关说法中错误的是_____ 。
Ⅳ.中国科学技术大学开发了一种高性能的水系锰基锌电池。其工作原理如图所示,已知该装置工作一段时间后,K2SO4溶液的浓度增大。_____ 。
(7)a膜为_____ (填“阳离子”或“阴离子”,下同)交换膜,b膜为_____ 交换膜。
(1)根据构成原电池的本质判断,下列反应可以设计成原电池的是
| A.CaO(s)+H2O(l)=Ca(OH)2(aq) | B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) |
| C.2CO(g)+O2(g)=2CO2(g) | D.Fe(s)+2FeCl3(aq)=3FeCl2(aq) |
Ⅱ.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。(2)放电时负极反应为
(3)放电时正极附近溶液的碱性
(4)放电时每转移
Ⅲ.回答下列问题:
(5)科学家研发出一种有利于“碳中和”的新电池系统,通过二氧化碳溶于水触发电化学反应,其工作原理如图所示(钠超离子导体只允许Na+通过)。系统工作时,下列有关说法中错误的是
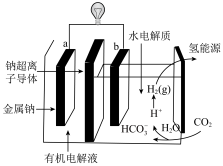
| A.Na+将从a极移动到b极 |
| B.该电池的电解液可以换成更易导电的饱和NaCl溶液 |
C.b极区可能会发生Na++HCO =NaHCO3↓ =NaHCO3↓ |
| D.b极区每生成1molH2转移2mol电子 |
Ⅳ.中国科学技术大学开发了一种高性能的水系锰基锌电池。其工作原理如图所示,已知该装置工作一段时间后,K2SO4溶液的浓度增大。

(7)a膜为
您最近一年使用:0次
2023-04-26更新
|
559次组卷
|
2卷引用:天津市第一中学2022-2023学年高一下学期期中考试化学试题
3 . 回答下列问题:
I.硅是太阳能电池的重要材料,工业冶炼纯硅的原理是:
粗硅冶炼:①SiO2+2C Si+2CO
Si+2CO
精炼硅:②Si+3HCl SiHCl3+H2
SiHCl3+H2
③SiHCl3+H2 Si+3HCl
Si+3HCl
化学反应与能量变化如图所示,回答下列问题:
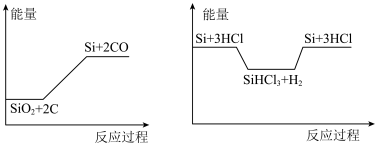
(1)①是______ 反应(填“吸热”或“放热”),反应②与反应③是否为可逆反应______ (填“是”或“否”)。
(2)0.5molSiHCl3发生反应③时,有______ mol极性键断裂。
(3)反应③破坏反应物的化学键所吸收的能量______ (填“大于”或“小于”或“等于”)形成生成物中化学键所放出的能量。
Ⅱ.化学电池的发明,改变了人们的生活。
(4)如图是银锌原电池装置的示意图。回答下列问题:
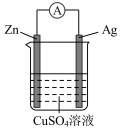
银电极上的电极反应式为_______ ,该原电池的总反应离子方程式为______ 。能证明化学能转化为电能的实验现象是______ 。
(5)如图是常见的锌锰干电池构造示意图。

已知:电池的总反应为Zn+2MnO2+2NH =Zn2++Mn2O3+2NH3+H2O。下列说法正确的是
=Zn2++Mn2O3+2NH3+H2O。下列说法正确的是______ (填字母)。
a.锌筒作负极 b.MnO2作正极 c.MnO2发生还原反应 d.NH4Cl发生氧化反应
I.硅是太阳能电池的重要材料,工业冶炼纯硅的原理是:
粗硅冶炼:①SiO2+2C
 Si+2CO
Si+2CO精炼硅:②Si+3HCl
 SiHCl3+H2
SiHCl3+H2③SiHCl3+H2
 Si+3HCl
Si+3HCl化学反应与能量变化如图所示,回答下列问题:

(1)①是
(2)0.5molSiHCl3发生反应③时,有
(3)反应③破坏反应物的化学键所吸收的能量
Ⅱ.化学电池的发明,改变了人们的生活。
(4)如图是银锌原电池装置的示意图。回答下列问题:

银电极上的电极反应式为
(5)如图是常见的锌锰干电池构造示意图。

已知:电池的总反应为Zn+2MnO2+2NH
 =Zn2++Mn2O3+2NH3+H2O。下列说法正确的是
=Zn2++Mn2O3+2NH3+H2O。下列说法正确的是a.锌筒作负极 b.MnO2作正极 c.MnO2发生还原反应 d.NH4Cl发生氧化反应
您最近一年使用:0次
解题方法
4 . 某化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
根据表中记录的实验现象,回答下列问题。
(1)实验1、2中Al电极的作用是否相同___________ (填“相同”或“不相同”)。
(2)实验3中铝为___________ 极,电极反应式为___________ ;石墨为___________ 极,电极反应式为___________ ;电池总反应为(离子方程式)___________ 。
(3)实验4中铝为___________ 极,原因是___________ ;写出铝电极的电极反应式:___________ 。
| 编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | NaOH溶液 | 偏向Mg |
根据表中记录的实验现象,回答下列问题。
(1)实验1、2中Al电极的作用是否相同
(2)实验3中铝为
(3)实验4中铝为
您最近一年使用:0次
5 . 化学电源的发明是化学对人类的一项重大贡献。
(1)将锌片、铜片按照如图所示装置连接,铜片做__ 极(填“正”或“负”),外电路电子的流向为__ (填“Cu→Zn”或“Zn→Cu”)。
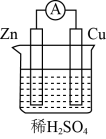
(2)若将装置中的稀H2SO4用CuSO4溶液替代,则相应原电池的总反应的化学方程式为__ 。
(3)下列化学反应通过原电池装置,可实现化学能直接转化为电能的是__ (填序号)。
①NaOH+HCl=NaCl+H2O
②CH4+2O2 CO2+2H2O
CO2+2H2O
③Fe+Cu2+=Cu+Fe2+
(1)将锌片、铜片按照如图所示装置连接,铜片做

(2)若将装置中的稀H2SO4用CuSO4溶液替代,则相应原电池的总反应的化学方程式为
(3)下列化学反应通过原电池装置,可实现化学能直接转化为电能的是
①NaOH+HCl=NaCl+H2O
②CH4+2O2
 CO2+2H2O
CO2+2H2O③Fe+Cu2+=Cu+Fe2+
您最近一年使用:0次
2020-06-02更新
|
457次组卷
|
6卷引用:天津市第二十一中学2020-2021学年高一下学期期中质量检测化学试题
名校
解题方法
6 . 微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn=ZnO+2Ag,其中一个电极反应为Ag2O+H2O+2e-=2Ag+2OH-。

(1)判断正负极的材料。
负极材料_____________ ,正极材料___________ 。
(2)写出另一电极的电极反应式,并判断反应类型。
电极反应式__________
反应类型___________
(3)判断电池工作时,电子的流动方向和电解质溶液中离子的流动方向。电子由______ 到______ ,溶液中的阳离子流向电池的________ ,阴离子流向________
(4)在电池使用的过程中,电解质溶液中KOH的物质的量怎样变化?________ (增大、减小、不变)
(5)当电池工作时通过电路对外提供了1 mol电子,计算消耗的负极的质量_______ 。
(6)氢氧燃料电池为绿色化学电源,在碱性NaOH溶液为电解质溶液时的负极电极反应式为______ 。

(1)判断正负极的材料。
负极材料
(2)写出另一电极的电极反应式,并判断反应类型。
电极反应式
反应类型
(3)判断电池工作时,电子的流动方向和电解质溶液中离子的流动方向。电子由
(4)在电池使用的过程中,电解质溶液中KOH的物质的量怎样变化?
(5)当电池工作时通过电路对外提供了1 mol电子,计算消耗的负极的质量
(6)氢氧燃料电池为绿色化学电源,在碱性NaOH溶液为电解质溶液时的负极电极反应式为
您最近一年使用:0次
2020-03-21更新
|
462次组卷
|
4卷引用:天津市宁河区芦台二中2019-2020学年高一下学期第一次阶段测试化学试题
天津市宁河区芦台二中2019-2020学年高一下学期第一次阶段测试化学试题(已下线)考点09 电化学原理-2020年【衔接教材·暑假作业】新高三一轮复习化学广西桂林市临桂区五通中学2021-2022学年高一下学期期中考试化学试题新疆和田地区皮山县2022-2023学年高二上学期11月期中考试化学试题
名校
7 . 根据电化学知识回答下列问题:
(1)如图所示,在不同的电解质溶液中可以组成不同的电池。

①当电解质溶液为稀硫酸时,Fe电极是________ (填“正”或“负”)极,其电极反应式为__________ 。
②当电解质溶液为NaOH溶液时,Al电极是________ (填“正”或“负”) 极,其电极反应式为_________ 。
③若把铝改为锌,电解质溶液为浓硝酸,则Fe电极是______ (填“正”或“负”)极,其电极反应式为_______________________________ 。
(2)请你利用原电池原理,设计实验,比较铜和银的金属活动性。画出实验装置图,标出正负极、电子流动方向。________

(1)如图所示,在不同的电解质溶液中可以组成不同的电池。

①当电解质溶液为稀硫酸时,Fe电极是
②当电解质溶液为NaOH溶液时,Al电极是
③若把铝改为锌,电解质溶液为浓硝酸,则Fe电极是
(2)请你利用原电池原理,设计实验,比较铜和银的金属活动性。画出实验装置图,标出正负极、电子流动方向。

您最近一年使用:0次
名校
8 . 将A、B两个电极,分别用接线柱平行地固定在一块塑料板上,与电流表连结,插入盛有溶液C的小烧杯中。试回答下列问题:
①若A、B分别为铜和铝,C为稀硫酸,原电池的负极为______ (填“铝”或“铜”)极,铝片上的电极反应式为:____________ 。
②若A、B分别为铜和铝,C为浓HNO3,原电池的负极为_________ (填“铝”或“铜”)极,铝片上的电极反应式为:_______________ 。
③若A、B分别为镁和铝,C为稀硫酸,原电池的负极为_________ (填“铝”或“镁”)极,铝片上的电极反应式为:_______________ 。
④若A、B分别为镁和铝,C为氢氧化钠溶液,原电池的负极为_________ (填“铝”或“镁”)极,铝片上的电极反应式为:_______________ 。
⑤若A、B分别为碳和铝,C为氯化钠溶液,原电池正极上的电极反应式为:_______________ 。
总结可作为原电池正负极判断依据的是:_______________ 。
①若A、B分别为铜和铝,C为稀硫酸,原电池的负极为
②若A、B分别为铜和铝,C为浓HNO3,原电池的负极为
③若A、B分别为镁和铝,C为稀硫酸,原电池的负极为
④若A、B分别为镁和铝,C为氢氧化钠溶液,原电池的负极为
⑤若A、B分别为碳和铝,C为氯化钠溶液,原电池正极上的电极反应式为:
总结可作为原电池正负极判断依据的是:
您最近一年使用:0次



