名校
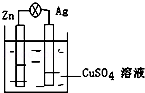
1 . 在银锌原电池中,以硫酸铜为电解质溶液,锌为_____ 极,电极上发生的是_____ 反应(“氧化”或“还原”).电极反应式为_____ ,锌片上观察到的现象为_____ 银为_____ 极,电极上发生的是_____ 反应(“氧化”或“还原”),电极反应式是_____ ,银片上观察到的现象是_____ .

您最近一年使用:0次
2018-04-10更新
|
850次组卷
|
10卷引用:吉林省汪清县第六中学2020-2021学年高二上学期期末考试化学试题
吉林省汪清县第六中学2020-2021学年高二上学期期末考试化学试题河北省故城县高级中学2017-2018学年高一3月月考化学试题宁夏青铜峡市高级中学2017-2018学年高一下学期期中考试化学试题陕西省渭南市临渭区尚德中学2019-2020学年高一下学期网络教学调研评估检测化学试题黑龙江省鸡西市鸡东县第二中学2019-2020学年高一下学期线上考试化学试题甘肃省靖远县第四中学2019-2020学年高一下学期期中考试化学(普通班)试题云南省玉龙纳西族自治县田家炳民族中学2019-2020学年高一下学期期中考试化学(理)试题河北省石家庄市元氏县第四中学2019-2020学年高一下学期期中考试化学试题广西钦州市第四中学2020-2021学年高一下学期4月月考化学试题2陕西省安康市汉滨区江北高级中学2020-2021学年高一下学期第二次月考化学试题
2 . 微型纽扣电池在现代生活中应用广泛。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应是Zn+Ag2O=ZnO+2Ag。请回答下列问题。
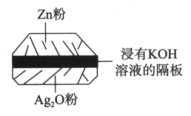
(1)该电池属于__________ 电池(填“一次”或“二次”)。
(2)负极是_________ ,电极反应式是____________ 。
(3)使用时,负极区的pH_______ (填“增大”、“减小”或“不变”,下同),电解质溶液的pH__________ 。

(1)该电池属于
(2)负极是
(3)使用时,负极区的pH
您最近一年使用:0次
解题方法
3 . Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是________ 。电池工作时,电子流向________ (填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是________ 。欲除去Cu2+,最好选用下列试剂中的________ (填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是________ 。若电解电路中通过2 mol电子,MnO2的理论产量为________ 。
(4)用间接电化学法除去NO的过程,如下图所示:
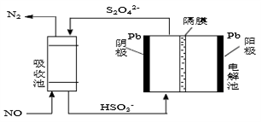
已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:_____________ 。用离子方程式表示吸收池中除去NO的原理:____________________________________ 。
(1)该电池的负极材料是
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是
(4)用间接电化学法除去NO的过程,如下图所示:

已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:
您最近一年使用:0次
2017-12-17更新
|
363次组卷
|
2卷引用:安徽省滁州市民办高中2019-2020学年高二上学期期末考试化学试题
解题方法
4 . 某化学小组的同学为探究原电池原理,设计如图所示装置,将锌、铜通过导线相连,置于稀硫酸中.

(1)锌片上的电极反应式为_____ .
(2)铜片上的现象是_____ .
(3)若反应过程中有0.2mol电子发生转移,则生成的气体在标准状况下的体积为_____ .
(4)该小组同学将稀硫酸分别换成下列试剂,电流计仍会偏转的是_____ (填序号).
A.无水乙醇 B.醋酸溶液 C.CuSO4溶液 D.苯
(5)实验后同学们经过充分讨论,认为符合某些要求的化学反应都可以通过原电池来实现.下列反应可以设计成原电池的是_____ (填字母代号).
A. NaOH+HCl═NaCl+H2O B. 2H2+O2═2H2O
C. Fe+2FeCl3═3FeCl2 D. 2H2O═2H2↑+2O2↑

(1)锌片上的电极反应式为
(2)铜片上的现象是
(3)若反应过程中有0.2mol电子发生转移,则生成的气体在标准状况下的体积为
(4)该小组同学将稀硫酸分别换成下列试剂,电流计仍会偏转的是
A.无水乙醇 B.醋酸溶液 C.CuSO4溶液 D.苯
(5)实验后同学们经过充分讨论,认为符合某些要求的化学反应都可以通过原电池来实现.下列反应可以设计成原电池的是
A. NaOH+HCl═NaCl+H2O B. 2H2+O2═2H2O
C. Fe+2FeCl3═3FeCl2 D. 2H2O═2H2↑+2O2↑
您最近一年使用:0次
2017-08-16更新
|
427次组卷
|
3卷引用:河北省石家庄市元氏县第四中学2019-2020学年高二下学期期末考试化学试题
填空题
|
适中(0.65)
|
5 . 能源是人类生存和发展的重要支柱,化学在能源的开发与利用方面起着十分重要的作用。某学习小组按如下图所示装置探究化学能与电能的相互转化:
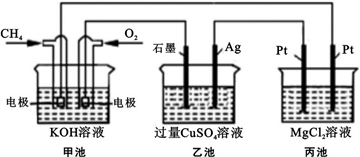
(1) 甲池是_____ 装置,通入CH4气体的电极上的反应式为_____ 。乙池中SO42- 移向_____ 电极(填“石墨”或“Ag”)
(2) 当甲池消耗标况下33.6LO2时,电解质KOH的物质的量变化_____ mol,乙池若要恢复电解前的状态则需要加入_____ g _____ (填物质名称)。
(3) 丙池中发生的电解反应的离子方程式为_____ 。

(1) 甲池是
(2) 当甲池消耗标况下33.6LO2时,电解质KOH的物质的量变化
(3) 丙池中发生的电解反应的离子方程式为
您最近一年使用:0次
6 . 我国每年产生的废旧铅蓄电池约330万吨。从含铅废料(PbSO4、PbO2、PbO等)中回收铅,实现铅的再生,意义重大。一种回收铅的工作流程如下:

(1)铅蓄电池放电时,PbO2作_______ 极。
(2)过程I,已知:PbSO4、PbCO3的溶解度(20℃)见图l;Na2SO4、Na2CO3的溶解度见图2。

①根据图l写出过程I的离子方程式:____ 。
②生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降。根据图2,解释可能原因:
i.温度降低,反应速率降低;
ii.__________________________________________ (请你提出一种合理解释)。
(3)过程Ⅱ,发生反应2PbO2+H2C2O4=2PbO+H2O2+2CO2↑。实验中检测到有大量O2放出,推测PbO2氧化了H2O2,通过实验证实了这一推测。实验方案是__________________ 。(已知:PbO2为棕黑色固体;PbO为橙黄色固体)
(4)过程Ⅲ,将PbO粗品溶解在HCI和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液,生成Pb,如图3。阴极的电极反应式是_______________________ 。


(1)铅蓄电池放电时,PbO2作
(2)过程I,已知:PbSO4、PbCO3的溶解度(20℃)见图l;Na2SO4、Na2CO3的溶解度见图2。

①根据图l写出过程I的离子方程式:
②生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降。根据图2,解释可能原因:
i.温度降低,反应速率降低;
ii.
(3)过程Ⅱ,发生反应2PbO2+H2C2O4=2PbO+H2O2+2CO2↑。实验中检测到有大量O2放出,推测PbO2氧化了H2O2,通过实验证实了这一推测。实验方案是
(4)过程Ⅲ,将PbO粗品溶解在HCI和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液,生成Pb,如图3。阴极的电极反应式是

您最近一年使用:0次
解题方法
7 . 根据下列电化学装置,回答下列问题:
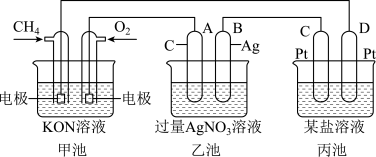
(1)图中甲、乙池的名称:甲池是__________ 装置,乙池是__________ 装置。(填“原电池”或“电解池”)
(2)A(石墨)电极的名称是____________ 。
(3)通入CH4一极的电极反应式为___________________________________ 。
(4)乙池中的电解方程式为___________________________________________ 。
(5)当乙池中B极的质量增加5.4 g时,甲池中理论上消耗O2_____ mL(标准状况下)。此时丙池某电极析出1.6 g某金属,则丙池溶液中的溶质可能是___________ (填序号)。
A.MgSO4 B.CuSO4 C.Na2SO4

(1)图中甲、乙池的名称:甲池是
(2)A(石墨)电极的名称是
(3)通入CH4一极的电极反应式为
(4)乙池中的电解方程式为
(5)当乙池中B极的质量增加5.4 g时,甲池中理论上消耗O2
A.MgSO4 B.CuSO4 C.Na2SO4
您最近一年使用:0次
2017-03-12更新
|
336次组卷
|
2卷引用:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷
12-13高二上·重庆·期末
解题方法
8 .
(1)腐蚀电路板的反应为:Cu+2FeCl3=CuCl2+2FeCl2。
①根据该反应设计一个原电池,在方框中画出该原电池装置图,注明电极材料和电解质溶液
②负极反应式_____________ ;正极反应式_____________ 。
(2)利用电化学原理将CO、SO2转化为重要化工原料,装置如图所示:

①若A为CO,B为H2, C为CH3OH,则通入CO的一极为_______ 极(填“正”或“负”);
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为:____________ 。
(1)腐蚀电路板的反应为:Cu+2FeCl3=CuCl2+2FeCl2。
①根据该反应设计一个原电池,在方框中画出该原电池装置图,注明电极材料和电解质溶液
(2)利用电化学原理将CO、SO2转化为重要化工原料,装置如图所示:

①若A为CO,B为H2, C为CH3OH,则通入CO的一极为
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为:
您最近一年使用:0次
10-11高二上·吉林长春·期末
解题方法
9 . 下图是一个化学过程的示意图。已知甲池的总反应式为: 2CH3OH+3O2+4KOH 2K2CO3+6H2O 填写下列空白:
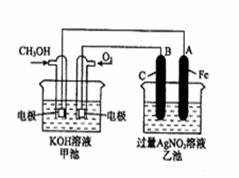
(1)请写出甲、乙两池的名称。甲电池是_______ ,乙池是_______ 。
(2)甲池中通入CH3OH的电极名称是_______ ,电极反应方程式为___________ ;乙池中B(石墨)电极的名称是_______ 。
(3)电解过程中,乙池溶液pH的变化为(“升高”、“降低”或“不变” )________ 。
(4)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2_________ mL(标准状况下)

(1)请写出甲、乙两池的名称。甲电池是
(2)甲池中通入CH3OH的电极名称是
(3)电解过程中,乙池溶液pH的变化为(“升高”、“降低”或“不变” )
(4)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2
您最近一年使用:0次
9-10高二下·福建福州·期末
10 . 下图是铜锌原电池装置。其电池的总反应是: Zn(s) + CuSO4(aq)= ZnSO4(aq) + Cu(s)。
请回答以下问题:
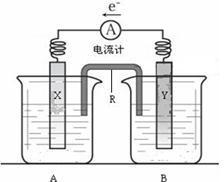
(1)R的名称是__________________ ,R中的阳离子移向_______ (填A或B)中的溶液。
(2)电极Y的材料是________ ,B中的电解质溶液是________________ 。
(3)X为原电池的______ 极,其电极反应式是____________________________ 。
请回答以下问题:

(1)R的名称是
(2)电极Y的材料是
(3)X为原电池的
您最近一年使用:0次



