解题方法
1 . 我国首创以铝—空气—海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则:
(1)电源的负极材料是________ ,负极反应为___________ ;正极反应为___________ 。
(2)熔盐电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32--4e-=4CO2,正极反应式为____________ ,电池总反应式为____________ 。
(1)电源的负极材料是
(2)熔盐电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32--4e-=4CO2,正极反应式为
您最近一年使用:0次
2020-02-11更新
|
344次组卷
|
3卷引用:云南省绥江县第三中学2019-2020学年高二上学期期末考试化学试题
名校
解题方法
2 . 观察如图,回答问题:
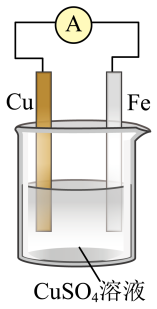
(1)该装置叫__ 装置,可以将__ 能转化为__ 能。
(2)负极是__ ,电极反应式为__ 。
(3)正极是__ ,电极反应式为__ 。
(4)电池总反应的离子方程式为__ 。

(1)该装置叫
(2)负极是
(3)正极是
(4)电池总反应的离子方程式为
您最近一年使用:0次
2020-01-29更新
|
181次组卷
|
3卷引用:陕西省西北工业大学附属中学2022-2023学年高二上学期1月期末考试化学试题
3 . 2019年诺贝尔化学奖授予约翰古迪纳夫、斯坦利惠廷厄姆和吉野彰三位科学家,以表彰他们在锂离子电池研发领域作出的贡献。我国科学家设计了一种锂离子电池,并用此电池来电解含有Na2SO3的工业废水,获得硫酸等物质,如图所示:
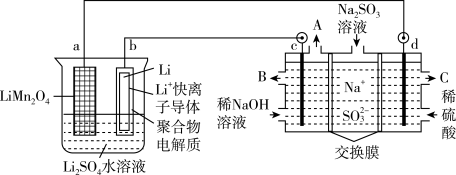
(1)锂离子电池工作时,a极发生____ 反应(填写“氧化”或“还原”),Li+移向__ 极(填写“a”或“b”),写出b极的电极反应式为____________ 。
(2)电解池中物质A的化学式是______ ,其中右侧交换膜应选用______ 交换膜(填写“阳离子”或“阴离子”),该交换膜的作用是________________________ ,写出d极的电极反应式为____________ 。
(3)若电解池左侧溶液的体积为2L,其浓度由2mol•L-1变为4mol•L-1时,理论上电路中通过的电子是______ mol。

(1)锂离子电池工作时,a极发生
(2)电解池中物质A的化学式是
(3)若电解池左侧溶液的体积为2L,其浓度由2mol•L-1变为4mol•L-1时,理论上电路中通过的电子是
您最近一年使用:0次
4 . 微型纽扣电池在现代生活中应用广泛。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应是Zn+Ag2O=ZnO+2Ag。
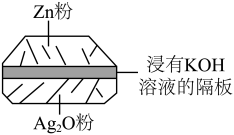
请回答下列问题。
(1)该电池属于_________ 电池(填“一次”或“二次”)。
(2)负极是_________ ,电极反应式是__________________________ 。
(3)使用时,正极区的pH_________ (填“增大”、“减小”或“不变”)。
(4)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_____ 。(填字母)
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H<0
C.2CO(g)+O2(g)=2CO2(1) △H<0
(5)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极的电极反应式为__________ 。

请回答下列问题。
(1)该电池属于
(2)负极是
(3)使用时,正极区的pH
(4)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H<0
C.2CO(g)+O2(g)=2CO2(1) △H<0
(5)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极的电极反应式为
您最近一年使用:0次
名校
解题方法
5 . 图中甲池的总反应式为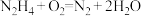 。
。

(1)甲池中负极上的电极反应式为_____________________ 。
(2)乙池中石墨电极上电极反应式为_________________________________ 。
(3)要使乙池恢复到电解前的状态,应向溶液中加入适量的_______________ 。
A.CuO B.Cu(OH)2 C.CuCO3 D.CuSO4
(4)若将乙池中两个电极改成等质量的Fe和Cu,实现在Fe上镀Cu,当甲中消耗1.6gN2H4时,乙池中两个电极质量差为_________________ g。
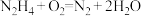 。
。
(1)甲池中负极上的电极反应式为
(2)乙池中石墨电极上电极反应式为
(3)要使乙池恢复到电解前的状态,应向溶液中加入适量的
A.CuO B.Cu(OH)2 C.CuCO3 D.CuSO4
(4)若将乙池中两个电极改成等质量的Fe和Cu,实现在Fe上镀Cu,当甲中消耗1.6gN2H4时,乙池中两个电极质量差为
您最近一年使用:0次
2020-01-07更新
|
132次组卷
|
3卷引用:吉林省长春市实验中学2019-2020学年高二上学期期末考试化学试题
名校
6 . (1)如图所示,若溶液C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为_________ ,A电极的电极反应式为____________ ;反应进行一段时间后溶液C的酸性会____ (填“增强”“减弱”或“基本不变”)。

(2)我国首创以铝—空气—海水电池作为能源的新型海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是______ (填化学名称),负极反应为___________ ;正极反应为_________ 。
(3)熔融盐电池具有高的发电效率,因而受到重视。可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,其负极反应式为2CO+2CO32---4e- 4CO2,则正极反应式为
4CO2,则正极反应式为_____ ,电池总反应式为______ 。

(2)我国首创以铝—空气—海水电池作为能源的新型海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是
(3)熔融盐电池具有高的发电效率,因而受到重视。可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,其负极反应式为2CO+2CO32---4e-
 4CO2,则正极反应式为
4CO2,则正极反应式为
您最近一年使用:0次
2019-05-02更新
|
147次组卷
|
4卷引用:云南省施甸县县第二完全中学2018-2019学年高二下学期期末考试化学试题
名校
7 . 依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
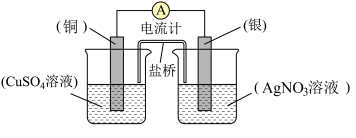
(1)电极铜是原电池的____________ 极(填正或负)。
(2)铜电极上发生的电极反应为___________ ;银电极上发生的电极反应为___________ ;
(3)外电路中的电子是从___________ 电极流向____________ 电极。

(1)电极铜是原电池的
(2)铜电极上发生的电极反应为
(3)外电路中的电子是从
您最近一年使用:0次
8 . 原电池是一种将________ 能转化为_______ 能的装置。如图所示的原电池装置中,锌片发生_________ (填“氧化”或“还原”)反应。铜片上能够观察到的现象是_____________ 。


您最近一年使用:0次
名校
9 . 反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势,如图所示:
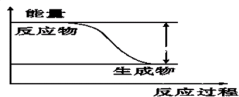
(1)该反应为______ 反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是______ (填字母)。
A.改铁片为铁粉 B.增大压强 C.升高温度 D.将稀硫酸改为98%的浓硫酸
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为____ 极(填“正”或“负”)。铜片上产生的现象为______ ,该极上发生的电极反应为______ 。

(1)该反应为
(2)若要使该反应的反应速率加快,下列措施可行的是
A.改铁片为铁粉 B.增大压强 C.升高温度 D.将稀硫酸改为98%的浓硫酸
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为
您最近一年使用:0次
2018-08-02更新
|
346次组卷
|
3卷引用:内蒙古自治区锦山蒙古族中学2018-2019学年高二上学期期末考试化学试题
名校
10 . 原电池的发明是化学对人类的一项重大贡献。
(1)一种新型燃料电池,它以多孔铂板为两个电极插入稀硫酸中,然后分别向两极通入氢气和氧气而获得电能。通入氢气的电极反应式为_________________ 。
(2)电子工业上常利用FeCl3溶液腐蚀铜板制作印刷电路,若将该反应原理设计成原电池,请写出原电池的正极反应______________________________ 。
(3)常温下,将除去表面氧化膜的铝片、铜片插入浓HNO3中组成原电池装置如图甲所示,测得原电池的电流强度(I)随时间(t)的变化如图乙所示,反应过程中有红棕色气体产生。


t1s前,原电池的负极是铝片,正极的电极反应式为________ ,溶液中的H+向______ (填“正”或“负”)极移动。t1s后,外电路中电子流动方向发生改变,其原因是_________________ 。
(1)一种新型燃料电池,它以多孔铂板为两个电极插入稀硫酸中,然后分别向两极通入氢气和氧气而获得电能。通入氢气的电极反应式为
(2)电子工业上常利用FeCl3溶液腐蚀铜板制作印刷电路,若将该反应原理设计成原电池,请写出原电池的正极反应
(3)常温下,将除去表面氧化膜的铝片、铜片插入浓HNO3中组成原电池装置如图甲所示,测得原电池的电流强度(I)随时间(t)的变化如图乙所示,反应过程中有红棕色气体产生。


t1s前,原电池的负极是铝片,正极的电极反应式为
您最近一年使用:0次
2018-07-21更新
|
398次组卷
|
3卷引用:【全国百强校】吉林省实验中学2018-2019学年高二上学期期末考试化学试题
【全国百强校】吉林省实验中学2018-2019学年高二上学期期末考试化学试题【全国百强校】甘肃省兰州第一中学2017-2018学年高一下学期期末考试化学试题(已下线)《2018-2019学年同步单元双基双测AB卷》第四单元 电化学基础单元测试B卷



