解题方法
1 . 完成下列问题
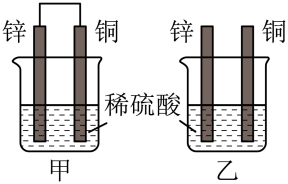
(1)如图所示,能够组成原电池(烧杯里为相应物质的溶液),并且产生明显电流的是_______ 。

(2)某化学小组探究不同条件下化学能转变为电能的装置如图所示。回答问题:若电极a为Fe、电极b为Cu、电解质溶液为稀硫酸时,正极的电极反应式是_______ 。燃料电池的工作原理是将燃料和氧化剂(如O2)反应所产生的化学能直接转化为电能,现设计一燃料电池,以电极a为正极,电极b为负极,CH4为燃料,采用酸性溶液做电解液,则CH4应通入_______ 极 (填“a”或“b”);电池的负极反应式是_______ 。
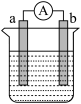
(3)工业电解饱和食盐水制烧碱时必须阻止OH- 移向阳极,目前采用阳离子交换膜将两极溶液分开(如下图所示)。F处加少量NaOH的目的是_______ ;C、D分别是直流电源的两电极,则C是电源_______ 极;若不采用阳离子交换膜,OH-向阳极移动,发生的反应可用离子方程式表示为_______ 。
(1)如图所示,能够组成原电池(烧杯里为相应物质的溶液),并且产生明显电流的是

(2)某化学小组探究不同条件下化学能转变为电能的装置如图所示。回答问题:若电极a为Fe、电极b为Cu、电解质溶液为稀硫酸时,正极的电极反应式是

(3)工业电解饱和食盐水制烧碱时必须阻止OH- 移向阳极,目前采用阳离子交换膜将两极溶液分开(如下图所示)。F处加少量NaOH的目的是

您最近一年使用:0次
2 . 氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺,节能超过30%。在此工艺中,物料传输和转化关系如图,其中电极未标出,所用离子交换膜只允许阳离子通过。
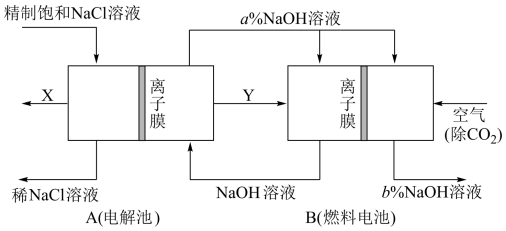
(1)电解池A中,离子交换膜的作用除了平衡电荷并形成闭合回路外,还有:_______ 。
(2)电解池A阴极产物化学式为:_______ 。
(3)燃料电池B负极反应式为:_______ 。
(4)分析比较图示中a%与b%的大小:a%_______ b%(填“>”“<”或“=”)。
(5)假设空气中O2体积比占20%。标准状况下,当得到8.96 L气体X时,电路中通过电子_______ mol,需要通入空气_______ L。
(6)该工艺虽然节约了能源,但与传统氯碱工业相比。产品减少了_______ 的产量。

(1)电解池A中,离子交换膜的作用除了平衡电荷并形成闭合回路外,还有:
(2)电解池A阴极产物化学式为:
(3)燃料电池B负极反应式为:
(4)分析比较图示中a%与b%的大小:a%
(5)假设空气中O2体积比占20%。标准状况下,当得到8.96 L气体X时,电路中通过电子
(6)该工艺虽然节约了能源,但与传统氯碱工业相比。产品减少了
您最近一年使用:0次
3 . 依据氧化还原反应:2Ag+(aq)+Cu(s)=2Ag(s)+Cu2+(aq)设计的原电池如下图所示。
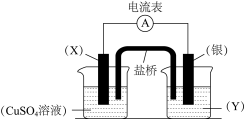
请回答下列问题:
(1)电极X的材料是_______ ,电解质溶液Y是_______ 。
(2)银电极为原电池的_______ 极,发生的电极反应为_______ 。
(3)X电极上发生的电极反应为_______ 。
(4)导线中电流方向是_______ (填“X→银”或“银→X”)。

请回答下列问题:
(1)电极X的材料是
(2)银电极为原电池的
(3)X电极上发生的电极反应为
(4)导线中电流方向是
您最近一年使用:0次
名校
解题方法
4 . 如图所示的装置,C、D、E、F、X、Y都是惰性电极。接通电源后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:

(1)A是外加电源的_______ 极,B是_______ 极。
(2)甲是_______ 池,甲中总的反应式是:_______ 。
(3)收集乙装置中产生的气体,则阴极和阳极产生的气体在相同状态下体积比为:_______ 。
(4)欲用丙装置给铜镀银,铜件是_______ (填G或H)极,电镀液是_______ 溶液。
(5)装置丁中可以观察到_______ ,原因是_______ 。

(1)A是外加电源的
(2)甲是
(3)收集乙装置中产生的气体,则阴极和阳极产生的气体在相同状态下体积比为:
(4)欲用丙装置给铜镀银,铜件是
(5)装置丁中可以观察到
您最近一年使用:0次
名校
解题方法
5 . 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.Zn+CuSO4=ZnSO4+Cu B.2NaOH+H2SO4=Na2SO4+2H2O,判断能否设计成原电池A._______ ,B. _______ 。(填“能”或“不能”)
(2)将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间。
下列说法正确的是_______。
(3)请写出图中构成原电池的正极电极反应式_______ 。
(4)电池工作时,溶液中SO 向
向_______ 极移动(填“锌”或“铜”);电池工作完成后,溶液中SO 浓度
浓度_______ (填“增大”“减小”或“不变”)。
(5)化学能可与热能、电能等相互转化。下列表述错误的是_______。
(1)现有如下两个反应:A.Zn+CuSO4=ZnSO4+Cu B.2NaOH+H2SO4=Na2SO4+2H2O,判断能否设计成原电池A.
(2)将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间。

下列说法正确的是_______。
| A.甲、乙装置均实现了化学能转变为电能 |
| B.甲中铜片上有气体产生,铜片发生了氧化反应 |
| C.两烧杯中反应原理相同,稀硫酸起始浓度相同,因而反应速率相同 |
| D.两烧杯溶液中的H+均被消耗,因而H+浓度减小 |
(4)电池工作时,溶液中SO
 向
向 浓度
浓度(5)化学能可与热能、电能等相互转化。下列表述错误的是_______。

| A.化学反应中能量变化的主要原因是化学键的断裂与形成 |
| B.酸碱中和反应中,反应物的总能量比生成物的总能量高 |
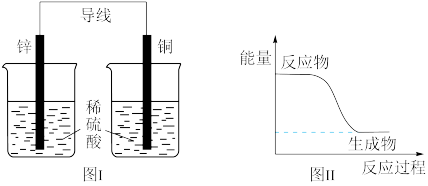
| C.图I所示的装置能将化学能转变为电能 |
| D.图II所示的反应为放热反应 |
您最近一年使用:0次
2023-01-12更新
|
342次组卷
|
2卷引用:上海市闵行(文绮)中学2022-2023学年高二上学期期末学情调研化学试题
名校
解题方法
6 . 燃料电池可以将燃料的化学能直接转化为电能,能量利用率高。
(1)碱性燃料电池(AFC)是最早进入实用阶段的燃料电池之一,也是最早用于车辆的燃料电池,以KOH、NaOH溶液之类的强碱性溶液为电解质溶液。其优点为性能可靠,具有较高的效率。甲烷碱性燃料电池正极的电极反应式为_______
(2)某燃料电池主要构成要素如图所示
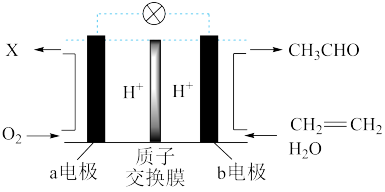
电流方向为__ ;电池工作时,X为___ ; a电极的反应式为___ ; b电极的反应式为____ 。
(1)碱性燃料电池(AFC)是最早进入实用阶段的燃料电池之一,也是最早用于车辆的燃料电池,以KOH、NaOH溶液之类的强碱性溶液为电解质溶液。其优点为性能可靠,具有较高的效率。甲烷碱性燃料电池正极的电极反应式为
(2)某燃料电池主要构成要素如图所示

电流方向为
您最近一年使用:0次
名校
解题方法
7 . 按照要求回答下列问题。
(1)在强碱性条件下用电解法除去废水中的 ,装置如图所示,阳极和阳极区依次发生的反应有:
,装置如图所示,阳极和阳极区依次发生的反应有:

i.
ii.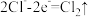
iii.
除去 ,外电路中至少需要转移
,外电路中至少需要转移_______ mol电子。
(2)为了使电解池连续工作,需要不断补充NaCl及_______ 。
(3)用NaOH溶液吸收烟气中的 ,将所得的
,将所得的 溶液进行电解,可循环再生NaOH,同时得到
溶液进行电解,可循环再生NaOH,同时得到 ,其原理如下图所示(电极材料为石墨)。
,其原理如下图所示(电极材料为石墨)。
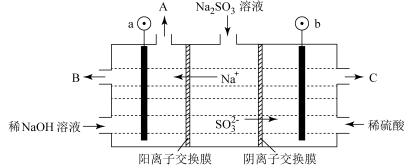
①图中a极要连接电源的_______ 填“正”或“负”)极,C口流出的物质是_______ 。
② 放电的电极反应式为
放电的电极反应式为_______ 。
(4)用零价铁(Fe)去除水体中的硝酸盐( )已成为环境修复研究的热点之一、Fe还原酸性水体中的
)已成为环境修复研究的热点之一、Fe还原酸性水体中的 的反应原理如图所示。
的反应原理如图所示。
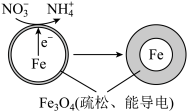
①作负极的物质是_______ 。
②正极的电极反应式是_______ 。
(1)在强碱性条件下用电解法除去废水中的
 ,装置如图所示,阳极和阳极区依次发生的反应有:
,装置如图所示,阳极和阳极区依次发生的反应有:
i.

ii.
iii.

除去
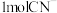 ,外电路中至少需要转移
,外电路中至少需要转移(2)为了使电解池连续工作,需要不断补充NaCl及
(3)用NaOH溶液吸收烟气中的
 ,将所得的
,将所得的 溶液进行电解,可循环再生NaOH,同时得到
溶液进行电解,可循环再生NaOH,同时得到 ,其原理如下图所示(电极材料为石墨)。
,其原理如下图所示(电极材料为石墨)。
①图中a极要连接电源的
②
 放电的电极反应式为
放电的电极反应式为(4)用零价铁(Fe)去除水体中的硝酸盐(
 )已成为环境修复研究的热点之一、Fe还原酸性水体中的
)已成为环境修复研究的热点之一、Fe还原酸性水体中的 的反应原理如图所示。
的反应原理如图所示。
①作负极的物质是
②正极的电极反应式是
您最近一年使用:0次
2022-12-11更新
|
314次组卷
|
4卷引用:湖南省衡阳市第八中学2022-2023学年高二上学期期末考试化学试题
解题方法
8 . 回答下列问题
(1)图中甲池是_____ (“原电池”或“电解池”)装置,其中OH-移向 _____ (填“CH4”或“O2")极。
(2)写出通入CH4的电极的电极反应式:_______________________________________
(3)向乙池两电极附近分别滴加适量紫色石蕊溶液,附近变红的电极为_________ (填“A"或“B")极,并写出此电极的电极反应式______________________________________________
(4)乙池中总反应的离子方程式为______________________________
(5)常温下,当乙池中B(Ag)极的质量增加5.40g时,乙池的pH是_______________ (若此时乙池中溶液的体积为500mL);此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是________________ (填字母)。
A.MgSO4 B.CuSO4 C.NaCl

(1)图中甲池是
(2)写出通入CH4的电极的电极反应式:
(3)向乙池两电极附近分别滴加适量紫色石蕊溶液,附近变红的电极为
(4)乙池中总反应的离子方程式为
(5)常温下,当乙池中B(Ag)极的质量增加5.40g时,乙池的pH是
A.MgSO4 B.CuSO4 C.NaCl
您最近一年使用:0次
9 . 应用电化学原理,回答下列问题:

(1)上述三个装置中,负极反应物化学性质上的共同特点是___________ 。
(2)甲中电流计指针偏移时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是___________ 。
(3)乙中正极反应式为___________ ;若将 换成
换成 ,则负极反应式为
,则负极反应式为___________ 。
(4)丙中正极的电极反应式为___________ 。
(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。按下图连接装置并加入药品(盐桥中的物质不参与反应),进行实验:
ⅰ.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
ⅱ.随后向U型管左侧逐渐加入浓 溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
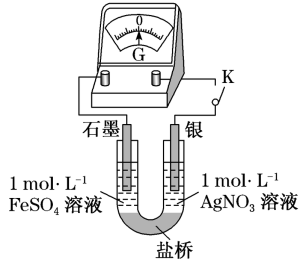
①实验ⅰ中银作___________ 极。
②综合实验ⅰ、ⅱ的现象,得出 和
和 反应的离子方程式是
反应的离子方程式是___________

(1)上述三个装置中,负极反应物化学性质上的共同特点是
(2)甲中电流计指针偏移时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是
(3)乙中正极反应式为
 换成
换成 ,则负极反应式为
,则负极反应式为(4)丙中正极的电极反应式为
(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。按下图连接装置并加入药品(盐桥中的物质不参与反应),进行实验:
ⅰ.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
ⅱ.随后向U型管左侧逐渐加入浓
 溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
①实验ⅰ中银作
②综合实验ⅰ、ⅱ的现象,得出
 和
和 反应的离子方程式是
反应的离子方程式是
您最近一年使用:0次
2022-12-02更新
|
326次组卷
|
2卷引用:广东省广州大学附中2023-2024学年高二上学期期末化学模拟试卷
10 . 能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标。
(1)如图所示,组成一个原电池。

①当电解质溶液为稀硫酸时:Cu电极是____ (填“正”或“负”)极,其电极反应为____ 。
②当电解质溶液为浓硝酸时:Cu电极是____ 极,其电极反应为____ 。
(2)请写出电解硫酸铜溶液的总化学方程式_____ 。
(1)如图所示,组成一个原电池。

①当电解质溶液为稀硫酸时:Cu电极是
②当电解质溶液为浓硝酸时:Cu电极是
(2)请写出电解硫酸铜溶液的总化学方程式
您最近一年使用:0次



