名校
1 . 以软锰矿(主要成分为 )为原料制备粗二氧化锰颗粒的过程如下:
)为原料制备粗二氧化锰颗粒的过程如下:
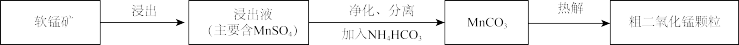
(1)浸出
①通入 浸出锰元素,该反应的化学方程式为
浸出锰元素,该反应的化学方程式为_______ 。
②研究表明, 可催化浸出效果,其催化过程如下:
可催化浸出效果,其催化过程如下:
过程Ⅰ: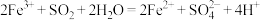 过程Ⅱ:……
过程Ⅱ:……
过程Ⅱ的离子方程式是_______ 。
③浸出液中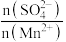 比值明显大于1,可能的原因是
比值明显大于1,可能的原因是_______ 。
(2)净化、分离
软锰矿浸出液中的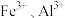 可通过加碱转化为沉淀去除,分离出清液的方法是
可通过加碱转化为沉淀去除,分离出清液的方法是_______ 。
(3)热解
在一定空气流速下,相同时间内 热解产物中不同价态
热解产物中不同价态 (Ⅱ、Ⅲ等代表锰元素的化合价)的占比随热解温度的变化如图。
(Ⅱ、Ⅲ等代表锰元素的化合价)的占比随热解温度的变化如图。 热解过程中涉及如下化学反应:
热解过程中涉及如下化学反应:
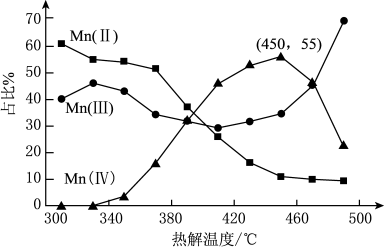
注:图中Mn(Ⅱ)等表示化合物中锰元素的价态
ⅰ.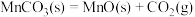
ⅱ.
ⅲ.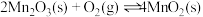
①为了增大产物中 的占比,可以采用的措施是
的占比,可以采用的措施是_______ (答出两条)。
②温度升高,产物中 的占比均降低,可能的原因是
的占比均降低,可能的原因是_______ 。
(4)碱性锌锰电池的总反应为: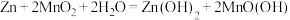 。
。
①电池的负极为_______ 。
②正极的电极反应为_______ 。
 )为原料制备粗二氧化锰颗粒的过程如下:
)为原料制备粗二氧化锰颗粒的过程如下: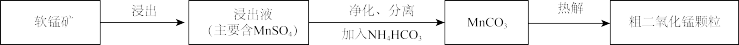
(1)浸出
①通入
 浸出锰元素,该反应的化学方程式为
浸出锰元素,该反应的化学方程式为②研究表明,
 可催化浸出效果,其催化过程如下:
可催化浸出效果,其催化过程如下:过程Ⅰ:
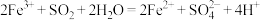 过程Ⅱ:……
过程Ⅱ:……过程Ⅱ的离子方程式是
③浸出液中
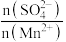 比值明显大于1,可能的原因是
比值明显大于1,可能的原因是(2)净化、分离
软锰矿浸出液中的
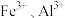 可通过加碱转化为沉淀去除,分离出清液的方法是
可通过加碱转化为沉淀去除,分离出清液的方法是(3)热解
在一定空气流速下,相同时间内
 热解产物中不同价态
热解产物中不同价态 (Ⅱ、Ⅲ等代表锰元素的化合价)的占比随热解温度的变化如图。
(Ⅱ、Ⅲ等代表锰元素的化合价)的占比随热解温度的变化如图。 热解过程中涉及如下化学反应:
热解过程中涉及如下化学反应:
注:图中Mn(Ⅱ)等表示化合物中锰元素的价态
ⅰ.
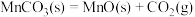
ⅱ.

ⅲ.
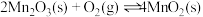
①为了增大产物中
 的占比,可以采用的措施是
的占比,可以采用的措施是②温度升高,产物中
 的占比均降低,可能的原因是
的占比均降低,可能的原因是(4)碱性锌锰电池的总反应为:
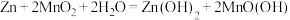 。
。①电池的负极为
②正极的电极反应为
您最近一年使用:0次
名校
解题方法
2 . 某学习小组探究某浓度浓硝酸和稀硝酸与铁的反应。
(1)Ⅰ中液面上方气体由无色变为红棕色的化学方程式为_______ 。
(2)取少量Ⅰ中溶液,加入KSCN溶液,_______ (填现象),说明产生了Fe3+。
(3)Ⅱ中现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应。说明硝酸具有_______ 性。
(4)Ⅲ中,连接导线后体系形成了原电池。为分析反应过程,在Fe、Cu之间连接电流计,实验如下。
①用方程式解释现象ⅳ:_______ 。
②推测现象ⅰ中被还原的是_______ 。
③解释现象ii中指针左右偏转,往复多次的原因_______ 。
④现象ⅲ中,Fe一直做负极,难以形成氧化层,可能的原因是_______ 。
| 实验 | 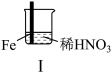 | 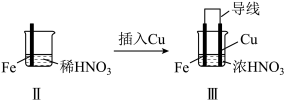 | |
| 现象 | Ⅰ中:Fe表面产生大量无色气泡,液面上方变为红棕色 | Ⅱ中:Fe表面产生红棕色气泡,过一会儿停止 | Ⅲ中:连接导线,一段时间后Fe表面产生红棕色气泡,而后停止;随即又产生红棕色气泡,而后停止,……如此往复多次。Cu表面始终产生红棕色气泡 |
(2)取少量Ⅰ中溶液,加入KSCN溶液,
(3)Ⅱ中现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应。说明硝酸具有
(4)Ⅲ中,连接导线后体系形成了原电池。为分析反应过程,在Fe、Cu之间连接电流计,实验如下。
| 实验 | 现象 |
 | ⅰ.K闭合时,指针向左偏转(Cu做负极),Fe表面无明显现象 ⅱ.过一会儿指针向右偏,Fe表面产生红棕色气体;后又迅速向左偏,Fe表面停止产生气泡,……如此往复多次 ⅲ.一段时间后,指针一直处于右端,Fe表面持续产生红棕色气体 ⅳ.Cu表面始终产生红棕色气泡 |
②推测现象ⅰ中被还原的是
③解释现象ii中指针左右偏转,往复多次的原因
④现象ⅲ中,Fe一直做负极,难以形成氧化层,可能的原因是
您最近一年使用:0次
2021-04-05更新
|
836次组卷
|
5卷引用:北京市朝阳区2021届高三一模化学试题
北京市朝阳区2021届高三一模化学试题(已下线)押山东卷第20题 化学实验综合题-备战2021年高考化学临考题号押题(山东卷)2021年北京高考化学试题变式题11-19辽宁省葫芦岛市普通高中2021-2022学年高三上学期期末学业质量监测化学试题北京市顺义区第一中学2023-2024学年高三上学期期中考试化学试题



