名校
解题方法
1 . Mg-空气电池的工作原理如下图所示。下列说法正确的是


| A.电极A是该电池的正极 |
| B.电极B附近溶液的pH增大 |
| C.电池工作时,电子由电极B经外电路流向电极A |
| D.电池工作时的主要反应为:Mg+2H+=Mg2++H2↑ |
您最近一年使用:0次
2021-11-28更新
|
419次组卷
|
4卷引用:海南省琼海市嘉积中学2022-2023学年高二上学期第二次月考(期中)化学试题
名校
2 . Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:2AgCl+ Mg =Mg2++ 2Ag +2Cl-。有关该电池的说法正确 的是
| A.Mg为电池的正极 | B.负极反应为AgCl+e- = Ag + Cl- |
| C.电流由镁电极经外电路流向正极 | D.Cl-移向负极 |
您最近一年使用:0次
解题方法
3 . 氧化铅-铜电池是一种电解质可循环流动的新型电池(如图所示),电池总反应为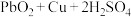
 。下列有关该电池的说法正确的是
。下列有关该电池的说法正确的是

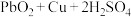
 。下列有关该电池的说法正确的是
。下列有关该电池的说法正确的是
| A.电池工作时,电子由Cu电极经电解质溶液流向PbO2电极 |
| B.电池工作过程中,电解质溶液的质量逐渐减小 |
C.正极反应式: |
| D.电池工作过程中,两个电极的质量均减小 |
您最近一年使用:0次
名校
4 . 锂电池用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中形成的,该电池的总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,下列叙述中正确的是( )
| A.电解质溶液中混入水,对电池反应无影响 |
| B.上述过程中是化学能转化成电能 |
| C.电池工作过程中,亚硫酰氯(SOCl2)被氧化为Li2SO3 |
| D.电池放电时,金属锂提供电子的物质的量与析出硫的物质的量之比为4 :1 |
您最近一年使用:0次
解题方法
5 . (1)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。电极b作________ 极,表面发生的电极反应为_______ 。

(2)浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。
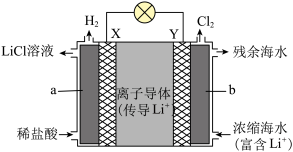
①X为________ 极,Y电极反应式为_______________________
②Y极生成1 mol Cl2时,________ mol Li+移向________ (填“X”或“Y”)极。

(2)浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。

①X为
②Y极生成1 mol Cl2时,
您最近一年使用:0次
6 . 如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是
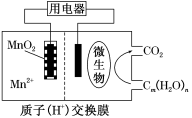

| A.分子组成为Cm(H2O)n的物质一定是糖类 |
| B.微生物所在电极区放电时发生氧化反应 |
| C.放电过程中,H+从正极区移向负极区 |
| D.正极反应式为MnO2+4H++2e-=Mn2++2H2O |
您最近一年使用:0次
名校
7 . SO2在生产、生活中有着广泛的用途。
(1)请你列举一个SO2在生活中的用途:______________________ 。
(2)SO2在工业上常用于硫酸生产:2SO2(g)+O2(g) 2SO3(g),该反应在一定条件下进行时的热效应如图所示,则其逆反应的活化能为
2SO3(g),该反应在一定条件下进行时的热效应如图所示,则其逆反应的活化能为__________________ 。
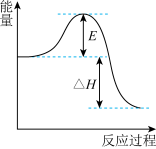

(3)上图中L、X表示物理量温度或压强,依据题中信息可判断:
①X表示的物理量是_________________________ ,
②L1________ (填“>”“<”或“=”)L2。
(4)在容积固定的密闭容器中,起始时充入0.2molSO2和0.1molO2,反应体系起始总压强为0.1MPa。反应在一定的温度下达到平衡时SO2的转化率为90%。该反应的压强平衡常数Kp=__________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)利用原电池原理,也可用SO2和O2来制备硫酸,该电池用多孔材料作电极。请写出该电池负极的电极反应式:__________________________________________ 。
(1)请你列举一个SO2在生活中的用途:
(2)SO2在工业上常用于硫酸生产:2SO2(g)+O2(g)
 2SO3(g),该反应在一定条件下进行时的热效应如图所示,则其逆反应的活化能为
2SO3(g),该反应在一定条件下进行时的热效应如图所示,则其逆反应的活化能为

(3)上图中L、X表示物理量温度或压强,依据题中信息可判断:
①X表示的物理量是
②L1
(4)在容积固定的密闭容器中,起始时充入0.2molSO2和0.1molO2,反应体系起始总压强为0.1MPa。反应在一定的温度下达到平衡时SO2的转化率为90%。该反应的压强平衡常数Kp=
(5)利用原电池原理,也可用SO2和O2来制备硫酸,该电池用多孔材料作电极。请写出该电池负极的电极反应式:
您最近一年使用:0次
名校
8 . 已知在一容器中发生反应:Fe+Cu2+=Fe2++Cu,有关说法正确的是
| A.可能为电解池反应,Fe做阴极,CuSO4溶液做电解液 |
| B.可能为原电池反应,负极Fe被还原为Fe2+ |
| C.可能为电解池反应,阳极反应:Fe-2e-=Fe2+ |
| D.可能为原电池反应,Fe做负极,Zn做正极,CuSO4溶液为电解液 |
您最近一年使用:0次
2016-12-09更新
|
158次组卷
|
5卷引用:海南省农垦中学2023-2024学年高二上学期期末考试化学试题(A卷)
真题
名校
9 . 锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。 回答下列问题:
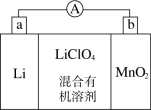
(1)外电路的电流方向是由________ 极流向________ 极(填字母)。
(2)电池正极反应式为___________________________________ 。
(3)是否可用水代替电池中的混合有机溶剂?________ (填“是”或“否”),原因是________________________________________________________________ 。
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为_______________________________________________ 。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为___________ 。

(1)外电路的电流方向是由
(2)电池正极反应式为
(3)是否可用水代替电池中的混合有机溶剂?
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为
您最近一年使用:0次
2016-12-09更新
|
4988次组卷
|
15卷引用:2014年全国普通高等学校招生统一考试理科综合能力测试化学(海南卷)
2014年全国普通高等学校招生统一考试理科综合能力测试化学(海南卷)(已下线)2014-2015学年黑龙江省哈尔滨市第六中学高二10月月考化学试卷河北省张家口市第一中学2016-2017学年高一(衔接班)6月月考(理)化学试题福建省惠安惠南中学2017-2018学年高二10月月考(理)化学试题湖北省沙市中学2018届高三上学期第二次双周考试化学试题河南省郑州市第一中学2018-2019学年高二上学期入学测试化学试题(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(教学案)(已下线)2019高考备考二轮复习精品资料-专题10 电化学及其应用(教学案)湖南省双峰县第一中学2018-2019学年高一6月月考化学试题安徽省淮北市第一中学2019-2020学年高一下学期第二次线上学习考试(3月)化学试题山东省德州市齐河县实验中学2019-2020学年高一下学期期中考试化学试题人教版(2019)高二选择性必修第一册 第四章 化学反应与电能 第一节 原电池 教材帮浙江省宁波市北仑中学2020-2021学年高一下学期期中考试化学(1班选考)试题河南省新蔡县第一高级中学2020-2021学年高一下学期5月月考化学试题黑龙江省大兴安岭呼玛县高级中学2021-2022学年高二上学期期末考试化学试题
2009·浙江·高考真题
10 . 市场上经常见锂离子电池,它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为:
Li + 2Li0.35NiO2 2Li0.85NiO2。下列说法不正确的是
2Li0.85NiO2。下列说法不正确的是
Li + 2Li0.35NiO2
 2Li0.85NiO2。下列说法不正确的是
2Li0.85NiO2。下列说法不正确的是 | A.放电时,负极的电极反应式:Li — e-= Li+ |
| B.该电池不能用水溶液作为电解质 |
| C.充电时,Li0.5NiO2既发生氧化反应又发生还原反应 |
| D.放电过程中Li+向负极移动 |
您最近一年使用:0次
2016-12-09更新
|
301次组卷
|
16卷引用:2014届海南省琼海市嘉积中学高三上学期教学质量监测化学试卷
(已下线)2014届海南省琼海市嘉积中学高三上学期教学质量监测化学试卷2009年普通高等学校招生统一考试理综试题化学部分(浙江卷)2009高考真题汇编-碱金属元素及其化合物(已下线)2010年天津一中高二下学期期中考试化学试题(已下线)2010—2011学年黑龙江省鹤岗一中高一下学期期末考试化学试卷(已下线)2012-2013学年山东省冠县武训高中高二10月月考化学试卷(已下线)2012-2013学年山东省冠县武训高中高二10月月考化学试卷2015-2016学年河南省安阳三十六中高二上学期期中考试化学试卷2016届黑龙江省哈尔滨师大附属中学高三上12月月考化学试卷2016-2017学年吉林省长春实验中学高二上9月月考化学卷(已下线)同步君 选修4 第4章 第2节 化学电源高中化学人教版 选修四 第四章 电化学基础 第二节 化学电源 化学电源2020年安徽省全省教学质量检测统一考试(练习检测一)四川省南充市白塔中学2019-2020学年高二下学期开学考试化学试题(已下线)【南昌新东方】江西省九江第一中学2018-2019学年高二上学期第二次月考化学试题福建省仙游县第二中学2022-2023学年高二上学期期中考试(选考班)化学试题



