锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。 回答下列问题:
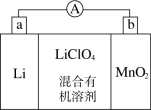
(1)外电路的电流方向是由________ 极流向________ 极(填字母)。
(2)电池正极反应式为___________________________________ 。
(3)是否可用水代替电池中的混合有机溶剂?________ (填“是”或“否”),原因是________________________________________________________________ 。
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为_______________________________________________ 。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为___________ 。

(1)外电路的电流方向是由
(2)电池正极反应式为
(3)是否可用水代替电池中的混合有机溶剂?
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为
2014·海南·高考真题 查看更多[15]
2014年全国普通高等学校招生统一考试理科综合能力测试化学(海南卷)(已下线)2014-2015学年黑龙江省哈尔滨市第六中学高二10月月考化学试卷河北省张家口市第一中学2016-2017学年高一(衔接班)6月月考(理)化学试题福建省惠安惠南中学2017-2018学年高二10月月考(理)化学试题湖北省沙市中学2018届高三上学期第二次双周考试化学试题河南省郑州市第一中学2018-2019学年高二上学期入学测试化学试题(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(教学案)(已下线)2019高考备考二轮复习精品资料-专题10 电化学及其应用(教学案)湖南省双峰县第一中学2018-2019学年高一6月月考化学试题安徽省淮北市第一中学2019-2020学年高一下学期第二次线上学习考试(3月)化学试题山东省德州市齐河县实验中学2019-2020学年高一下学期期中考试化学试题人教版(2019)高二选择性必修第一册 第四章 化学反应与电能 第一节 原电池 教材帮浙江省宁波市北仑中学2020-2021学年高一下学期期中考试化学(1班选考)试题河南省新蔡县第一高级中学2020-2021学年高一下学期5月月考化学试题黑龙江省大兴安岭呼玛县高级中学2021-2022学年高二上学期期末考试化学试题
更新时间:2016-12-09 06:06:40
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】在400°C,0.1MPa 以及Xe过量条件下,Xe和F2可以直接反应生成+2价态的化合物。反应的方程式是___________ 。所生成的氟化物与碘阴离子在常温下即可以反应,相应的反应式是___________ 。该反应说明氟化物具有(氧化性、还原性中选一项回答)___________ 。该氟化物溶于水,且缓慢地与水产生反应,反应式是___________ 。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】焦亚硫酸钠Na2S205可用作食品的抗氧化剂,请回答下列问题:
(1)工业上生产Na2S205,通常是由NaHS03过饱和溶液经结晶脱水制得。该反应______ (填“是”或“不是”)氧化还原反应。
(2)Na2S205在水溶液中很容易被碘单质氧化,写出该反应的离子方程式_____ 。
(3)在测定某葡萄酒中Na2S205残留量时,取20.00 mL某葡萄酒样品置于锥形瓶中,用0.01000 mol•L-1的碘标准液滴定至终点,消耗碘标准液10.00mL。请回答下列问题:
①滴定时应将碘标准液装在_____ (填“酸式”或“碱式”)滴定管中,若该滴定操作选择淀粉溶液作为指示剂,则滴定终点的现象为_______ 。
②利用上述数据,可计算出该葡萄酒样品中Na2S205的残留量为____ g•L-1 (以SO2 计)。
③上述滴定完成时,若滴定管尖嘴处留有气泡会导致测量结果偏____ (填“高”或 “低”)。
(1)工业上生产Na2S205,通常是由NaHS03过饱和溶液经结晶脱水制得。该反应
(2)Na2S205在水溶液中很容易被碘单质氧化,写出该反应的离子方程式
(3)在测定某葡萄酒中Na2S205残留量时,取20.00 mL某葡萄酒样品置于锥形瓶中,用0.01000 mol•L-1的碘标准液滴定至终点,消耗碘标准液10.00mL。请回答下列问题:
①滴定时应将碘标准液装在
②利用上述数据,可计算出该葡萄酒样品中Na2S205的残留量为
③上述滴定完成时,若滴定管尖嘴处留有气泡会导致测量结果偏
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】中国环境监测总站数据显示,颗粒物 等
等 为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对
为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对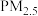 、
、 、
、 等进行研究具有重要意义。请回答下列问题:
等进行研究具有重要意义。请回答下列问题:
(1)将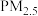 样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据计算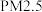 待测试样的pH =
待测试样的pH =___________ 。
(2)汽车发动机工作时会引发 和
和 反应,当尾气中空气不足时,
反应,当尾气中空气不足时, 在催化转化器中被还原成
在催化转化器中被还原成 排出。写出NO被CO还原的化学方程式
排出。写出NO被CO还原的化学方程式________ 。
(3)碘循环工艺不仅能吸收 降低环境污染,同时又能制得氢气,具体流程如下:
降低环境污染,同时又能制得氢气,具体流程如下:
①用离子方程式表示反应器中发生的反应_______ 。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出 的目的是
的目的是_______ 。
(4)下图是用 脱除烟气中NO的原理。
脱除烟气中NO的原理。
①该脱硝原理中,NO最终转化为________  填化学式
填化学式 和H2O。
和H2O。
②当消耗 和
和 时,除去的NO在标准状况下的体积为
时,除去的NO在标准状况下的体积为____ L。
 等
等 为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对
为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对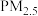 、
、 、
、 等进行研究具有重要意义。请回答下列问题:
等进行研究具有重要意义。请回答下列问题: (1)将
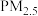 样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表: | 离子 |  |  |  |  | 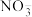 |  |
浓度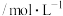 | 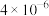 | 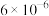 | 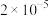 | 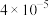 | 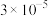 | 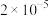 |
根据表中数据计算
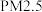 待测试样的pH =
待测试样的pH =(2)汽车发动机工作时会引发
 和
和 反应,当尾气中空气不足时,
反应,当尾气中空气不足时, 在催化转化器中被还原成
在催化转化器中被还原成 排出。写出NO被CO还原的化学方程式
排出。写出NO被CO还原的化学方程式(3)碘循环工艺不仅能吸收
 降低环境污染,同时又能制得氢气,具体流程如下:
降低环境污染,同时又能制得氢气,具体流程如下: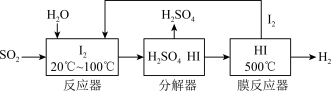
①用离子方程式表示反应器中发生的反应
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出
 的目的是
的目的是(4)下图是用
 脱除烟气中NO的原理。
脱除烟气中NO的原理。
①该脱硝原理中,NO最终转化为
 填化学式
填化学式 和H2O。
和H2O。②当消耗
 和
和 时,除去的NO在标准状况下的体积为
时,除去的NO在标准状况下的体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】用Cu还原密度为1.42g·cm-3,溶质质量分数为68%的HNO3溶液。反应的化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(1)该反应的离子方程式为:_______ ,该硝酸的物质的量浓度为_______ mol/L(保留一位小数)。
(2)用双线桥法表示出该反应的电子转移方向和数目:_______ 。
(3)12.8gCu与足量该浓硝酸反应能使_______ molHNO3被还原;其中,还原过程为:_______ →_______ 。
(4)浓硝酸在反应中显示出来的性质是_______ (填字母)
a.还原性 b.酸性 c.氧化性 d. 挥发性
(1)该反应的离子方程式为:
(2)用双线桥法表示出该反应的电子转移方向和数目:
(3)12.8gCu与足量该浓硝酸反应能使
(4)浓硝酸在反应中显示出来的性质是
a.还原性 b.酸性 c.氧化性 d. 挥发性
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】在抗击新冠肺炎疫情的战役中,病毒在不断发生变异,现有疫苗对变异病毒的有效性有待进一步的验证,因此民众的防疫意识不能松懈。
(1)口罩作为基础防疫物资,可以有效防止飞沫的传播。最新的研究表明新冠病毒可能通过气溶胶传播,气溶胶属于_______ (填“胶体”或“溶液”);常利用_______ 区分溶液和胶体。
(2)为有效防止新冠病毒的传播,除了戴口罩,还需加强对隔离场所的消毒。常用的消毒剂有双氧水、医用酒精以及含氯消毒剂,其中含氯消毒剂的家族最庞大、应用最广泛。实验室制 有三种常用方法:
有三种常用方法:
a.
b.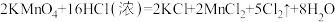
c. (未配平)
(未配平)
①反应c未配平,请写出配平后的化学方程式:_______ 。
②写出反应b对应的离子方程式_______ 。[已知:HCl(浓)可拆分为 和
和 ]
]
③当三个反应中参与反应的HCl的质量相同时,得到 的质量最多的是反应
的质量最多的是反应_______ (填“a”、“b”、“c”,下同);当得到等质量的 时,消耗HCl的质量最多的是反应
时,消耗HCl的质量最多的是反应_______ 。
④ 与浓盐酸反应制
与浓盐酸反应制 需要加热,而
需要加热,而 与浓盐酸反应制
与浓盐酸反应制 通常不需要加热。从氧化能力的角度分析,原因可能为
通常不需要加热。从氧化能力的角度分析,原因可能为_______ 。
(1)口罩作为基础防疫物资,可以有效防止飞沫的传播。最新的研究表明新冠病毒可能通过气溶胶传播,气溶胶属于
(2)为有效防止新冠病毒的传播,除了戴口罩,还需加强对隔离场所的消毒。常用的消毒剂有双氧水、医用酒精以及含氯消毒剂,其中含氯消毒剂的家族最庞大、应用最广泛。实验室制
 有三种常用方法:
有三种常用方法:a.

b.
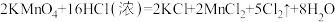
c.
 (未配平)
(未配平)①反应c未配平,请写出配平后的化学方程式:
②写出反应b对应的离子方程式
 和
和 ]
]③当三个反应中参与反应的HCl的质量相同时,得到
 的质量最多的是反应
的质量最多的是反应 时,消耗HCl的质量最多的是反应
时,消耗HCl的质量最多的是反应④
 与浓盐酸反应制
与浓盐酸反应制 需要加热,而
需要加热,而 与浓盐酸反应制
与浓盐酸反应制 通常不需要加热。从氧化能力的角度分析,原因可能为
通常不需要加热。从氧化能力的角度分析,原因可能为
您最近一年使用:0次
【推荐3】过氧化氢H2O2(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是______ (填字母)。
(2)H2O2既体现氧化性又体现还原性的反应是_______ (填字母)。
(3)在稀硫酸中,KMnO4和H2O2能构成原电池。其中负极反应为:H2O2-2e-=2H++O2↑,正极反应: +5e-+8H+=Mn2++4H2O,写出该氧化还原反应的离子方程式:
+5e-+8H+=Mn2++4H2O,写出该氧化还原反应的离子方程式:___________ 。
(4)在K2Cr2O7+14HCl=2KCl+3Cl2↑+7H2O+2CrCl3的反应中,有0.3mol电子转移时生成Cl2的体积为______ (标准状况),被氧化的HCl的物质的量为___________ 。
(5)除去镁粉中混入的铝粉杂质用____ 溶解、___ 方法分离,化学反应方程式为___ 。
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是
(2)H2O2既体现氧化性又体现还原性的反应是
(3)在稀硫酸中,KMnO4和H2O2能构成原电池。其中负极反应为:H2O2-2e-=2H++O2↑,正极反应:
 +5e-+8H+=Mn2++4H2O,写出该氧化还原反应的离子方程式:
+5e-+8H+=Mn2++4H2O,写出该氧化还原反应的离子方程式:(4)在K2Cr2O7+14HCl=2KCl+3Cl2↑+7H2O+2CrCl3的反应中,有0.3mol电子转移时生成Cl2的体积为
(5)除去镁粉中混入的铝粉杂质用
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。

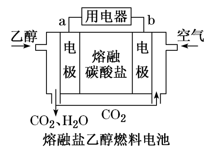
(1)三种乙醇燃料电池中正极反应物均为_____ 。
(2)碱性乙醇燃料电池中,若使用空气代替氧气,电池工作过程中电解质溶液的碱性会不断降低,其原因是____ 。
(3)酸性乙醇燃料电池中,电极b上发生的电极反应式为____ 。
(4)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,电子向电极____ (填“a”或“b”)移动,电极a上发生的电极反应式为____ 。
(5)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,“水”电池在放电时,负极的电极反应为_____ 。每有1mol电子转移,生成____ gNa2Mn5O10。


(1)三种乙醇燃料电池中正极反应物均为
(2)碱性乙醇燃料电池中,若使用空气代替氧气,电池工作过程中电解质溶液的碱性会不断降低,其原因是
(3)酸性乙醇燃料电池中,电极b上发生的电极反应式为
(4)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,电子向电极
(5)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,“水”电池在放电时,负极的电极反应为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】(1)现有KOH溶液及反应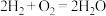 ,要构成燃料电池,则负极通入的应是
,要构成燃料电池,则负极通入的应是________ ,正极通入的应是________ ,电极反应式分别为________ 、________ 。
(2)若把KOH溶液改为稀硫酸作电解质溶液,则负极的电极反应式为________ ,正极的电极反应式为________ 。
(3)上述(1)和(2)的电解质溶液不同,反应进行一段时间后,(1)中溶液pH变________ (填“大”或“小”下同),(2)中溶液pH变________ 。
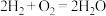 ,要构成燃料电池,则负极通入的应是
,要构成燃料电池,则负极通入的应是(2)若把KOH溶液改为稀硫酸作电解质溶液,则负极的电极反应式为
(3)上述(1)和(2)的电解质溶液不同,反应进行一段时间后,(1)中溶液pH变
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】镍镉电池是应用广泛的二次电池,其总反应为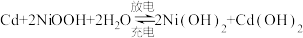 ,制造密封式镍镉电池的部分工艺如下:
,制造密封式镍镉电池的部分工艺如下:
I. 的制备
的制备
以硫酸镍( )为原料制备
)为原料制备 的主要过程如下图所示。制备过程中,降低
的主要过程如下图所示。制备过程中,降低 沉淀速率,可以避免沉淀团聚,提升电池性能。
沉淀速率,可以避免沉淀团聚,提升电池性能。

已知: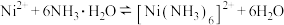
(1)制备过程中,需先加氨水,再加过量NaOH,请分析:
①先加氨水的目的是___ ,用化学平衡移动原理分析加入NaOH需过量的原因___ 。
II.镍镉电池的组装
②主要步骤:①将 (内含增强导电性的石墨粉)和
(内含增强导电性的石墨粉)和 (内含防结块的氧化铁粉)固定,中间用隔膜隔成阴极室和阳极室(如下图所示);②将多组上述结构串联;③向电池中注入KOH溶液;④密封。
(内含防结块的氧化铁粉)固定,中间用隔膜隔成阴极室和阳极室(如下图所示);②将多组上述结构串联;③向电池中注入KOH溶液;④密封。
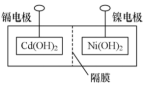
(2)下列对镍镉电池组装和使用的分析正确的是_______ (填字母)。
A.密封镍镉电池可以避免KOH变质
B.镍电极为电池的负极,镉电极为电池的正极
C.电池组装后,应先充电,再使用
III.池充电时,若 和
和 耗尽后继续充电,会造成安全隐患,称为过度充电。制造电池时,在镉电极加入过量的
耗尽后继续充电,会造成安全隐患,称为过度充电。制造电池时,在镉电极加入过量的 可对电池进行过度充电保护,该方法称为镉氧循环法。
可对电池进行过度充电保护,该方法称为镉氧循环法。
(3)若 耗尽后继续充电,镉电极上生成的物质的化学式为
耗尽后继续充电,镉电极上生成的物质的化学式为___ 。
(4)已知:①隔膜可以透过阴离子和分子;②O2可以与Cd发生反应生成 。请结合两个电极上的电极反应式说明用镉氧循环法实现过度充电保护的原理
。请结合两个电极上的电极反应式说明用镉氧循环法实现过度充电保护的原理___ 。
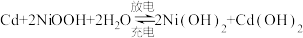 ,制造密封式镍镉电池的部分工艺如下:
,制造密封式镍镉电池的部分工艺如下:I.
 的制备
的制备以硫酸镍(
 )为原料制备
)为原料制备 的主要过程如下图所示。制备过程中,降低
的主要过程如下图所示。制备过程中,降低 沉淀速率,可以避免沉淀团聚,提升电池性能。
沉淀速率,可以避免沉淀团聚,提升电池性能。
已知:
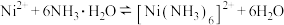
(1)制备过程中,需先加氨水,再加过量NaOH,请分析:
①先加氨水的目的是
II.镍镉电池的组装
②主要步骤:①将
 (内含增强导电性的石墨粉)和
(内含增强导电性的石墨粉)和 (内含防结块的氧化铁粉)固定,中间用隔膜隔成阴极室和阳极室(如下图所示);②将多组上述结构串联;③向电池中注入KOH溶液;④密封。
(内含防结块的氧化铁粉)固定,中间用隔膜隔成阴极室和阳极室(如下图所示);②将多组上述结构串联;③向电池中注入KOH溶液;④密封。
(2)下列对镍镉电池组装和使用的分析正确的是
A.密封镍镉电池可以避免KOH变质
B.镍电极为电池的负极,镉电极为电池的正极
C.电池组装后,应先充电,再使用
III.池充电时,若
 和
和 耗尽后继续充电,会造成安全隐患,称为过度充电。制造电池时,在镉电极加入过量的
耗尽后继续充电,会造成安全隐患,称为过度充电。制造电池时,在镉电极加入过量的 可对电池进行过度充电保护,该方法称为镉氧循环法。
可对电池进行过度充电保护,该方法称为镉氧循环法。(3)若
 耗尽后继续充电,镉电极上生成的物质的化学式为
耗尽后继续充电,镉电极上生成的物质的化学式为(4)已知:①隔膜可以透过阴离子和分子;②O2可以与Cd发生反应生成
 。请结合两个电极上的电极反应式说明用镉氧循环法实现过度充电保护的原理
。请结合两个电极上的电极反应式说明用镉氧循环法实现过度充电保护的原理
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】如下图装置中,b电极用金属 M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。试回答:
(1)a为__________ 极,c极的电极反应式为_________________ 。
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是:__________ ,电解进行一段时间后,罩在c极上的试管中也收集到了气体,此时c极上的电极反应为_________________ 。
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上放出了_____ moL气体,若b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为_____________ 。
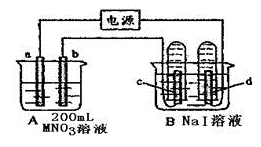
(1)a为
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是:
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上放出了
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液: 溶液、
溶液、 溶液、稀硫酸。按要求回答下列问题:
溶液、稀硫酸。按要求回答下列问题:
(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用。请说明原因:________________ 。
(2)若电极材料选铜和石墨,电解质溶液选 溶液,外加导线,能否构成原电池?
溶液,外加导线,能否构成原电池?______ 。若能,请写出电极反应式,负极:__________________ ,正极:_________________ (若不能,后两空不填)。
(3)设计一种以铁和稀硫酸反应为原理的原电池,在下面的方框中画出装置图__________ (需标明电极材料及电池的正负极)。

 溶液、
溶液、 溶液、稀硫酸。按要求回答下列问题:
溶液、稀硫酸。按要求回答下列问题:(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用。请说明原因:
(2)若电极材料选铜和石墨,电解质溶液选
 溶液,外加导线,能否构成原电池?
溶液,外加导线,能否构成原电池?(3)设计一种以铁和稀硫酸反应为原理的原电池,在下面的方框中画出装置图

您最近一年使用:0次

 Na2Sx,正极的电极反应式为
Na2Sx,正极的电极反应式为


