1 . (1)已知拆开1molH-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mol NH3时反应放出___________ kJ 的热量。
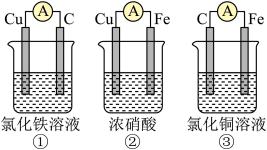
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的的是________ (填序号)。
(3)直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。
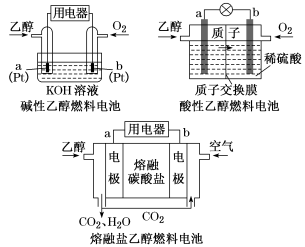
①三种乙醇燃料电池中正极反应物均为______________________ ;
②碱性乙醇燃料电池中,电极a上发生的电极反应式为_______________________________ ;
③熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,电极b上发生的电极反应式为______________________________ 。
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的的是

(3)直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。

①三种乙醇燃料电池中正极反应物均为
②碱性乙醇燃料电池中,电极a上发生的电极反应式为
③熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,电极b上发生的电极反应式为
您最近一年使用:0次
2018-08-19更新
|
396次组卷
|
4卷引用:湖南省醴陵市第一中学2017-2018学年高一下学期期末考试化学试题
湖南省醴陵市第一中学2017-2018学年高一下学期期末考试化学试题【校级联考】湖北省孝感市六校2018-2019学年高二上学期12月月考化学试题(已下线)2019年4月10日《每日一题》 必修2 新型原电池分析河北省唐山市海港高级中学2019-2020学年高一下学期第五次校考化学试题
2 . 电化学手段对于研究物质性质以及工业生产中都有重要价值。
I. 某实验小组利用原电池装置对 FeCl3与Na2SO3的反应进行探究。
(1)取少量 FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生蓝色沉淀,证明 FeCl3转化成_____ 。
(2)检验另一电极产物的操作及现象是_____ 。
(3)负极的电极反应式为_____ 。
II. 工业上用 Na2SO4溶液吸收工业烟气中的低浓度 SO2形成吸收液后,再采用阳离子膜电解法, 控制电压,电解吸收液可制成产品 S 和 O2。工作原理示意图如下图

阴极区和阳极区的pH 随时间的变化关系如下图:

(4)阳极反应的电极反应物是____ 。
(5)阳极区 pH 降低的原因是____ 。(写出一条即可)
(6) 结合电极反应式,说明阴极区 pH 升高的原因_____ 。(写出一条即可)
I. 某实验小组利用原电池装置对 FeCl3与Na2SO3的反应进行探究。
| 装置 | 实验现象 |
 1 mol/L FeCl3溶液(pH≈1) 1mol/LNa2SO3溶液(pH≈9) | 灵敏电流计指针发生偏转 |
(1)取少量 FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生蓝色沉淀,证明 FeCl3转化成
(2)检验另一电极产物的操作及现象是
(3)负极的电极反应式为
II. 工业上用 Na2SO4溶液吸收工业烟气中的低浓度 SO2形成吸收液后,再采用阳离子膜电解法, 控制电压,电解吸收液可制成产品 S 和 O2。工作原理示意图如下图

阴极区和阳极区的pH 随时间的变化关系如下图:

(4)阳极反应的电极反应物是
(5)阳极区 pH 降低的原因是
(6) 结合电极反应式,说明阴极区 pH 升高的原因
您最近一年使用:0次
解题方法
3 . 由A、B、C、D四种金属按下表中装置进行实验。
根据实验现象回答下列问题(用符号A、B、C、D回答下列问题)
(1)装置甲中负极 为___ 。装置丙中负极 为__ 。
(2)装置乙中正极 的电极反应式是___ 。
(3)四种金属活泼性由强到弱 的顺序是___ 。
| 装置 |  甲 甲 |  乙 乙 |  丙 丙 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题(用符号A、B、C、D回答下列问题)
(1)装置甲中
(2)装置乙中
(3)四种金属活泼性
您最近一年使用:0次
名校
解题方法
4 . 回答下列问题:
(1)电解硫酸亚铁和硫酸铝溶液得到液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n]。装置如图1所示(阴离子交换膜只允许阴离子通过,电极为惰性电极):
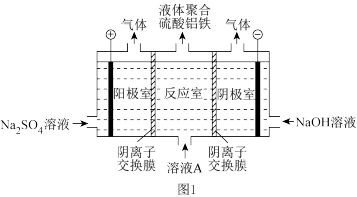
①电解过程阳极室溶液 pH 的变化是___________ (填“增大”、“减小”或“不变”)。
②简述在反应室中生成液体聚合硫酸铝铁的原理___________ 。
(2)如图2是一种用电解原理来制备 H2O2,并用产生的 H2O2处理废氨水的装置。

①Ir-Ru 惰性电极吸附 O2生成 H2O2,其电极反应式为___________ 。。
②理论上电路中每转移3 mol e-,最多可以处理废氨水中溶质(以NH3计)的质量是___________ g。
(3)为探究金属的腐蚀情况,某同学取一张用饱和 NaCl 溶液浸湿的石蕊试纸,平铺在一块金属板上,按如图3所示的方法连接电路。
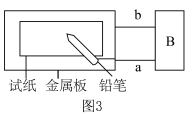
①若试纸为红色石蕊试纸,金属板为一锌片,B 处为一灵敏电流计,接通电路,将铅笔芯(主要成分为石墨)放置在试纸上一段时间,发现电流计指针发生偏转,则铅笔芯与试纸接触处颜色___________ 。
②若金属板为一铂片,B 处为一直流电源,接通电源后,若试纸为蓝色石蕊试纸,将铅笔芯放置在试纸上一段时间后,若接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色,则铅笔芯与试纸接触处的电极反应式为___________ 。
(1)电解硫酸亚铁和硫酸铝溶液得到液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n]。装置如图1所示(阴离子交换膜只允许阴离子通过,电极为惰性电极):

①电解过程阳极室溶液 pH 的变化是
②简述在反应室中生成液体聚合硫酸铝铁的原理
(2)如图2是一种用电解原理来制备 H2O2,并用产生的 H2O2处理废氨水的装置。

①Ir-Ru 惰性电极吸附 O2生成 H2O2,其电极反应式为
②理论上电路中每转移3 mol e-,最多可以处理废氨水中溶质(以NH3计)的质量是
(3)为探究金属的腐蚀情况,某同学取一张用饱和 NaCl 溶液浸湿的石蕊试纸,平铺在一块金属板上,按如图3所示的方法连接电路。

①若试纸为红色石蕊试纸,金属板为一锌片,B 处为一灵敏电流计,接通电路,将铅笔芯(主要成分为石墨)放置在试纸上一段时间,发现电流计指针发生偏转,则铅笔芯与试纸接触处颜色
②若金属板为一铂片,B 处为一直流电源,接通电源后,若试纸为蓝色石蕊试纸,将铅笔芯放置在试纸上一段时间后,若接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色,则铅笔芯与试纸接触处的电极反应式为
您最近一年使用:0次
2023-09-19更新
|
71次组卷
|
2卷引用:河北省唐县第一中学2023-2024学年高二上学期9月月考化学试题
名校
5 . 填空。
(1)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过人工光合作用,以 和
和 为原料制备
为原料制备 和
和 的原理示意图。电极b作
的原理示意图。电极b作_______ 极,表面发生的电极反应为_______ 。

(2)浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如下图所示,该电池从浓缩海水中提取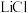 的同时又获得了电能。
的同时又获得了电能。
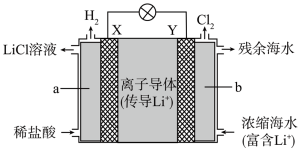
①X为_______ 极,Y极反应式为_______ 。
②Y极生成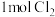 时,
时,_______ 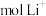 移向
移向_______ (填“X”或“Y”)极。
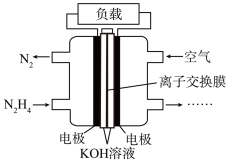
(3)一种以肼(N2H4)为液体燃料的电池装置如下图所示。该电池用空气中的氧气作氧化剂, 作电解质。负极反应式为
作电解质。负极反应式为_______ ;正极反应式为_______ 。
(1)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过人工光合作用,以
 和
和 为原料制备
为原料制备 和
和 的原理示意图。电极b作
的原理示意图。电极b作
(2)浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如下图所示,该电池从浓缩海水中提取
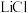 的同时又获得了电能。
的同时又获得了电能。
①X为
②Y极生成
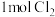 时,
时,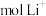 移向
移向(3)一种以肼(N2H4)为液体燃料的电池装置如下图所示。该电池用空气中的氧气作氧化剂,
 作电解质。负极反应式为
作电解质。负极反应式为
您最近一年使用:0次
解题方法
6 . 如图所示,是原电池的装置图。请回答:

(1)若溶液C 为稀H2SO4溶液,电流表指针发生偏转,B 电极材料为Fe 且作负极,则 A 电极上发生的电极反应为___________ 。
(2)若需将反应 Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则 A 极(负极)材料为___________ , B 极电极反应式为___________ 。
(3)若 C 为 CuCl2溶液,Zn 是___________ 极(填正极或负极),Cu 极发生___________ 反应(填氧化或还原),Cu 极电极反应为___________ 。
(4)CO 与 H2反应还可制备 CH3OH,CH3OH 可作为燃料使用,用 CH3OH 和 O2组合形成的质子交换膜燃料电池的结构示意图如下:

电池总反应为 2CH3OH+3O2=2CO2+4H2O,则电极 d 反应式为___________ ,若线路中转移 2 mol 电子,则上述 CH3OH 燃料电池,消耗的 O2 在标准状况下的体积为___________ L。

(1)若溶液C 为稀H2SO4溶液,电流表指针发生偏转,B 电极材料为Fe 且作负极,则 A 电极上发生的电极反应为
(2)若需将反应 Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则 A 极(负极)材料为
(3)若 C 为 CuCl2溶液,Zn 是
(4)CO 与 H2反应还可制备 CH3OH,CH3OH 可作为燃料使用,用 CH3OH 和 O2组合形成的质子交换膜燃料电池的结构示意图如下:

电池总反应为 2CH3OH+3O2=2CO2+4H2O,则电极 d 反应式为
您最近一年使用:0次
名校
解题方法
7 . 如图所示是原电池的装置图。请回答:

(1)若C为稀H2SO4,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为___ ;反应进行一段时间后溶液酸性将__ (填“增强”“减弱”或“基本不变”)。
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A(正极)极材料为___ ,B(负极)极材料为__ ,溶液C为___ 。
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:
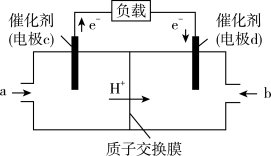
电池总反应为2CH3OH+3O2=2CO2+4H2O,则d电极是__ (填“正极”或“负极”),c电极的反应方程式为__ 。若线路中转移1mol电子,则上述CH3OH燃料电池消耗的O2在标准状况下的体积为__ L。

(1)若C为稀H2SO4,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A(正极)极材料为
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:

电池总反应为2CH3OH+3O2=2CO2+4H2O,则d电极是
您最近一年使用:0次
2020-06-23更新
|
555次组卷
|
3卷引用:湖北省黄冈市黄州区第一中学2019-2020学年高一下学期6月月考化学试题
8 . 世界能源消费的90%以上依靠化学技术。
(1)工业制氢的一个重要反应是利用CO还原H2O(g)。已知:
C(石墨,s)+O2(g)===CO2(g) ΔH=-394 kJ·mol-1
2C(石墨,s)+O2(g)===2CO(g) ΔH=-222 kJ·mol-1
H2(g)+ O2(g)===H2O(g) ΔH=-242 kJ·mol-1
O2(g)===H2O(g) ΔH=-242 kJ·mol-1
则CO还原H2O(g)的热化学方程式为__________________ 。
(2)氢能被视为最具发展潜力的绿色能源,写出碱式氢氧燃料电池工作时的负极电极反应式:______________________________________________________________ 。
(3)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如下图,写出该电池充电时的阳极电极反应式:___________ 。

(4)LiOH是制备锂离子电池正极材料的重要原料,其电解法制备装置如下图。气体a通入淀粉KI溶液中,发现溶液变蓝,持续一段时间后,蓝色逐渐褪去。则M极为电源的_______ (填“正”或“负”)极,B极区电解液为_______ (填化学式)溶液,该离子交换膜是_______ (填“阳”或“阴”)离子交换膜,解释蓝色褪去的原因_________________________________ 。

(1)工业制氢的一个重要反应是利用CO还原H2O(g)。已知:
C(石墨,s)+O2(g)===CO2(g) ΔH=-394 kJ·mol-1
2C(石墨,s)+O2(g)===2CO(g) ΔH=-222 kJ·mol-1
H2(g)+
 O2(g)===H2O(g) ΔH=-242 kJ·mol-1
O2(g)===H2O(g) ΔH=-242 kJ·mol-1则CO还原H2O(g)的热化学方程式为
(2)氢能被视为最具发展潜力的绿色能源,写出碱式氢氧燃料电池工作时的负极电极反应式:
(3)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如下图,写出该电池充电时的阳极电极反应式:

(4)LiOH是制备锂离子电池正极材料的重要原料,其电解法制备装置如下图。气体a通入淀粉KI溶液中,发现溶液变蓝,持续一段时间后,蓝色逐渐褪去。则M极为电源的

您最近一年使用:0次
2017-06-26更新
|
1115次组卷
|
3卷引用:苏教版2017届高三单元精练检测六化学试题



