名校
解题方法
1 . 化学电源在生产生活中有着广泛的应用,请回答下列问颕:
(1)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是___________(填字母,下同)。
(2)电子表和电子计算器中所用的是钮扣式的微型银锌电池,其电极分别为 和Zn,电解液为KOH溶液。工作时电池总反应为:
和Zn,电解液为KOH溶液。工作时电池总反应为: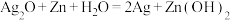 。
。
①工作时电流从___________ 极流向___________ 极(两空均选填“ ”或“Zn”);
”或“Zn”);
②负极的电极反应式为:___________ ;
③工作时电池正极区的pH___________ (选填“增大”“减小”或“不变”);
④外电路中每通过0.2mol电子,锌的质量理论上减少___________ g。
(3)理论上,任何自发的氧化还原反应都可以设计成原电池。请利用反应“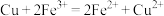 ”设计一种化学电池(正极材料用石墨棒),回答下列问题:
”设计一种化学电池(正极材料用石墨棒),回答下列问题:
①该电池的负极材料是___________ (填化学式),电解质溶液是___________ (填化学式)溶液。
②正极上发生的电极反应为___________ 。
③若导线上转移的电子为1mol,则消耗的金属铜的质量为___________ 。
(1)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是___________(填字母,下同)。
A.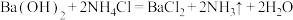 |
B. |
C. |
D. |
 和Zn,电解液为KOH溶液。工作时电池总反应为:
和Zn,电解液为KOH溶液。工作时电池总反应为: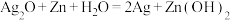 。
。①工作时电流从
 ”或“Zn”);
”或“Zn”);②负极的电极反应式为:
③工作时电池正极区的pH
④外电路中每通过0.2mol电子,锌的质量理论上减少
(3)理论上,任何自发的氧化还原反应都可以设计成原电池。请利用反应“
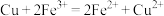 ”设计一种化学电池(正极材料用石墨棒),回答下列问题:
”设计一种化学电池(正极材料用石墨棒),回答下列问题:①该电池的负极材料是
②正极上发生的电极反应为
③若导线上转移的电子为1mol,则消耗的金属铜的质量为
您最近半年使用:0次
名校
2 . 自重轻、体积小、容量大、使用安全、环保是新型电池的典型特点,回答下列问题:
I.“阿波罗”飞船中使用的氢氧燃料电池部分结构如图所示。
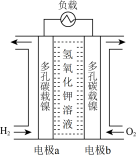
(1)电池的正极为电极___________ (填“a”或“b”),其表面上发生的电极反应为___________ (填电极反应式)。
(2)“神舟”飞船是中国自行研制的,具有自主知识产权的载人飞船,其返回舱使用的是银锌蓄电池组。银锌电池结构如图所示,放电时总反应为 。电池放电时负极质量
。电池放电时负极质量___________ (填“增大”、“减小”或“不变”),电池放电时电解质溶液的
___________ (填“增大”、“减小”或“不变”)。

Ⅱ.非水系锂氧(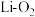 )电池因其高能量密度而成为一种有前景的先进电池技术,其放电电池示意图以及正极示意图分别为图1和图2,隔膜a只允许
)电池因其高能量密度而成为一种有前景的先进电池技术,其放电电池示意图以及正极示意图分别为图1和图2,隔膜a只允许 通过。
通过。

(3)放电时,电池的总反应为___________ ;电解液a不选用 水溶液的原因可能是
水溶液的原因可能是___________ 。
(4)不考虑其他副反应,若放电前两电极质量完全相同,放电时,电路中转移1mole-,正、负电极的质量之差为___________ g(假设生成的不溶物全覆盖在电极表面,生成的可溶物全部扩散至电解液中,参与电极反应的物质均过量)。(相对原子质量:Li~7 O~16 )
I.“阿波罗”飞船中使用的氢氧燃料电池部分结构如图所示。

(1)电池的正极为电极
(2)“神舟”飞船是中国自行研制的,具有自主知识产权的载人飞船,其返回舱使用的是银锌蓄电池组。银锌电池结构如图所示,放电时总反应为
 。电池放电时负极质量
。电池放电时负极质量

Ⅱ.非水系锂氧(
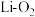 )电池因其高能量密度而成为一种有前景的先进电池技术,其放电电池示意图以及正极示意图分别为图1和图2,隔膜a只允许
)电池因其高能量密度而成为一种有前景的先进电池技术,其放电电池示意图以及正极示意图分别为图1和图2,隔膜a只允许 通过。
通过。
(3)放电时,电池的总反应为
 水溶液的原因可能是
水溶液的原因可能是(4)不考虑其他副反应,若放电前两电极质量完全相同,放电时,电路中转移1mole-,正、负电极的质量之差为
您最近半年使用:0次
名校
3 . 詹姆斯·韦伯太空望远镜捕捉到第一批火星图像。火星本身不发光, 其红色的外观源于表层土壤中丰富的铁元素及反射的太阳光。
(1)火星反射的光线通过气态原子后经过棱镜色散分光后得到了一系列不连续的暗线,该光谱属于___________ (填“吸收”或“发射”)光谱。
(2)已知铁是第 26 号元素,铁在元素周期表中的位置是___________ ,基态铁原子价电子轨道表示式为___________ ,其核外有___________ 种不同运动状态的电子。
(3)某实验小组为探究 Fe 与 Fe3+能否发生氧化还原反应,试设计对应的双液原电池___________ 。
(1)火星反射的光线通过气态原子后经过棱镜色散分光后得到了一系列不连续的暗线,该光谱属于
(2)已知铁是第 26 号元素,铁在元素周期表中的位置是
(3)某实验小组为探究 Fe 与 Fe3+能否发生氧化还原反应,试设计对应的双液原电池
您最近半年使用:0次
解题方法
4 . 原电池原理广泛应用于科技、生产和生活中。
(1)一种处理垃圾渗透液并用其发电的装置工作示意图如下。

①在空气中,微生物将垃圾渗透液硝化,该反应的离子方程式为___________ 。
②Y电极的电极反应式为___________ 。
③盐桥中 移向
移向___________ (填“X或Y”)极;当转移0.15mol电子时,生成标准状况下 的体积为
的体积为___________ L。
(2)用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。
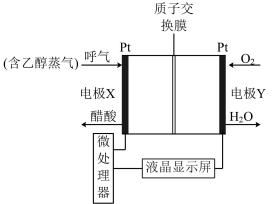
①电极X是该电池的___________ (填“正”或“负”)极,电池总反应式为___________ 。
②电池工作时,质子通过交换膜___________ (填“从左向右”或“从右向左”)迁移。
(1)一种处理垃圾渗透液并用其发电的装置工作示意图如下。

①在空气中,微生物将垃圾渗透液硝化,该反应的离子方程式为
②Y电极的电极反应式为
③盐桥中
 移向
移向 的体积为
的体积为(2)用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。

①电极X是该电池的
②电池工作时,质子通过交换膜
您最近半年使用:0次
名校
解题方法
5 . 原电池原理在工农业生产、日常生活、科学研究中具有广泛的应用。
(1)甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医约和橡胶等工业。某科研团队利用光催化制甲酸如图所示:已知: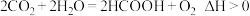 。
。
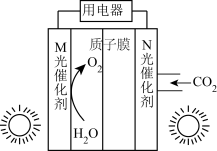
①两个电极中,电极电势较高的电极是___________ (填“M”或“N”)。
②正极电极反应式为___________ 。
③若制得 ,不考虑气体溶解,整套装置质量增加
,不考虑气体溶解,整套装置质量增加___________ g。
(2)热激活电池主要用于导弹、火箭以及应急电子仪器供电,是一种电解质受热熔融即可开始工作的电池。一种热激活电池的结构如图所示。
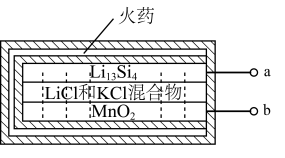
已知放电后的两极产物分别为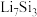 和
和 ,则a极的电极方程式为
,则a极的电极方程式为___________ 。
(3)我国《政府工作报告》写入“推动充电、加氢等设施的建设”。如下图是一种新型“全氢电池”,能量效率可达 。
。
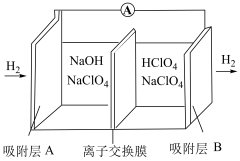
①该电池的总反应方程式为___________ 。
②该电池工作一段时间后,离子交换膜右侧质量增大,则透过离子交换膜迁移的离子是___________ 。
③该电池以恒定电流2A输出,当电池左侧消耗标况下 时,可持续对外供电
时,可持续对外供电___________ 小时(已知法拉第常数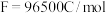 ,计算结果保留到整数)。
,计算结果保留到整数)。
(1)甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医约和橡胶等工业。某科研团队利用光催化制甲酸如图所示:已知:
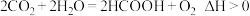 。
。
①两个电极中,电极电势较高的电极是
②正极电极反应式为
③若制得
 ,不考虑气体溶解,整套装置质量增加
,不考虑气体溶解,整套装置质量增加(2)热激活电池主要用于导弹、火箭以及应急电子仪器供电,是一种电解质受热熔融即可开始工作的电池。一种热激活电池的结构如图所示。

已知放电后的两极产物分别为
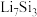 和
和 ,则a极的电极方程式为
,则a极的电极方程式为(3)我国《政府工作报告》写入“推动充电、加氢等设施的建设”。如下图是一种新型“全氢电池”,能量效率可达
 。
。
①该电池的总反应方程式为
②该电池工作一段时间后,离子交换膜右侧质量增大,则透过离子交换膜迁移的离子是
③该电池以恒定电流2A输出,当电池左侧消耗标况下
 时,可持续对外供电
时,可持续对外供电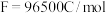 ,计算结果保留到整数)。
,计算结果保留到整数)。
您最近半年使用:0次
名校
解题方法
6 . 回答下列问题:
(1)电解硫酸亚铁和硫酸铝溶液得到液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n]。装置如图1所示(阴离子交换膜只允许阴离子通过,电极为惰性电极):
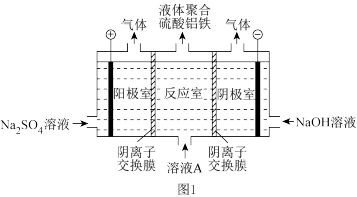
①电解过程阳极室溶液 pH 的变化是___________ (填“增大”、“减小”或“不变”)。
②简述在反应室中生成液体聚合硫酸铝铁的原理___________ 。
(2)如图2是一种用电解原理来制备 H2O2,并用产生的 H2O2处理废氨水的装置。

①Ir-Ru 惰性电极吸附 O2生成 H2O2,其电极反应式为___________ 。。
②理论上电路中每转移3 mol e-,最多可以处理废氨水中溶质(以NH3计)的质量是___________ g。
(3)为探究金属的腐蚀情况,某同学取一张用饱和 NaCl 溶液浸湿的石蕊试纸,平铺在一块金属板上,按如图3所示的方法连接电路。
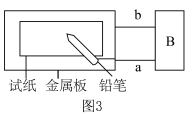
①若试纸为红色石蕊试纸,金属板为一锌片,B 处为一灵敏电流计,接通电路,将铅笔芯(主要成分为石墨)放置在试纸上一段时间,发现电流计指针发生偏转,则铅笔芯与试纸接触处颜色___________ 。
②若金属板为一铂片,B 处为一直流电源,接通电源后,若试纸为蓝色石蕊试纸,将铅笔芯放置在试纸上一段时间后,若接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色,则铅笔芯与试纸接触处的电极反应式为___________ 。
(1)电解硫酸亚铁和硫酸铝溶液得到液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n]。装置如图1所示(阴离子交换膜只允许阴离子通过,电极为惰性电极):

①电解过程阳极室溶液 pH 的变化是
②简述在反应室中生成液体聚合硫酸铝铁的原理
(2)如图2是一种用电解原理来制备 H2O2,并用产生的 H2O2处理废氨水的装置。

①Ir-Ru 惰性电极吸附 O2生成 H2O2,其电极反应式为
②理论上电路中每转移3 mol e-,最多可以处理废氨水中溶质(以NH3计)的质量是
(3)为探究金属的腐蚀情况,某同学取一张用饱和 NaCl 溶液浸湿的石蕊试纸,平铺在一块金属板上,按如图3所示的方法连接电路。

①若试纸为红色石蕊试纸,金属板为一锌片,B 处为一灵敏电流计,接通电路,将铅笔芯(主要成分为石墨)放置在试纸上一段时间,发现电流计指针发生偏转,则铅笔芯与试纸接触处颜色
②若金属板为一铂片,B 处为一直流电源,接通电源后,若试纸为蓝色石蕊试纸,将铅笔芯放置在试纸上一段时间后,若接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色,则铅笔芯与试纸接触处的电极反应式为
您最近半年使用:0次
2023-09-19更新
|
70次组卷
|
2卷引用:河北省唐县第一中学2023-2024学年高二上学期9月月考化学试题
2023高三·全国·专题练习
解题方法
7 . 电池是人类生产和生活中重要的能量来源。各式各样电池的发明是化学对人类的一项重大贡献。请根据下列几种电池的工作原理示意图,回答问题。

全钒液流电池是一种新型的绿色环保储能电池,工作原理如图所示,a、b均为惰性电极。放电时左槽溶液颜色由黄色变为蓝色,则H+向______ 槽移动(填“左”或“右”)。充电时,______ 极连接直流电源正极(填“a”或“b”),其电极反应式为______ 。

全钒液流电池是一种新型的绿色环保储能电池,工作原理如图所示,a、b均为惰性电极。放电时左槽溶液颜色由黄色变为蓝色,则H+向
您最近半年使用:0次
解题方法
8 . 含氮、磷、砷化合物的转化和处理是环境保护的重要课题。
(1)研究团队采用NaClO氧化法去除水中氨氮( 、
、 )。已知:HClO的氧化性比NaClO强;
)。已知:HClO的氧化性比NaClO强; 比
比 更容易被氧化。在相同时间内,反应温度对剩余氨氮浓度和氨氮去除率的影响如图所示。40~60℃时氨氮去除率持续下降,其原因为
更容易被氧化。在相同时间内,反应温度对剩余氨氮浓度和氨氮去除率的影响如图所示。40~60℃时氨氮去除率持续下降,其原因为___________ 。
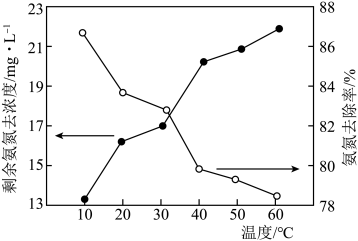
(2)十八面体结构的 晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。
晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。 沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能。
沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能。
①向银氨溶液中加入 溶液,离心分离、洗涤干燥后可得到
溶液,离心分离、洗涤干燥后可得到 高效光催化剂,写出反应的离子方程式为
高效光催化剂,写出反应的离子方程式为___________ 。
② 和
和 在溶液中反应也可制得
在溶液中反应也可制得 固体,但制得的
固体,但制得的 固体光催化性能极差。从速率角度解释其原因是
固体光催化性能极差。从速率角度解释其原因是___________ 。
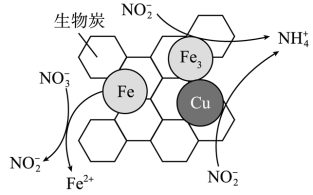
(3)将一定量纳米零价铁和少量铜粉附着在生物炭上,也可用于去除水体中 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 的效率更高,其主要原因是
的效率更高,其主要原因是___________ ; 转化为
转化为 的反应机理可描述为
的反应机理可描述为___________ 。
(1)研究团队采用NaClO氧化法去除水中氨氮(
 、
、 )。已知:HClO的氧化性比NaClO强;
)。已知:HClO的氧化性比NaClO强; 比
比 更容易被氧化。在相同时间内,反应温度对剩余氨氮浓度和氨氮去除率的影响如图所示。40~60℃时氨氮去除率持续下降,其原因为
更容易被氧化。在相同时间内,反应温度对剩余氨氮浓度和氨氮去除率的影响如图所示。40~60℃时氨氮去除率持续下降,其原因为
(2)十八面体结构的
 晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。
晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。 沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能。
沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能。①向银氨溶液中加入
 溶液,离心分离、洗涤干燥后可得到
溶液,离心分离、洗涤干燥后可得到 高效光催化剂,写出反应的离子方程式为
高效光催化剂,写出反应的离子方程式为②
 和
和 在溶液中反应也可制得
在溶液中反应也可制得 固体,但制得的
固体,但制得的 固体光催化性能极差。从速率角度解释其原因是
固体光催化性能极差。从速率角度解释其原因是(3)将一定量纳米零价铁和少量铜粉附着在生物炭上,也可用于去除水体中
 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 的效率更高,其主要原因是
的效率更高,其主要原因是 转化为
转化为 的反应机理可描述为
的反应机理可描述为
您最近半年使用:0次
名校
解题方法
9 . 氮的化合物是重要的化工原料,其转化一直是化学研究的热点。
(1)氨催化氧化法是制硝酸的重要步骤,探究氨催化氧化反应的装置如图所示:
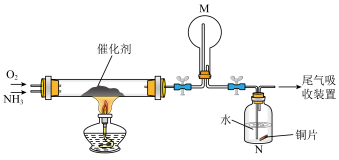
①氨催化氧化时会生成副产物N2O。生成含等物质的量氮元素的NO与N2O时,消耗的O2的物质的量之比为___________ 。
②一段时间后,观察到装置M中有白烟生成,该白烟成分是___________ (写化学式)。
(2)选择性催化还原法(SCR)工艺是以NH3 为还原剂,在催化剂作用下选择性地与NOx发生氧化还原反应生成无害化的N2和H2O。
已知:4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H1=-905.8 kJ/mol
N2(g)+ O2(g)=2NO(g) △H2 = +180 kJ/mol
则NH3与NO反应的热化学方程式为:___________ 。
(3)可用ClO2将氮氧化物转化成 。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为___________ 。
(4)纳米铁粉可去除水体中的 。
。
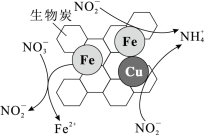
①将一定量纳米零价铁和少量铜粉附着在生物炭上,可用于去除水体中 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 效率更高,其主要原因是
效率更高,其主要原因是___________ 。
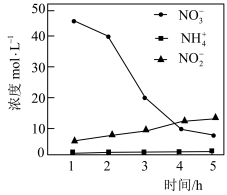
②控制其他条件不变,用纳米铁粉还原水体中的 ,测得溶液中含氮物质(
,测得溶液中含氮物质( 、
、 、
、 )浓度随时间变化如图所示。与初始溶液中
)浓度随时间变化如图所示。与初始溶液中 浓度相比,反应后溶液中所有含氮物质(
浓度相比,反应后溶液中所有含氮物质( 、
、 、
、 )总浓度减小,原因是
)总浓度减小,原因是___________ 。
(1)氨催化氧化法是制硝酸的重要步骤,探究氨催化氧化反应的装置如图所示:

①氨催化氧化时会生成副产物N2O。生成含等物质的量氮元素的NO与N2O时,消耗的O2的物质的量之比为
②一段时间后,观察到装置M中有白烟生成,该白烟成分是
(2)选择性催化还原法(SCR)工艺是以NH3 为还原剂,在催化剂作用下选择性地与NOx发生氧化还原反应生成无害化的N2和H2O。
已知:4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H1=-905.8 kJ/mol
N2(g)+ O2(g)=2NO(g) △H2 = +180 kJ/mol
则NH3与NO反应的热化学方程式为:
(3)可用ClO2将氮氧化物转化成
 。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为(4)纳米铁粉可去除水体中的
 。
。①将一定量纳米零价铁和少量铜粉附着在生物炭上,可用于去除水体中
 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 效率更高,其主要原因是
效率更高,其主要原因是
②控制其他条件不变,用纳米铁粉还原水体中的
 ,测得溶液中含氮物质(
,测得溶液中含氮物质( 、
、 、
、 )浓度随时间变化如图所示。与初始溶液中
)浓度随时间变化如图所示。与初始溶液中 浓度相比,反应后溶液中所有含氮物质(
浓度相比,反应后溶液中所有含氮物质( 、
、 、
、 )总浓度减小,原因是
)总浓度减小,原因是
您最近半年使用:0次
2023高三·全国·专题练习
10 . 完成下列小题
(1)绿色电源“直接二甲醚燃料电池”的工作原理示意图如图所示:

正极为___________ (填“A电极”或“B电极”),H+移动方向为由___________ 到___________ (填“A”或“B”),写出A电极的电极反应式:___________ 。
(2)SO2和NOx是主要大气污染物,利用下图装置可同时吸收SO2和NO。
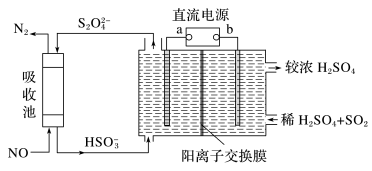
①a是直流电源的___________ 极。
②已知电解池的阴极室中溶液的pH在4~7之间,阴极的电极反应为___________ 。
③用离子方程式表示吸收NO的原理___________ 。
(3)结合下图所示的电解装置可去除废水中的氨氮(次氯酸氧化能力强)。
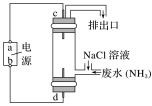
①a极为___________ 。
②d极反应式为___________ 。
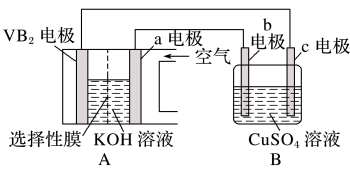
(4)VB2-空气电池是目前储电能力最高的电池。以VB2-空气电池为电源,用惰性电极电解硫酸铜溶液如图所示,该电池工作时的反应为4VB2+11O2=4B2O3+2V2O5,VB2极发生的电极反应为___________ 。
(1)绿色电源“直接二甲醚燃料电池”的工作原理示意图如图所示:

正极为
(2)SO2和NOx是主要大气污染物,利用下图装置可同时吸收SO2和NO。

①a是直流电源的
②已知电解池的阴极室中溶液的pH在4~7之间,阴极的电极反应为
③用离子方程式表示吸收NO的原理
(3)结合下图所示的电解装置可去除废水中的氨氮(次氯酸氧化能力强)。

①a极为
②d极反应式为
(4)VB2-空气电池是目前储电能力最高的电池。以VB2-空气电池为电源,用惰性电极电解硫酸铜溶液如图所示,该电池工作时的反应为4VB2+11O2=4B2O3+2V2O5,VB2极发生的电极反应为

您最近半年使用:0次



