名校
1 . 如下图所示,A、B两个装置中两个烧杯分别盛有足量的CuSO4溶液:
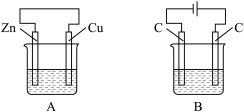
(1)A、B两个装置中属于原电池的是_____ (填标号,下同),属于电解池的是____ 。
(2)A池中Zn是___ 极,发生______ (填氧化或还原)反应,电极反应式为____________ ; Cu极电极反应式为_______ ;A中总反应的离子方程式为__________ 。
(3)B池中左边C是___ 极,发生______ (填氧化或还原)反应,电极反应式____________ ;右边C极电极反应式为_________ ;B中总反应的化学方程式为_______ 。

(1)A、B两个装置中属于原电池的是
(2)A池中Zn是
(3)B池中左边C是
您最近一年使用:0次
2020-04-30更新
|
636次组卷
|
3卷引用:河北省唐山市第一中学2019-2020学年高一下学期期中考试化学试题
解题方法
2 . 1887年,英国人赫勒森发明了最早的干电池,如今干电池已经发展成为一个庞大的家族,种类达100多种。应用广泛的是Zn—MnO2干电池,其电解质溶液是ZnCl2—NH4Cl混合溶液。电池工作一段时间后,电池内存在7种物质:NH3、Mn2O3、ZnCl2、MnO2、NH4Cl、Zn和H2O。请回答下列问题
(1)该电池的负极材料是__ ;电池工作时,电子流向__ (填“正极”或“负极”,下同);放电时NH4+向___ 移动。
(2)该氧化还原反应的化学方程式为__ ,发生还原反应的物质是__ ,被氧化的元素是__ 。若有17.4g氧化剂参与反应,则电子转移数目为__ NA(NA表示阿伏加 德罗常数的值)。
(3)普通锌锰电池的缺点是电量小、放电电流弱。为增大放电电流,可把负极锌片改为锌粉,其理由是___ 。
(4)若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是__ 。欲除去Cu2+,最好选用下列试剂中的__ (填序号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(1)该电池的负极材料是
(2)该氧化还原反应的化学方程式为
(3)普通锌锰电池的缺点是电量小、放电电流弱。为增大放电电流,可把负极锌片改为锌粉,其理由是
(4)若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是
a.NaOH b.Zn c.Fe d.NH3·H2O
您最近一年使用:0次
解题方法
3 . 锂空气电池比传统的锂离子电池拥有更强的蓄电能力,是传统锂离子电池容量的10倍,其工作原理示意图如下:
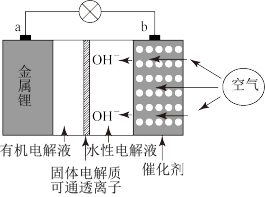
放电时,b电极为电源的________ 极,电极反应式为________

放电时,b电极为电源的
您最近一年使用:0次
2014·上海浦东新·二模
4 . (1)在含Mg2+、Al3+、H+、Cl-的混合溶液中滴加NaOH溶液,与OH-发生反应的顺序为:___ 、___ 、Mg2+和___ 。在NaOH滴加过量后的澄清溶液中,浓度最高的离子是___ 。
(2)加热条件下,一氧化碳与硫反应可生成硫氧化碳(COS)。
①写出S原子核外最外层电子排布式___ 。
②每摩尔COS气体中含电子___ NA(阿佛加得罗常数)个。
③写出COS的电子式。___ 。
(3)海水中含量较高的金属元素有Na、Mg、Ca等,地壳中含量最高的Al、Fe在海水中的含量却极低,以至食盐提纯过程一般无需考虑除Fe3+、Al3+或AlO2-。为什么海水中Al元素的含量极低?___ 。
(4)某些非金属单质可与水发生置换反应,如2F2+2H2O=4HF+O2。非金属单质与水发生置换反应的另一个熟知实例是(用热化学方程式表示,热值用Q表示,Q>0):___ 。
(5)一银制摆件因日久在表面生成硫化银而变黑。使银器复原的一种方法是利用原电池原理:在一铝锅中盛盐水,将该银器浸入,并与锅底接触,放置一段时间,黑色褪去。
①构成原电池负极的材料是___ 。
②操作后可闻盐水微有臭味,估计具有臭味的物质是___ 。
(2)加热条件下,一氧化碳与硫反应可生成硫氧化碳(COS)。
①写出S原子核外最外层电子排布式
②每摩尔COS气体中含电子
③写出COS的电子式。
(3)海水中含量较高的金属元素有Na、Mg、Ca等,地壳中含量最高的Al、Fe在海水中的含量却极低,以至食盐提纯过程一般无需考虑除Fe3+、Al3+或AlO2-。为什么海水中Al元素的含量极低?
(4)某些非金属单质可与水发生置换反应,如2F2+2H2O=4HF+O2。非金属单质与水发生置换反应的另一个熟知实例是(用热化学方程式表示,热值用Q表示,Q>0):
(5)一银制摆件因日久在表面生成硫化银而变黑。使银器复原的一种方法是利用原电池原理:在一铝锅中盛盐水,将该银器浸入,并与锅底接触,放置一段时间,黑色褪去。
①构成原电池负极的材料是
②操作后可闻盐水微有臭味,估计具有臭味的物质是
您最近一年使用:0次
解题方法
5 . 全钒液流电池是一种新型的绿色环保储能系统,工作原理如图:

(1)全钒液流电池放电时V2+发生氧化反应,该电池放电时总反应式是__________ 。
(2)当完成储能时,正极溶液的颜色是________
(3)质子交换膜的作用是____________

| 离子种类 | VO2+ | VO2+ | V3+ | V2+ |
| 颜色 | 黄色 | 蓝色 | 绿色 | 紫色 |
(1)全钒液流电池放电时V2+发生氧化反应,该电池放电时总反应式是
(2)当完成储能时,正极溶液的颜色是
(3)质子交换膜的作用是
您最近一年使用:0次
解题方法
6 . 如图所示:
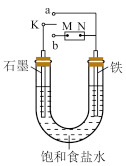
(1)若开始时开关K与a连接,则铁发生电化学腐蚀中的________ 腐蚀(填“吸氧”或“析氢”),正极发生的电极反应式为_______________ 。
(2)若开始时开关K与b连接,两极均有气体产生,则N端是电源的________ 极(填“正”或“负”),电解池总反应的离子方程式为_________ 。

(1)若开始时开关K与a连接,则铁发生电化学腐蚀中的
(2)若开始时开关K与b连接,两极均有气体产生,则N端是电源的
您最近一年使用:0次
2020·山东·模拟预测
7 . 2019年诺贝尔化学奖颁给在锂离子电池发展方面作出突出贡献的三位科学家,颁奖词中说:他们创造了一个可再充电的世界。下面是最近研发的Ca-LiFePO4可充电电池的工作示意图,锂离子导体膜只允许Li+通过,电池反应为:xCa2++2LiFePO4 xCa+2Li1-xFePO4+2xLi+。下列说法错误的是
xCa+2Li1-xFePO4+2xLi+。下列说法错误的是

 xCa+2Li1-xFePO4+2xLi+。下列说法错误的是
xCa+2Li1-xFePO4+2xLi+。下列说法错误的是
| A.LiPF6-LiAsF6为非水电解质,其与Li2SO4溶液的主要作用都是传递离子 |
| B.放电时,负极反应为:LiFePO4−xe−=Li1-xFePO4+xLi+ |
| C.充电时,Li1-xFePO4/LiFePO4电极发生Li+脱嵌,放电时发生Li+嵌入 |
| D.充电时,当转移0.2 mol电子时,左室中电解质的质量减轻4.0 g |
您最近一年使用:0次
名校
解题方法
8 . 铝–空气–海水电池
我国首创以铝–空气–海水电池作为能源的新型海水标志灯,以海水为电解质,靠空气中的氧气使铝不断被氧化而产生电流。只要把灯放入海水中数分钟,就会发出耀眼的白光。
(1)电源负极材料为___________ ;电源正极材料为:石墨、铂网等能导电的惰性材料。
(2)负极的电极反应式为:____________________ ;正极的电极反应式为:3O2+6H2O+12e-=12OH-
(3)总反应式为:4Al+3O2+6H2O=4Al(OH)3
(4)说明:铝板要及时更换,铂做成网状是为了____________ 。
(5)燃料电池正极反应式本质都是O2+4e—=2O2—,在不同电解质环境中,其正极反应式的书写形式有所不同。因此在书写正极反应式时,要特别注意所给电解质的状态和电解质溶液的酸碱性。
我国首创以铝–空气–海水电池作为能源的新型海水标志灯,以海水为电解质,靠空气中的氧气使铝不断被氧化而产生电流。只要把灯放入海水中数分钟,就会发出耀眼的白光。
(1)电源负极材料为
(2)负极的电极反应式为:
(3)总反应式为:4Al+3O2+6H2O=4Al(OH)3
(4)说明:铝板要及时更换,铂做成网状是为了
(5)燃料电池正极反应式本质都是O2+4e—=2O2—,在不同电解质环境中,其正极反应式的书写形式有所不同。因此在书写正极反应式时,要特别注意所给电解质的状态和电解质溶液的酸碱性。
您最近一年使用:0次
名校
解题方法
9 . Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOCl2=4LiCl+S+SO2。请回答下列问题:
(1)电池的负极材料为_____ ,发生的电极反应为______________ 。
(2)电池正极发生的电极反应为_______________ 。
(1)电池的负极材料为
(2)电池正极发生的电极反应为
您最近一年使用:0次
名校
10 . 2019年诺贝尔化学奖颁给了三位为锂离子电池发展做出巨大贡献的科学家,锂离子电池广泛应用于手机、笔记本电脑等。
(1)锂元素在元素周期表中的位置:_________________ 。
(2)氧化锂(Li2O)是制备锂离子电池的重要原料,氧化锂的电子式为_____________ 。
(3)近日华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出了石墨烯电池,电池反应式为LIxC6+Li1-x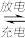 C6+LiCoO2,其工作原理如图。
C6+LiCoO2,其工作原理如图。

①石墨烯的优点是提高电池的能量密度,石墨烯为层状结构,层与层之间存在的作用力是_______ 。
②锂离子电池不能用水溶液做离子导体的原因是___________ (用离子方程式表示)。
③锂离子电池放电时正极的电极反应式为________________ 。
④请指出使用锂离子电池的注意问题____________________ 。(回答一条即可)
(1)锂元素在元素周期表中的位置:
(2)氧化锂(Li2O)是制备锂离子电池的重要原料,氧化锂的电子式为
(3)近日华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出了石墨烯电池,电池反应式为LIxC6+Li1-x
 C6+LiCoO2,其工作原理如图。
C6+LiCoO2,其工作原理如图。
①石墨烯的优点是提高电池的能量密度,石墨烯为层状结构,层与层之间存在的作用力是
②锂离子电池不能用水溶液做离子导体的原因是
③锂离子电池放电时正极的电极反应式为
④请指出使用锂离子电池的注意问题
您最近一年使用:0次



