解题方法
1 . 含氮、磷、砷化合物的转化和处理是环境保护的重要课题。
(1)研究团队采用NaClO氧化法去除水中氨氮( 、
、 )。已知:HClO的氧化性比NaClO强;
)。已知:HClO的氧化性比NaClO强; 比
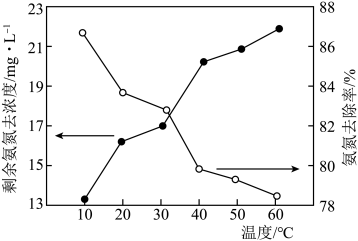
比 更容易被氧化。在相同时间内,反应温度对剩余氨氮浓度和氨氮去除率的影响如图所示。40~60℃时氨氮去除率持续下降,其原因为
更容易被氧化。在相同时间内,反应温度对剩余氨氮浓度和氨氮去除率的影响如图所示。40~60℃时氨氮去除率持续下降,其原因为___________ 。
(2)十八面体结构的 晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。
晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。 沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能。
沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能。
①向银氨溶液中加入 溶液,离心分离、洗涤干燥后可得到
溶液,离心分离、洗涤干燥后可得到 高效光催化剂,写出反应的离子方程式为
高效光催化剂,写出反应的离子方程式为___________ 。
② 和
和 在溶液中反应也可制得
在溶液中反应也可制得 固体,但制得的
固体,但制得的 固体光催化性能极差。从速率角度解释其原因是
固体光催化性能极差。从速率角度解释其原因是___________ 。
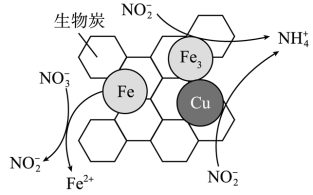
(3)将一定量纳米零价铁和少量铜粉附着在生物炭上,也可用于去除水体中 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 的效率更高,其主要原因是
的效率更高,其主要原因是___________ ; 转化为
转化为 的反应机理可描述为
的反应机理可描述为___________ 。
(1)研究团队采用NaClO氧化法去除水中氨氮(
 、
、 )。已知:HClO的氧化性比NaClO强;
)。已知:HClO的氧化性比NaClO强; 比
比 更容易被氧化。在相同时间内,反应温度对剩余氨氮浓度和氨氮去除率的影响如图所示。40~60℃时氨氮去除率持续下降,其原因为
更容易被氧化。在相同时间内,反应温度对剩余氨氮浓度和氨氮去除率的影响如图所示。40~60℃时氨氮去除率持续下降,其原因为
(2)十八面体结构的
 晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。
晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。 沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能。
沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能。①向银氨溶液中加入
 溶液,离心分离、洗涤干燥后可得到
溶液,离心分离、洗涤干燥后可得到 高效光催化剂,写出反应的离子方程式为
高效光催化剂,写出反应的离子方程式为②
 和
和 在溶液中反应也可制得
在溶液中反应也可制得 固体,但制得的
固体,但制得的 固体光催化性能极差。从速率角度解释其原因是
固体光催化性能极差。从速率角度解释其原因是(3)将一定量纳米零价铁和少量铜粉附着在生物炭上,也可用于去除水体中
 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 的效率更高,其主要原因是
的效率更高,其主要原因是 转化为
转化为 的反应机理可描述为
的反应机理可描述为
您最近一年使用:0次
名校
解题方法
2 . 氮的化合物是重要的化工原料,其转化一直是化学研究的热点。
(1)氨催化氧化法是制硝酸的重要步骤,探究氨催化氧化反应的装置如图所示:
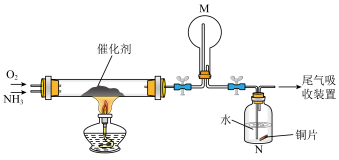
①氨催化氧化时会生成副产物N2O。生成含等物质的量氮元素的NO与N2O时,消耗的O2的物质的量之比为___________ 。
②一段时间后,观察到装置M中有白烟生成,该白烟成分是___________ (写化学式)。
(2)选择性催化还原法(SCR)工艺是以NH3 为还原剂,在催化剂作用下选择性地与NOx发生氧化还原反应生成无害化的N2和H2O。
已知:4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H1=-905.8 kJ/mol
N2(g)+ O2(g)=2NO(g) △H2 = +180 kJ/mol
则NH3与NO反应的热化学方程式为:___________ 。
(3)可用ClO2将氮氧化物转化成 。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为___________ 。
(4)纳米铁粉可去除水体中的 。
。
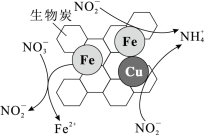
①将一定量纳米零价铁和少量铜粉附着在生物炭上,可用于去除水体中 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 效率更高,其主要原因是
效率更高,其主要原因是___________ 。
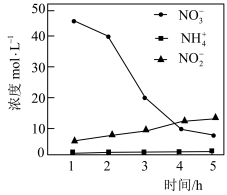
②控制其他条件不变,用纳米铁粉还原水体中的 ,测得溶液中含氮物质(
,测得溶液中含氮物质( 、
、 、
、 )浓度随时间变化如图所示。与初始溶液中
)浓度随时间变化如图所示。与初始溶液中 浓度相比,反应后溶液中所有含氮物质(
浓度相比,反应后溶液中所有含氮物质( 、
、 、
、 )总浓度减小,原因是
)总浓度减小,原因是___________ 。
(1)氨催化氧化法是制硝酸的重要步骤,探究氨催化氧化反应的装置如图所示:

①氨催化氧化时会生成副产物N2O。生成含等物质的量氮元素的NO与N2O时,消耗的O2的物质的量之比为
②一段时间后,观察到装置M中有白烟生成,该白烟成分是
(2)选择性催化还原法(SCR)工艺是以NH3 为还原剂,在催化剂作用下选择性地与NOx发生氧化还原反应生成无害化的N2和H2O。
已知:4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H1=-905.8 kJ/mol
N2(g)+ O2(g)=2NO(g) △H2 = +180 kJ/mol
则NH3与NO反应的热化学方程式为:
(3)可用ClO2将氮氧化物转化成
 。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为(4)纳米铁粉可去除水体中的
 。
。①将一定量纳米零价铁和少量铜粉附着在生物炭上,可用于去除水体中
 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 效率更高,其主要原因是
效率更高,其主要原因是
②控制其他条件不变,用纳米铁粉还原水体中的
 ,测得溶液中含氮物质(
,测得溶液中含氮物质( 、
、 、
、 )浓度随时间变化如图所示。与初始溶液中
)浓度随时间变化如图所示。与初始溶液中 浓度相比,反应后溶液中所有含氮物质(
浓度相比,反应后溶液中所有含氮物质( 、
、 、
、 )总浓度减小,原因是
)总浓度减小,原因是
您最近一年使用:0次
3 . 地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。水体除NO 主要有电化学法。催化还原法等。
主要有电化学法。催化还原法等。
(1)电化学去除弱酸性水体中NO 的反应原理如图1所示:
的反应原理如图1所示:

①作负极的物质是____ 。
②正极的电极反应式是____ 。
③取两份完全相同的含NO 废液A和B,调节废液A、B的pH分别为2.5和4.5,向废液A、B中加入足量铁粉,经相同时间充分反应后,废液A、B均接近中性.废液A、B中铁的最终物质存在形态分别如图2所示。溶液的初始pH对铁的氧化产物有影响,具体影响为
废液A和B,调节废液A、B的pH分别为2.5和4.5,向废液A、B中加入足量铁粉,经相同时间充分反应后,废液A、B均接近中性.废液A、B中铁的最终物质存在形态分别如图2所示。溶液的初始pH对铁的氧化产物有影响,具体影响为____ 。废浓中NO 的去除率较低的是NO
的去除率较低的是NO (“废液A”和“废液B”),NO
(“废液A”和“废液B”),NO 的去除率低的原因是
的去除率低的原因是____ 。
(2)纳米Fe-Ni去除废液中的NO (Ni不参与反应)。
(Ni不参与反应)。
①在酸性条件下,Fe与NO 反应生成Fe2+和NH
反应生成Fe2+和NH ,则反应的离子方程式为
,则反应的离子方程式为_____ 。
②初始pH=2.0的废液,加入一定量的纳米Fe-Ni,反应一段时间后,废液中出现大量白色絮状沉淀物,过滤后白色沉淀物在空气中逐渐变成红褐色。产生上述现象的原因是_____ 。
 主要有电化学法。催化还原法等。
主要有电化学法。催化还原法等。(1)电化学去除弱酸性水体中NO
 的反应原理如图1所示:
的反应原理如图1所示:
①作负极的物质是
②正极的电极反应式是
③取两份完全相同的含NO
 废液A和B,调节废液A、B的pH分别为2.5和4.5,向废液A、B中加入足量铁粉,经相同时间充分反应后,废液A、B均接近中性.废液A、B中铁的最终物质存在形态分别如图2所示。溶液的初始pH对铁的氧化产物有影响,具体影响为
废液A和B,调节废液A、B的pH分别为2.5和4.5,向废液A、B中加入足量铁粉,经相同时间充分反应后,废液A、B均接近中性.废液A、B中铁的最终物质存在形态分别如图2所示。溶液的初始pH对铁的氧化产物有影响,具体影响为 的去除率较低的是NO
的去除率较低的是NO (“废液A”和“废液B”),NO
(“废液A”和“废液B”),NO 的去除率低的原因是
的去除率低的原因是(2)纳米Fe-Ni去除废液中的NO
 (Ni不参与反应)。
(Ni不参与反应)。①在酸性条件下,Fe与NO
 反应生成Fe2+和NH
反应生成Fe2+和NH ,则反应的离子方程式为
,则反应的离子方程式为②初始pH=2.0的废液,加入一定量的纳米Fe-Ni,反应一段时间后,废液中出现大量白色絮状沉淀物,过滤后白色沉淀物在空气中逐渐变成红褐色。产生上述现象的原因是
您最近一年使用:0次
名校
4 . 填空。
(1)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过人工光合作用,以 和
和 为原料制备
为原料制备 和
和 的原理示意图。电极b作
的原理示意图。电极b作_______ 极,表面发生的电极反应为_______ 。

(2)浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如下图所示,该电池从浓缩海水中提取 的同时又获得了电能。
的同时又获得了电能。
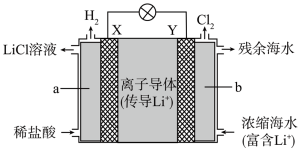
①X为_______ 极,Y极反应式为_______ 。
②Y极生成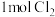 时,
时,_______ 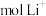 移向
移向_______ (填“X”或“Y”)极。
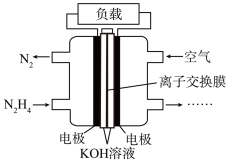
(3)一种以肼(N2H4)为液体燃料的电池装置如下图所示。该电池用空气中的氧气作氧化剂, 作电解质。负极反应式为
作电解质。负极反应式为_______ ;正极反应式为_______ 。
(1)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过人工光合作用,以
 和
和 为原料制备
为原料制备 和
和 的原理示意图。电极b作
的原理示意图。电极b作
(2)浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如下图所示,该电池从浓缩海水中提取
 的同时又获得了电能。
的同时又获得了电能。
①X为
②Y极生成
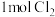 时,
时,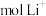 移向
移向(3)一种以肼(N2H4)为液体燃料的电池装置如下图所示。该电池用空气中的氧气作氧化剂,
 作电解质。负极反应式为
作电解质。负极反应式为
您最近一年使用:0次
名校
解题方法
5 . 水体中的六价铬[Cr(Ⅵ)]对生态环境和人体健康威胁很大。工业废水中[Cr(Ⅵ)]常用还原沉淀法、微生物法等进行处理。
(1)“还原沉淀法”常用Na2SO3、FeSO4等处理Cr(Ⅵ)得到Cr(Ⅲ)。已知溶液中含Cr(Ⅵ)的微粒(H2CrO4、Cr2O 和CrO
和CrO )的物质的量分数随pH的关系如图所示。
)的物质的量分数随pH的关系如图所示。
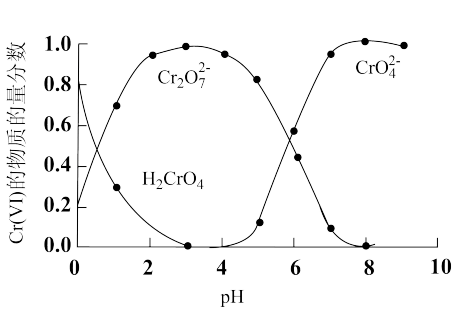
①某含Cr(Ⅵ)废水的pH约为8,写出用Na2SO3处理该废水的主要离子方程式:_______ 。[已知pH=3时,Cr(Ⅲ)以Cr3+形式存在,pH=7.5时,Cr(Ⅲ)开始沉淀]。
②其他条件相同,用Na2SO3处理不同pH含Cr(Ⅵ)的废水,反应相同时间,Cr(Ⅵ)的去除率与pH的关系如图所示。已知酸性条件下Cr(Ⅵ)对Na2SO3具有很强的氧化能力,pH<2时,Cr(Ⅵ)的去除率随pH降低而降低的原因是_______ 。
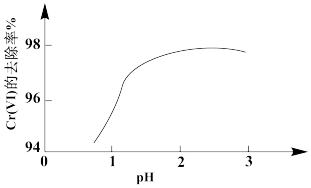
③研究发现,用FeSO4处理pH=3的含Cr(Ⅵ)废水,Cr(Ⅵ)的去除率大于其被FeSO4还原的理论值。Cr(Ⅵ)的去除率大于理论值的原因是_______ 。
(2)“微生物法”处理含Cr(Ⅵ)废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水。
①硫酸盐还原菌能将水中的SO 转化为S2-,S2-与CrO
转化为S2-,S2-与CrO 可反应生成Cr2S3和S两种沉淀。写出S2-与CrO
可反应生成Cr2S3和S两种沉淀。写出S2-与CrO 反应的离子方程式:
反应的离子方程式:_______ 。
②用硫酸盐还原菌(SRB)处理含铬废水时,温度常控制在30℃左右,温度过高,Cr(Ⅵ)的去除率低的原因是_______ 。
③硫酸盐还原菌(SRB)常存在于水体中,会腐蚀许多金属及合金。一种Fe合金在硫酸盐还原菌存在条件下腐蚀的机理如图所示。已知溶液中的S2-会完全转化为FeS,则Fe腐蚀后生成Fe(OH)2和FeS的物质的量之比为_______ 。

(1)“还原沉淀法”常用Na2SO3、FeSO4等处理Cr(Ⅵ)得到Cr(Ⅲ)。已知溶液中含Cr(Ⅵ)的微粒(H2CrO4、Cr2O
 和CrO
和CrO )的物质的量分数随pH的关系如图所示。
)的物质的量分数随pH的关系如图所示。
①某含Cr(Ⅵ)废水的pH约为8,写出用Na2SO3处理该废水的主要离子方程式:
②其他条件相同,用Na2SO3处理不同pH含Cr(Ⅵ)的废水,反应相同时间,Cr(Ⅵ)的去除率与pH的关系如图所示。已知酸性条件下Cr(Ⅵ)对Na2SO3具有很强的氧化能力,pH<2时,Cr(Ⅵ)的去除率随pH降低而降低的原因是

③研究发现,用FeSO4处理pH=3的含Cr(Ⅵ)废水,Cr(Ⅵ)的去除率大于其被FeSO4还原的理论值。Cr(Ⅵ)的去除率大于理论值的原因是
(2)“微生物法”处理含Cr(Ⅵ)废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水。
①硫酸盐还原菌能将水中的SO
 转化为S2-,S2-与CrO
转化为S2-,S2-与CrO 可反应生成Cr2S3和S两种沉淀。写出S2-与CrO
可反应生成Cr2S3和S两种沉淀。写出S2-与CrO 反应的离子方程式:
反应的离子方程式:②用硫酸盐还原菌(SRB)处理含铬废水时,温度常控制在30℃左右,温度过高,Cr(Ⅵ)的去除率低的原因是
③硫酸盐还原菌(SRB)常存在于水体中,会腐蚀许多金属及合金。一种Fe合金在硫酸盐还原菌存在条件下腐蚀的机理如图所示。已知溶液中的S2-会完全转化为FeS,则Fe腐蚀后生成Fe(OH)2和FeS的物质的量之比为

您最近一年使用:0次
2022-04-19更新
|
373次组卷
|
5卷引用:江苏省2022届高三下学期3月第一次调研测试化学试题
6 . 金属铁、铝可用于含铬(主要成份是 )酸性污水的处理。
)酸性污水的处理。
(1)铝在含铬污水中将 还原为Cr3+,再调节pH生成Cr(OH)3沉淀除去。用铝处理不同初始pH的酸性含铬污水,
还原为Cr3+,再调节pH生成Cr(OH)3沉淀除去。用铝处理不同初始pH的酸性含铬污水, 去除率与反应时间的关系如图1。
去除率与反应时间的关系如图1。

①基态Cr3+的核外电子排布式为___________ 。
②铝处理酸性含铬污水发生反应的离子方程式为___________ 。
③铝处理初始pH=3的污水,前180min污水中 的还原较慢,180min后变快,其原因是
的还原较慢,180min后变快,其原因是___________ 。
(2)将铁屑装入玻璃管中制成如图2所示污水处理柱。以同样的流速缓慢通入不同高度的处理柱进行酸性含铬污水处理实验,处理柱失活的时间与处理柱中铁屑高度的关系如图3。

①铁屑的高度为27cm时,处理柱的失活时间不增反降,其可能的原因是___________ 。
②铁屑中掺入一定量炭黑,污水的处理效果明显提高,炭黑的作用是___________ 。
③铁处理后的废水加入石灰调节pH=9,同时通入适量的空气,其目的是___________ 。
 )酸性污水的处理。
)酸性污水的处理。(1)铝在含铬污水中将
 还原为Cr3+,再调节pH生成Cr(OH)3沉淀除去。用铝处理不同初始pH的酸性含铬污水,
还原为Cr3+,再调节pH生成Cr(OH)3沉淀除去。用铝处理不同初始pH的酸性含铬污水, 去除率与反应时间的关系如图1。
去除率与反应时间的关系如图1。
①基态Cr3+的核外电子排布式为
②铝处理酸性含铬污水发生反应的离子方程式为
③铝处理初始pH=3的污水,前180min污水中
 的还原较慢,180min后变快,其原因是
的还原较慢,180min后变快,其原因是(2)将铁屑装入玻璃管中制成如图2所示污水处理柱。以同样的流速缓慢通入不同高度的处理柱进行酸性含铬污水处理实验,处理柱失活的时间与处理柱中铁屑高度的关系如图3。

①铁屑的高度为27cm时,处理柱的失活时间不增反降,其可能的原因是
②铁屑中掺入一定量炭黑,污水的处理效果明显提高,炭黑的作用是
③铁处理后的废水加入石灰调节pH=9,同时通入适量的空气,其目的是
您最近一年使用:0次
名校
解题方法
7 . (1)制作印刷电路板的过程中常用FeCl3溶液与铜反应2Fe3++Cu=2Fe2++Cu2+,把该反应设计成原电池,并回答下列问题:可用___________ 作正极材料,电解质溶液是___________ 正极反应的电极方程式为___________
(2)下图为氢氧燃料电池的构造示意图,由此判断X极为电池的___________ 极,OH-向___________ (填“正”或“负”)极作定向移动,Y极的电极反应式为___________ 。

(3)铅蓄电池是常见的化学电源之一,其充电、放电的总反应式为2PbSO4+2H2O Pb+PbO2+2H2SO4.铅蓄电池放电时正极是
Pb+PbO2+2H2SO4.铅蓄电池放电时正极是___________ (填化学式),该电极质量___________ (填“增加”或“减少”)。放电过程中外电路中转移3 mol电子,消耗硫酸___________ mol
(2)下图为氢氧燃料电池的构造示意图,由此判断X极为电池的

(3)铅蓄电池是常见的化学电源之一,其充电、放电的总反应式为2PbSO4+2H2O
 Pb+PbO2+2H2SO4.铅蓄电池放电时正极是
Pb+PbO2+2H2SO4.铅蓄电池放电时正极是
您最近一年使用:0次
解题方法
8 . 镍镉电池是应用广泛的二次电池,其总反应为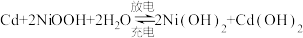 ,制造密封式镍镉电池的部分工艺如下:
,制造密封式镍镉电池的部分工艺如下:
I. 的制备
的制备
以硫酸镍( )为原料制备
)为原料制备 的主要过程如下图所示。制备过程中,降低
的主要过程如下图所示。制备过程中,降低 沉淀速率,可以避免沉淀团聚,提升电池性能。
沉淀速率,可以避免沉淀团聚,提升电池性能。

已知: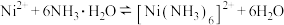
(1)制备过程中,需先加氨水,再加过量NaOH,请分析:
①先加氨水的目的是___ ,用化学平衡移动原理分析加入NaOH需过量的原因___ 。
II.镍镉电池的组装
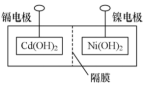
②主要步骤:①将 (内含增强导电性的石墨粉)和
(内含增强导电性的石墨粉)和 (内含防结块的氧化铁粉)固定,中间用隔膜隔成阴极室和阳极室(如下图所示);②将多组上述结构串联;③向电池中注入KOH溶液;④密封。
(内含防结块的氧化铁粉)固定,中间用隔膜隔成阴极室和阳极室(如下图所示);②将多组上述结构串联;③向电池中注入KOH溶液;④密封。
(2)下列对镍镉电池组装和使用的分析正确的是_______ (填字母)。
A.密封镍镉电池可以避免KOH变质
B.镍电极为电池的负极,镉电极为电池的正极
C.电池组装后,应先充电,再使用
III.池充电时,若 和
和 耗尽后继续充电,会造成安全隐患,称为过度充电。制造电池时,在镉电极加入过量的
耗尽后继续充电,会造成安全隐患,称为过度充电。制造电池时,在镉电极加入过量的 可对电池进行过度充电保护,该方法称为镉氧循环法。
可对电池进行过度充电保护,该方法称为镉氧循环法。
(3)若 耗尽后继续充电,镉电极上生成的物质的化学式为
耗尽后继续充电,镉电极上生成的物质的化学式为___ 。
(4)已知:①隔膜可以透过阴离子和分子;②O2可以与Cd发生反应生成 。请结合两个电极上的电极反应式说明用镉氧循环法实现过度充电保护的原理
。请结合两个电极上的电极反应式说明用镉氧循环法实现过度充电保护的原理___ 。
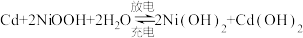 ,制造密封式镍镉电池的部分工艺如下:
,制造密封式镍镉电池的部分工艺如下:I.
 的制备
的制备以硫酸镍(
 )为原料制备
)为原料制备 的主要过程如下图所示。制备过程中,降低
的主要过程如下图所示。制备过程中,降低 沉淀速率,可以避免沉淀团聚,提升电池性能。
沉淀速率,可以避免沉淀团聚,提升电池性能。
已知:
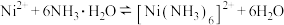
(1)制备过程中,需先加氨水,再加过量NaOH,请分析:
①先加氨水的目的是
II.镍镉电池的组装
②主要步骤:①将
 (内含增强导电性的石墨粉)和
(内含增强导电性的石墨粉)和 (内含防结块的氧化铁粉)固定,中间用隔膜隔成阴极室和阳极室(如下图所示);②将多组上述结构串联;③向电池中注入KOH溶液;④密封。
(内含防结块的氧化铁粉)固定,中间用隔膜隔成阴极室和阳极室(如下图所示);②将多组上述结构串联;③向电池中注入KOH溶液;④密封。
(2)下列对镍镉电池组装和使用的分析正确的是
A.密封镍镉电池可以避免KOH变质
B.镍电极为电池的负极,镉电极为电池的正极
C.电池组装后,应先充电,再使用
III.池充电时,若
 和
和 耗尽后继续充电,会造成安全隐患,称为过度充电。制造电池时,在镉电极加入过量的
耗尽后继续充电,会造成安全隐患,称为过度充电。制造电池时,在镉电极加入过量的 可对电池进行过度充电保护,该方法称为镉氧循环法。
可对电池进行过度充电保护,该方法称为镉氧循环法。(3)若
 耗尽后继续充电,镉电极上生成的物质的化学式为
耗尽后继续充电,镉电极上生成的物质的化学式为(4)已知:①隔膜可以透过阴离子和分子;②O2可以与Cd发生反应生成
 。请结合两个电极上的电极反应式说明用镉氧循环法实现过度充电保护的原理
。请结合两个电极上的电极反应式说明用镉氧循环法实现过度充电保护的原理
您最近一年使用:0次
解题方法
9 . 资料显示: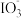 在酸性溶液中能氧化I-,反应为
在酸性溶液中能氧化I-,反应为 +5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
+5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
(1)甲同学对这一现象做出如下假设:t秒前生成了I2,但由于存在Na2SO3,I2被消耗,该反应的离子方程式为________ , 的还原性
的还原性________ I-(填“>”“=”或“<”)。
(2)为验证他的猜想,甲同学向反应后的蓝色溶液中加入________ ,蓝色迅速消失,随后再次变蓝。
(3)甲同学设计了如下实验,进一步研究Na2SO3溶液和KIO3溶液反应的过程。
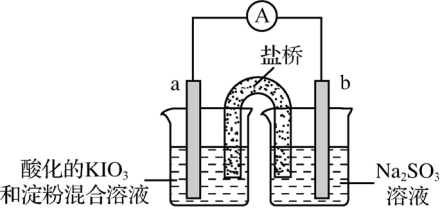
①甲同学在b电极附近的溶液中检测出了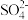
②刚开始放电时,a电极附近溶液未变蓝;取出a电极附近溶液于试管中,溶液变蓝。 在a极放电的产物是
在a极放电的产物是________ 。
③放电一段时间后,a电极附近溶液短暂出现蓝色,随即消失,重复多次后,蓝色不再褪去。电流表显示电路中时而出现电流,时而归零,最终电流消失。电流表短暂归零的原因是________ 。
④下列说法正确的是________ 。
a. a电极附近蓝色不再褪去时, 尚未完全氧化
尚未完全氧化
b. a电极附近短暂出现蓝色,随即消失的原因可能是因为I2被 还原
还原
c. 电流消失后,向b电极附近加入过量Na2SO3溶液,重新产生电流,a电极附近蓝色褪去
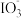 在酸性溶液中能氧化I-,反应为
在酸性溶液中能氧化I-,反应为 +5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
+5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。(1)甲同学对这一现象做出如下假设:t秒前生成了I2,但由于存在Na2SO3,I2被消耗,该反应的离子方程式为
 的还原性
的还原性(2)为验证他的猜想,甲同学向反应后的蓝色溶液中加入
(3)甲同学设计了如下实验,进一步研究Na2SO3溶液和KIO3溶液反应的过程。

①甲同学在b电极附近的溶液中检测出了
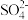
②刚开始放电时,a电极附近溶液未变蓝;取出a电极附近溶液于试管中,溶液变蓝。
 在a极放电的产物是
在a极放电的产物是③放电一段时间后,a电极附近溶液短暂出现蓝色,随即消失,重复多次后,蓝色不再褪去。电流表显示电路中时而出现电流,时而归零,最终电流消失。电流表短暂归零的原因是
④下列说法正确的是
a. a电极附近蓝色不再褪去时,
 尚未完全氧化
尚未完全氧化b. a电极附近短暂出现蓝色,随即消失的原因可能是因为I2被
 还原
还原c. 电流消失后,向b电极附近加入过量Na2SO3溶液,重新产生电流,a电极附近蓝色褪去
您最近一年使用:0次
名校
解题方法
10 . 锂二次电池新正极材料的探索和研究对锂电池的发展非常关键。
(1) 锂硒电池具有优异的循环稳定性。
①正极材料Se可由SO2通入亚硒酸(H2SeO3)溶液反应制得,则该反应的化学方程式为__ 。
②一种锂硒电池放电时的工作原理如图1所示,写出正极的电极反应式:________________ 。充电时Li+向________ (填“Se”或“Li”)极迁移。
③ Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是________ 。

(2) Li2S电池的理论能量密度高,其正极材料为碳包裹的硫化锂(Li2S)。
① Li2S可由硫酸锂与壳聚糖高温下制得,其中壳聚糖的作用是________ 。
②取一定量Li2S样品在空气中加热,测得样品固体残留率随温度的变化如图3所示。(固体残留率= ×100%)分析300 ℃后,固体残留率变化的原因是
×100%)分析300 ℃后,固体残留率变化的原因是________ 。
(1) 锂硒电池具有优异的循环稳定性。
①正极材料Se可由SO2通入亚硒酸(H2SeO3)溶液反应制得,则该反应的化学方程式为
②一种锂硒电池放电时的工作原理如图1所示,写出正极的电极反应式:
③ Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是

(2) Li2S电池的理论能量密度高,其正极材料为碳包裹的硫化锂(Li2S)。
① Li2S可由硫酸锂与壳聚糖高温下制得,其中壳聚糖的作用是
②取一定量Li2S样品在空气中加热,测得样品固体残留率随温度的变化如图3所示。(固体残留率=
 ×100%)分析300 ℃后,固体残留率变化的原因是
×100%)分析300 ℃后,固体残留率变化的原因是
您最近一年使用:0次
2020-05-21更新
|
868次组卷
|
6卷引用:江苏省泰州市2020届高三第二次模拟考试(5月) 化学试题
江苏省泰州市2020届高三第二次模拟考试(5月) 化学试题江苏省扬州市江都区大桥高级中学2020届高三下学期学情调研(三)化学试题江苏省徐州市2019-2020学年高二下学期期末抽测化学试题(已下线)科技热点之几种新型电池(已下线)第18讲 原电池 化学电源(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)4.1.2 化学电源-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)



