解题方法
1 . 原电池原理广泛应用于科技、生产和生活中。
(1)一种处理垃圾渗透液并用其发电的装置工作示意图如下。

①在空气中,微生物将垃圾渗透液硝化,该反应的离子方程式为___________ 。
②Y电极的电极反应式为___________ 。
③盐桥中 移向
移向___________ (填“X或Y”)极;当转移0.15mol电子时,生成标准状况下 的体积为
的体积为___________ L。
(2)用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。
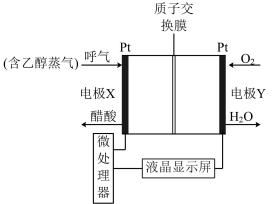
①电极X是该电池的___________ (填“正”或“负”)极,电池总反应式为___________ 。
②电池工作时,质子通过交换膜___________ (填“从左向右”或“从右向左”)迁移。
(1)一种处理垃圾渗透液并用其发电的装置工作示意图如下。

①在空气中,微生物将垃圾渗透液硝化,该反应的离子方程式为
②Y电极的电极反应式为
③盐桥中
 移向
移向 的体积为
的体积为(2)用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。

①电极X是该电池的
②电池工作时,质子通过交换膜
您最近一年使用:0次
名校
解题方法
2 . 微生物燃料电池是一种利用微生物将有机物中的化学能直接转化成电能的装置。已知某种利用微生物的甲醇燃料电池中,电解质溶液为酸性,示意图如下:

(1)该电池外电路电子的流动方向为_______ (填“从A到B”或“从B到A”)。
(2)电池工作结束后,B电极室溶液的pH与工作前相比将_______ (填“增大”“减小”或“不变”,溶液体积变化忽略不计)。
(3)A电极附近甲醇发生的电极反应式为_______ 。

(1)该电池外电路电子的流动方向为
(2)电池工作结束后,B电极室溶液的pH与工作前相比将
(3)A电极附近甲醇发生的电极反应式为
您最近一年使用:0次
2022-12-02更新
|
151次组卷
|
2卷引用:河南省郑州外国语学校2022-2023学年高二上学期期中考试化学试题
3 . 人们利用电化学原理满足不同的需求。下列每小题中的电化学原理广泛应用于日常生活、生产和科学技术等方面,请根据题中提供的信息填空。
(1)蓄电池在放电时起原电池的作用,在充电时起电解池的作用。铅蓄电池属于_______ (填“一次”或“二次”)电池,铅蓄电池的总反应为Pb+PbO2+2H2SO4 2PbSO4+2H2O,铅蓄电池的放电反应与充电反应
2PbSO4+2H2O,铅蓄电池的放电反应与充电反应_______ (填“是”或“不是”)可逆反应。
(2)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
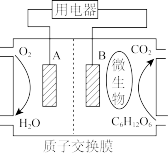
①B为微生物燃料电池的_______ (填“正”或“负”)极。
②正极的电极反应式为_______ 。
③电池工作过程中,H+将移向_______ (填“正”或“负”)极。
④在电池反应中,每消耗1mol氧气,理论上转移的电子的物质的量为_______ 。
(3)若将反应Cu+2FeCl3=CuCl2+2FeCl2设计成原电池,则该电池的正极材料可以是_______ (填“铜片”或“石墨”)。请在烧杯中画出你所设计的原电池的装置图,并标注出电极材料和电解质溶液_______ 。

(1)蓄电池在放电时起原电池的作用,在充电时起电解池的作用。铅蓄电池属于
 2PbSO4+2H2O,铅蓄电池的放电反应与充电反应
2PbSO4+2H2O,铅蓄电池的放电反应与充电反应(2)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。

①B为微生物燃料电池的
②正极的电极反应式为
③电池工作过程中,H+将移向
④在电池反应中,每消耗1mol氧气,理论上转移的电子的物质的量为
(3)若将反应Cu+2FeCl3=CuCl2+2FeCl2设计成原电池,则该电池的正极材料可以是

您最近一年使用:0次
名校
4 . 下图为某化学兴趣小组探究不同条件下化学能转变为电能的装置。请根据原电池原理回答问题:

(1)若电极a为Zn。电极b为Cu。电解质溶液为稀硫酸,该装置工作时, 向
向___ 极(填a或b)移动,经过一段时间后,若导线中转移了0.4mol电子,则产生的气体在标况下的体积为____ 。如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,该同学在烧杯中分别加入等体积的下列液体,你认为可行的是____ (填序号)。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液 E.KNO3溶液
(2)若电极a为Mg,电极b为Al,电解质溶液为氢氧化钠溶液,该原电池工作时,电子从__ 极(填a或b)流出。一段时间后,若反应转移3NA个电子,则理论上的电解质溶液质量变化是___ g。

(1)若电极a为Zn。电极b为Cu。电解质溶液为稀硫酸,该装置工作时,
 向
向A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液 E.KNO3溶液
(2)若电极a为Mg,电极b为Al,电解质溶液为氢氧化钠溶液,该原电池工作时,电子从
您最近一年使用:0次
5 . 锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:

(1)外电路的电流方向是由____ 极流向____ 极(填字母)。
(2)电池正极反应式为____ 。
(3)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为___ 。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为___ 。

(1)外电路的电流方向是由
(2)电池正极反应式为
(3)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为
您最近一年使用:0次
名校
解题方法
6 . 为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
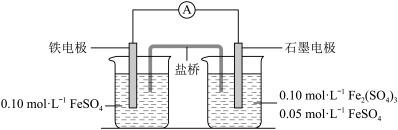
回答下列问题:
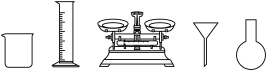
(1)由FeSO4·7H2O固体配制0.10 mol·L-1FeSO4溶液,需要的仪器有药匙、玻璃棒、________ (从下列图中选择,写出名称)。
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择________ 作为电解质。
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入________ 电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L-1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=________ 。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为________ ,铁电极的电极反应式为______________ 。因此,验证了Fe2+氧化性小于Fe3+还原性小于Fe。

回答下列问题:
(1)由FeSO4·7H2O固体配制0.10 mol·L-1FeSO4溶液,需要的仪器有药匙、玻璃棒、

(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择
| 阳离子 | u∞×108/(m2·s-1·V-1) | 阴离子 | u∞×108/(m2·s-1·V-1) |
| Li+ | 4.07 |  | 4.61 |
| Na+ | 5.19 |  | 7.40 |
| Ca2+ | 6.59 | Cl- | 7.91 |
| K+ | 7.62 |  | 8.27 |
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L-1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为
您最近一年使用:0次
2021-01-12更新
|
135次组卷
|
2卷引用:河南省南阳市第五中学2021-2022学年高二上学期10月月考化学试题
名校
解题方法
7 . (1)新型固体LiFePO4隔膜电池广泛应用于电动汽车。
电池反应为FePO4+Li LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电。该电池放电时Li+向
LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电。该电池放电时Li+向__ 极移动(填“正”或“负”),负极反应为Li-e-=Li+,则正极反应式为___ 。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:
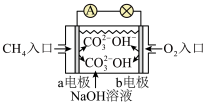
①电池的负极是__ (填“a”或“b”)电极,该极的电极反应式为__ 。
②电池工作一段时间后电解质溶液的pH__ (填“增大”、“减小”或“不变”)。
电池反应为FePO4+Li
 LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电。该电池放电时Li+向
LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电。该电池放电时Li+向(2)如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极是
②电池工作一段时间后电解质溶液的pH
您最近一年使用:0次
2020-11-18更新
|
331次组卷
|
2卷引用:河南省郑州市第106中学2020-2021学年高二上学期9月月考化学(理)试题
名校
解题方法
8 . 下表中阿拉伯数字(1、2…)是元素周期表中行或列的序号。请参照元素A~I在周期表中的位置,回答下列问题。
(1)B、C两元素中非金属性较强的是____ (写出元素名称),I元素在周期表中的位置是_____ 。
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式_______ 。
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1∶1和1∶2的两种共价化合物X和Y,请写出Y的电子式_____ ,该元素还能与A~I中的另一种元素以原子个数之比为1∶1和1∶2形成两种离子化合物Z和M,用电子式表示M的形成过程:____ 。
(4)表中某两种元素的气态单质可以形成燃料电池,其产物清洁无污染,请写出碱性环境中负极反应式_______ 。
| 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 | |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I |
(1)B、C两元素中非金属性较强的是
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1∶1和1∶2的两种共价化合物X和Y,请写出Y的电子式
(4)表中某两种元素的气态单质可以形成燃料电池,其产物清洁无污染,请写出碱性环境中负极反应式
您最近一年使用:0次
解题方法
9 . 如图所示:
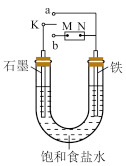
(1)若开始时开关K与a连接,则铁发生电化学腐蚀中的________ 腐蚀(填“吸氧”或“析氢”),正极发生的电极反应式为_______________ 。
(2)若开始时开关K与b连接,两极均有气体产生,则N端是电源的________ 极(填“正”或“负”),电解池总反应的离子方程式为_________ 。

(1)若开始时开关K与a连接,则铁发生电化学腐蚀中的
(2)若开始时开关K与b连接,两极均有气体产生,则N端是电源的
您最近一年使用:0次
10 . 我国每年产生的废旧铅蓄电池约330万吨。从含铅废料(PbSO4、PbO2、PbO等)中回收铅,实现铅的再生,意义重大。一种回收铅的工作流程如下:

(1)铅蓄电池放电时,PbO2作_______ 极。
(2)过程I,已知:PbSO4、PbCO3的溶解度(20℃)见图l;Na2SO4、Na2CO3的溶解度见图2。

①根据图l写出过程I的离子方程式:____ 。
②生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降。根据图2,解释可能原因:
i.温度降低,反应速率降低;
ii.__________________________________________ (请你提出一种合理解释)。
(3)过程Ⅱ,发生反应2PbO2+H2C2O4=2PbO+H2O2+2CO2↑。实验中检测到有大量O2放出,推测PbO2氧化了H2O2,通过实验证实了这一推测。实验方案是__________________ 。(已知:PbO2为棕黑色固体;PbO为橙黄色固体)
(4)过程Ⅲ,将PbO粗品溶解在HCI和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液,生成Pb,如图3。阴极的电极反应式是_______________________ 。


(1)铅蓄电池放电时,PbO2作
(2)过程I,已知:PbSO4、PbCO3的溶解度(20℃)见图l;Na2SO4、Na2CO3的溶解度见图2。

①根据图l写出过程I的离子方程式:
②生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降。根据图2,解释可能原因:
i.温度降低,反应速率降低;
ii.
(3)过程Ⅱ,发生反应2PbO2+H2C2O4=2PbO+H2O2+2CO2↑。实验中检测到有大量O2放出,推测PbO2氧化了H2O2,通过实验证实了这一推测。实验方案是
(4)过程Ⅲ,将PbO粗品溶解在HCI和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液,生成Pb,如图3。阴极的电极反应式是

您最近一年使用:0次



