解题方法
1 . 原电池是直接把化学能转化为电能的装置。
(1)如图所示:
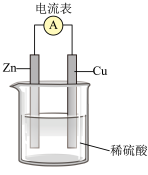
①在Cu-Zn原电池中,Zn片上发生___________ 反应(填“氧化”或“还原”)。 Cu片上发生的电极反应式为___________ 。
②外电路中电子流向___________ 极(填 “正”或“负”,下同); 内电路溶液中SO 移向
移向___________ 极。
(2)某原电池的总反应为Zn + Cu2+ = Cu + Zn2+,该原电池组成正确的是___________。
(3)某锂-空气电池的总反应为4Li + O2 + 2H2O = 4LiOH,其工作原理如图所示:
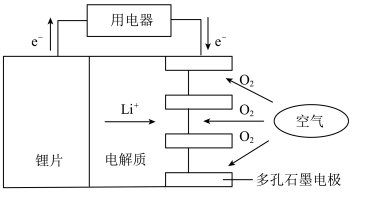
下列说法正确的是___________ 。
a.锂片作负极
b.O2发生氧化反应
c.正极的反应式为 O2 + 4e-+ 2H2O = 4OH-
(1)如图所示:

①在Cu-Zn原电池中,Zn片上发生
②外电路中电子流向
 移向
移向(2)某原电池的总反应为Zn + Cu2+ = Cu + Zn2+,该原电池组成正确的是___________。
A.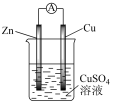 | B.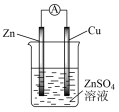 |
C. | D.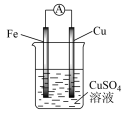 |

下列说法正确的是
a.锂片作负极
b.O2发生氧化反应
c.正极的反应式为 O2 + 4e-+ 2H2O = 4OH-
您最近一年使用:0次
名校
2 . 电池是一种将化学能直接转化为电能的装置,它的出现极大方便了人们的生活。如下为三种电池的示意图:

(1)请根据原电池的形成条件,分析图中原电池的组成要素,用化学式填写下表:
(2)锂—空气电池的理论能量密度高,是未来电动汽车续航里程的关键。锂—空气电池的反应原理可表示为: 。探究
。探究 对放电的影响:向非水电解液中加入少量水,放电后检测A、B电极上的固体物质:A极产物:
对放电的影响:向非水电解液中加入少量水,放电后检测A、B电极上的固体物质:A极产物: ;B极产物:
;B极产物: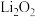 、
、 。A、B电极产生
。A、B电极产生 的化学或电极反应方程式分别是:A极:
的化学或电极反应方程式分别是:A极:_______ ;B极: 或
或_______ 。
结论: 降低锂一空气电池放电、充电循环性能。
降低锂一空气电池放电、充电循环性能。
(3)铝离子电池高效耐用、超快充电、高安全性、可折叠、材料成本低等优势。已知图3的正极反应物为 ,请写出两极的电极反应式:负极:
,请写出两极的电极反应式:负极:_______ ;正极:_______ 。
(4)某碱性锌锰电池维持电流0.5A(相当于每秒通过 电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6g,则电池失效时仍有
电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6g,则电池失效时仍有_______ %的金属锌未参加反应。

(1)请根据原电池的形成条件,分析图中原电池的组成要素,用化学式填写下表:
| 负极材料 | 负极反应物 | 正极材料 | 正极反应物 | 离子导体 | |
| 图1:碱性锌锰电池 | K+、OH- | ||||
| 图2:锂-空气电池 | Li+ |
 。探究
。探究 对放电的影响:向非水电解液中加入少量水,放电后检测A、B电极上的固体物质:A极产物:
对放电的影响:向非水电解液中加入少量水,放电后检测A、B电极上的固体物质:A极产物: ;B极产物:
;B极产物: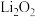 、
、 。A、B电极产生
。A、B电极产生 的化学或电极反应方程式分别是:A极:
的化学或电极反应方程式分别是:A极: 或
或结论:
 降低锂一空气电池放电、充电循环性能。
降低锂一空气电池放电、充电循环性能。(3)铝离子电池高效耐用、超快充电、高安全性、可折叠、材料成本低等优势。已知图3的正极反应物为
 ,请写出两极的电极反应式:负极:
,请写出两极的电极反应式:负极:(4)某碱性锌锰电池维持电流0.5A(相当于每秒通过
 电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6g,则电池失效时仍有
电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6g,则电池失效时仍有
您最近一年使用:0次
名校
解题方法
3 . 某课外小组利用原电池原理驱动某简易小车(用电动机表示)。

(1)初步设计的实验装置示意图如图1所示,CuSO4溶液在图1所示装置中的作用是_______ (答两点)。
实验发现:该装置不能驱动小车。
(2)该小组同学提出假设:
可能是氧化反应和还原反应没有完全隔开,降低了能量利用率,为进一步提高能量利用率,该小组同学在原有反应的基础上将氧化反应与还原反应隔开进行,优化的实验装置示意图如图2所示,图2中A溶液和B溶液分别是_______ 和_______ ,盐桥属于_______ (填“电子导体”或“离子导体”),盐桥中的Cl-移向_______ 溶液(填“A”或“B”)。为降低电池自重,该小组用阳离子交换膜代替盐桥,实验装置示意图如图3所示。
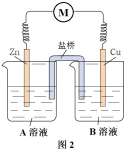
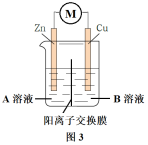
(3)利用改进后的实验装置示意图3,仍不能驱动小车,该小组同学再次提出假设:
可能是电压不够;可能是电流不够;可能是电压和电流都不够;
实验发现:1.5V的干电池能驱动小车,其电流为750μA;
实验装置示意图3的最大电压为1.0V,最大电流为200μA
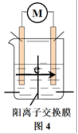
该小组从电极材料、电极反应、离子导体等角度对装置做进一步优化,请补全优化后的实验装置示意图4,并在图中标明阳离子的流向。_______

(1)初步设计的实验装置示意图如图1所示,CuSO4溶液在图1所示装置中的作用是
实验发现:该装置不能驱动小车。
(2)该小组同学提出假设:
可能是氧化反应和还原反应没有完全隔开,降低了能量利用率,为进一步提高能量利用率,该小组同学在原有反应的基础上将氧化反应与还原反应隔开进行,优化的实验装置示意图如图2所示,图2中A溶液和B溶液分别是


(3)利用改进后的实验装置示意图3,仍不能驱动小车,该小组同学再次提出假设:
可能是电压不够;可能是电流不够;可能是电压和电流都不够;
实验发现:1.5V的干电池能驱动小车,其电流为750μA;
实验装置示意图3的最大电压为1.0V,最大电流为200μA
该小组从电极材料、电极反应、离子导体等角度对装置做进一步优化,请补全优化后的实验装置示意图4,并在图中标明阳离子的流向。

您最近一年使用:0次
2021-02-05更新
|
413次组卷
|
2卷引用:北京市石景山区2020-2021学年高二上学期期末调研化学试题
4 . 电化学手段对于研究物质性质以及工业生产中都有重要价值。
I. 某实验小组利用原电池装置对 FeCl3与Na2SO3的反应进行探究。
(1)取少量 FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生蓝色沉淀,证明 FeCl3转化成_____ 。
(2)检验另一电极产物的操作及现象是_____ 。
(3)负极的电极反应式为_____ 。
II. 工业上用 Na2SO4溶液吸收工业烟气中的低浓度 SO2形成吸收液后,再采用阳离子膜电解法, 控制电压,电解吸收液可制成产品 S 和 O2。工作原理示意图如下图

阴极区和阳极区的pH 随时间的变化关系如下图:

(4)阳极反应的电极反应物是____ 。
(5)阳极区 pH 降低的原因是____ 。(写出一条即可)
(6) 结合电极反应式,说明阴极区 pH 升高的原因_____ 。(写出一条即可)
I. 某实验小组利用原电池装置对 FeCl3与Na2SO3的反应进行探究。
| 装置 | 实验现象 |
 1 mol/L FeCl3溶液(pH≈1) 1mol/LNa2SO3溶液(pH≈9) | 灵敏电流计指针发生偏转 |
(1)取少量 FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生蓝色沉淀,证明 FeCl3转化成
(2)检验另一电极产物的操作及现象是
(3)负极的电极反应式为
II. 工业上用 Na2SO4溶液吸收工业烟气中的低浓度 SO2形成吸收液后,再采用阳离子膜电解法, 控制电压,电解吸收液可制成产品 S 和 O2。工作原理示意图如下图

阴极区和阳极区的pH 随时间的变化关系如下图:

(4)阳极反应的电极反应物是
(5)阳极区 pH 降低的原因是
(6) 结合电极反应式,说明阴极区 pH 升高的原因
您最近一年使用:0次
名校
解题方法
5 . 如图所示是原电池的装置图。请回答:

(1)若C为稀H2SO4,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为___ ;反应进行一段时间后溶液酸性将__ (填“增强”“减弱”或“基本不变”)。
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A(正极)极材料为___ ,B(负极)极材料为__ ,溶液C为___ 。
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:
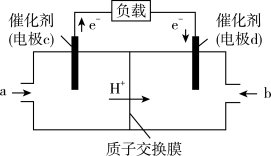
电池总反应为2CH3OH+3O2=2CO2+4H2O,则d电极是__ (填“正极”或“负极”),c电极的反应方程式为__ 。若线路中转移1mol电子,则上述CH3OH燃料电池消耗的O2在标准状况下的体积为__ L。

(1)若C为稀H2SO4,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A(正极)极材料为
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:

电池总反应为2CH3OH+3O2=2CO2+4H2O,则d电极是
您最近一年使用:0次
2020-06-23更新
|
555次组卷
|
3卷引用:北京市首都师范大学附属中学2019-2020学年高一下学期结业考试(期末)化学试题
名校
解题方法
6 . 铜与稀硫酸不反应,某校实验小组的同学在老师的指导下设计了下列装置,实现了铜与稀硫酸的反应。请回答下列问题:
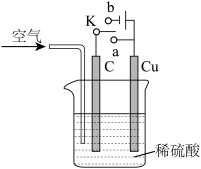
(1)甲同学认为,不通入空气,将 K 与_____ (填“a”或“b”)连接,即可实现。则总反应的离子方程式为_____ 。
(2)乙同学认为在通入空气的同时,将开关 K 与_____ 连通,也可以实现,则电池总反应的化学方程式为_____ 。

(1)甲同学认为,不通入空气,将 K 与
(2)乙同学认为在通入空气的同时,将开关 K 与
您最近一年使用:0次
名校
解题方法
7 . 研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以氢氧化锂为电解质,使用时加入水即可放电,总反应方程式为2Li+2H2O=2LiOH +H2↑。
(1)该电池的负极是________ ,负极反应式是____________ 。
(2)正极现象是____________ ,正极反应式是____________ 。
(3)放电时氢氧根离子向________ (填“正极”或“负极”)移动。
(1)该电池的负极是
(2)正极现象是
(3)放电时氢氧根离子向
您最近一年使用:0次
2020-01-28更新
|
419次组卷
|
2卷引用:北京市海淀区首都师范大学附属中学2019-2020学年高一下学期第二次月考化学试题



