名校
解题方法
1 . 人们应用原电池原理制作了多种电池,广泛使用于日常生活、生产和科学技术等方面,以满足不同的需要。请按要求回答下列问题:
(1)新一代锂二次电池体系和全固态锂二次电池体系是化学、物理等学科的基础理论研究与应用技术的前沿。
①Li—CuO二次电池的比能量高、工作温度宽。Li—CuO二次电池中,放电时金属锂作____ 极。比能量是指消耗单位质量的电极所释放的电量,可用来衡量电池的优劣,则Li、Na、Al分别作为电极时比能量由大到小的顺序为____ 。
②一种制备CuO的过程如图:

“酸浸反应”中,H2O2作____ (填“氧化剂”或“还原剂”)。写出“混合沉淀”过程产生Cu2(OH)2CO3反应的离子方程式:____ 。
(2)CH3OH可作为燃料使用,使用CH3OH和O2组合设计的燃料电池的结构如图所示,电池总反应为2CH3OH+3O2=2CO2+4H2O,质子(H+)交换膜左右两侧的溶液均为等浓度的稀硫酸。

①物质a为____ (填化学式);电极c上发生的电极反应为____ 。
②电极d为____ 极,电极d上发生的电极反应为____ 。
(1)新一代锂二次电池体系和全固态锂二次电池体系是化学、物理等学科的基础理论研究与应用技术的前沿。
①Li—CuO二次电池的比能量高、工作温度宽。Li—CuO二次电池中,放电时金属锂作
②一种制备CuO的过程如图:

“酸浸反应”中,H2O2作
(2)CH3OH可作为燃料使用,使用CH3OH和O2组合设计的燃料电池的结构如图所示,电池总反应为2CH3OH+3O2=2CO2+4H2O,质子(H+)交换膜左右两侧的溶液均为等浓度的稀硫酸。

①物质a为
②电极d为
您最近一年使用:0次
2022-05-03更新
|
253次组卷
|
3卷引用:湖北省黄冈市部分重点中学2021-2022学年高一下学期4月期中联考化学试题
解题方法
2 . I.一种利用电化学原理治污的装置如下图,其反应原理是6NO2+8NH3=7N2+12H2O
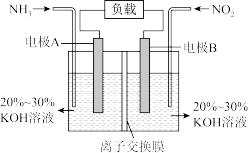
(1)A电极的电极反应式为___________ 。
(2)下列关于该电池说法正确的是___________(填序号)。
II.全钒液流电池(VFB)是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图为VFB放电工作原理。
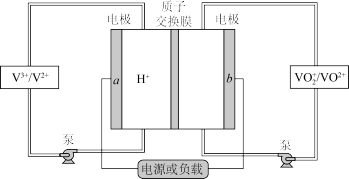
(3)电极b为___________ 极(填“正”或“负”)。充电时,该电极的反应为___________ 。
(4)若负载为如图2所示的装置,A、B、C、D均为石墨电极。
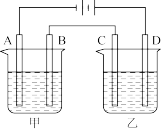
①甲槽是电极电解饱和食盐水的装置,产生40 g NaOH时,VFB电池中消耗___________ mol H+。
②乙槽为200 mLCuSO4溶液,当C电极析出0.64 g物质时,则乙槽中生成的H2SO4的物质的量为___________ mol。
③若通电一段时间后,向所得的乙槽溶液中加入0.2 mol的Cu(OH)2才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为___________ (用NA表示)
(5)锂离子电池的一种工作方式为Li+在电池两极的嵌入或迁出,以石墨做正极时,充电过程中,Li+在该石墨电极上___________ (填“嵌入”或“迁出”)。

(1)A电极的电极反应式为
(2)下列关于该电池说法正确的是___________(填序号)。
| A.电子从右侧电极经过负载后流向左侧电极 |
| B.为使电池持续放电,离子交换膜需选用阴离子交换膜 |
| C.电池工作一段时间,溶液的pH不变 |
| D.当有44.8 LNO2被处理时,转移电子的物质的量为8 mol |
II.全钒液流电池(VFB)是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图为VFB放电工作原理。

(3)电极b为
(4)若负载为如图2所示的装置,A、B、C、D均为石墨电极。

①甲槽是电极电解饱和食盐水的装置,产生40 g NaOH时,VFB电池中消耗
②乙槽为200 mLCuSO4溶液,当C电极析出0.64 g物质时,则乙槽中生成的H2SO4的物质的量为
③若通电一段时间后,向所得的乙槽溶液中加入0.2 mol的Cu(OH)2才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为
(5)锂离子电池的一种工作方式为Li+在电池两极的嵌入或迁出,以石墨做正极时,充电过程中,Li+在该石墨电极上
您最近一年使用:0次
3 . 填空题
(1)浓硝酸久置显黄色的原因(用化学方程式回答)___________
(2)氢氟酸腐蚀玻璃的原因(用化学方程式回答)___________
(3)请用实验方法证明某无色晶体是
___________
(4)下面三个化学方程式能不能设计成原电池
a.
b.
c.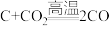
请回答:若不能,说明理由:___________ ,如果能,请画出设计的简单原电池的示意图,并标出正、负极,写出电极反应式。
(1)浓硝酸久置显黄色的原因(用化学方程式回答)
(2)氢氟酸腐蚀玻璃的原因(用化学方程式回答)
(3)请用实验方法证明某无色晶体是

(4)下面三个化学方程式能不能设计成原电池
a.

b.

c.
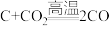
请回答:若不能,说明理由:
您最近一年使用:0次
解题方法
4 . 新一代锂二次电池体系和全固态锂二次电池体系是化学、物理等学科的基础理论研究与应用技术的前沿。
(1)Li-CuO二次电池的比能量高、工作温度宽。Li-CuO二次电池中,金属锂作___________ 极。比能量是指消耗单位质量的电极所释放的电量,用来衡量电池的优劣,则Li、Na、Al分别作为电极时比能量由大到小的顺序为___________ 。
(2)通过如下过程制备CuO:

“过程Ⅰ”中,H2O2作___________ (填“氧化剂”或“还原剂”)。“过程Ⅱ”产生Cu2(OH)2CO3的离子方程式为___________ 。
(3)锂硒电池具有优异的循环稳定性。

①正极材料Se可由SO2通入亚硒酸(H2SeO3)溶液反应制得,则该反应中氧化剂与还原剂的物质的量之比为___________ 。
②一种锂硒电池放电时的工作原理如图1所示,正极的电极反应式为___________ 。
③Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是___________ 。
(1)Li-CuO二次电池的比能量高、工作温度宽。Li-CuO二次电池中,金属锂作
(2)通过如下过程制备CuO:

“过程Ⅰ”中,H2O2作
(3)锂硒电池具有优异的循环稳定性。

①正极材料Se可由SO2通入亚硒酸(H2SeO3)溶液反应制得,则该反应中氧化剂与还原剂的物质的量之比为
②一种锂硒电池放电时的工作原理如图1所示,正极的电极反应式为
③Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是
您最近一年使用:0次
名校
解题方法
5 . 如图所示是原电池的装置图。请回答:

(1)若C为稀H2SO4,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为___ ;反应进行一段时间后溶液酸性将__ (填“增强”“减弱”或“基本不变”)。
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A(正极)极材料为___ ,B(负极)极材料为__ ,溶液C为___ 。
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:
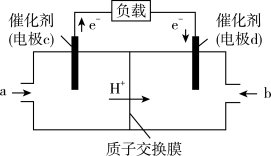
电池总反应为2CH3OH+3O2=2CO2+4H2O,则d电极是__ (填“正极”或“负极”),c电极的反应方程式为__ 。若线路中转移1mol电子,则上述CH3OH燃料电池消耗的O2在标准状况下的体积为__ L。

(1)若C为稀H2SO4,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A(正极)极材料为
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:

电池总反应为2CH3OH+3O2=2CO2+4H2O,则d电极是
您最近一年使用:0次
2020-06-23更新
|
555次组卷
|
3卷引用:湖北省黄冈市黄州区第一中学2019-2020学年高一下学期6月月考化学试题
名校
解题方法
6 . Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOCl2=4LiCl+S+SO2。请回答下列问题:
(1)电池的负极材料为_____ ,发生的电极反应为______________ 。
(2)电池正极发生的电极反应为_______________ 。
(1)电池的负极材料为
(2)电池正极发生的电极反应为
您最近一年使用:0次
7 . (1)已知拆开1molH-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mol NH3时反应放出___________ kJ 的热量。
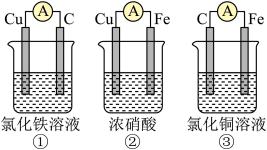
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的的是________ (填序号)。
(3)直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。
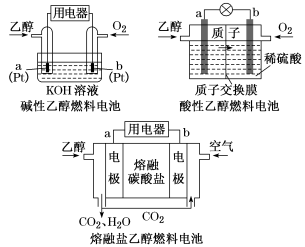
①三种乙醇燃料电池中正极反应物均为______________________ ;
②碱性乙醇燃料电池中,电极a上发生的电极反应式为_______________________________ ;
③熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,电极b上发生的电极反应式为______________________________ 。
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的的是

(3)直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。

①三种乙醇燃料电池中正极反应物均为
②碱性乙醇燃料电池中,电极a上发生的电极反应式为
③熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,电极b上发生的电极反应式为
您最近一年使用:0次
2018-08-19更新
|
396次组卷
|
4卷引用:【校级联考】湖北省孝感市六校2018-2019学年高二上学期12月月考化学试题
【校级联考】湖北省孝感市六校2018-2019学年高二上学期12月月考化学试题湖南省醴陵市第一中学2017-2018学年高一下学期期末考试化学试题(已下线)2019年4月10日《每日一题》 必修2 新型原电池分析河北省唐山市海港高级中学2019-2020学年高一下学期第五次校考化学试题
真题
名校
8 . 锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。 回答下列问题:
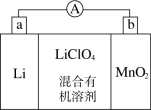
(1)外电路的电流方向是由________ 极流向________ 极(填字母)。
(2)电池正极反应式为___________________________________ 。
(3)是否可用水代替电池中的混合有机溶剂?________ (填“是”或“否”),原因是________________________________________________________________ 。
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为_______________________________________________ 。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为___________ 。

(1)外电路的电流方向是由
(2)电池正极反应式为
(3)是否可用水代替电池中的混合有机溶剂?
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为
您最近一年使用:0次
2016-12-09更新
|
4988次组卷
|
15卷引用:湖北省沙市中学2018届高三上学期第二次双周考试化学试题
湖北省沙市中学2018届高三上学期第二次双周考试化学试题2014年全国普通高等学校招生统一考试理科综合能力测试化学(海南卷)(已下线)2014-2015学年黑龙江省哈尔滨市第六中学高二10月月考化学试卷河北省张家口市第一中学2016-2017学年高一(衔接班)6月月考(理)化学试题福建省惠安惠南中学2017-2018学年高二10月月考(理)化学试题河南省郑州市第一中学2018-2019学年高二上学期入学测试化学试题(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(教学案)(已下线)2019高考备考二轮复习精品资料-专题10 电化学及其应用(教学案)湖南省双峰县第一中学2018-2019学年高一6月月考化学试题安徽省淮北市第一中学2019-2020学年高一下学期第二次线上学习考试(3月)化学试题山东省德州市齐河县实验中学2019-2020学年高一下学期期中考试化学试题人教版(2019)高二选择性必修第一册 第四章 化学反应与电能 第一节 原电池 教材帮浙江省宁波市北仑中学2020-2021学年高一下学期期中考试化学(1班选考)试题河南省新蔡县第一高级中学2020-2021学年高一下学期5月月考化学试题黑龙江省大兴安岭呼玛县高级中学2021-2022学年高二上学期期末考试化学试题



